Введение
Хронический запор (ХЗ) — распространенная проблема, которая затрагивает значительную долю населения и при этом остается как недостаточно диагностируемой, так и недооцененной с точки зрения влияния на течение коморбидных патологий [1]. Для запора характерно не только уменьшение частоты стула (менее 3 раз в нед.), но и изменение его консистенции — 1 и 2 тип по Бристольской шкале, а также дефекация небольшими порциями, ощущение неполного опорожнения кишечника и необходимость избыточного натуживания, присутствующие в течение не менее 3 мес.[1]
[2]. При ХЗ зачастую появляется потребность в постоянном приеме слабительных препаратов или необходимость проведения манипуляций, облегчающих дефекацию.
С патофизиологических позиций выделяют первичный (функциональный) и вторичный запор. Первичный запор подразделяется на запор с замедленным транзитом, диссинергическую дефекацию и запор с нормальным транзитом. Вторичный запор развивается на фоне приема лекарственных средств (антагонисты кальция, опиоиды, препараты железа, агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1) и др.), эндокринных, неврологических и системных заболеваний, особенностей питания, а также в связи с механическим препятствием прохождению каловых масс1.
Распространенность запора среди взрослого населения составляет около 19% [1], при этом у пожилых пациентов в возрасте от 60 до 110 лет этот показатель может достигать 33,5% [3], а по отдельным данным — 80% [3, 4].
Несмотря на распространенность проблемы, лишь немногие пациенты обращаются за медицинской помощью. Так, в исследовании А. Tamura et al. [5] было показано, что только около 5% пациентов с ХЗ обращаются к врачу. Это может быть обусловлено как стигматизацией темы дефекации, так и распространенностью самолечения. В свою очередь, врачи при сборе анамнеза не всегда уточняют у пациента частоту стула и наличие проблем с дефекацией, что приводит к низкому уровню выявления и отсроченному началу лечения данной патологии [3, 5]. Нередко пациент, обратившийся за врачебной помощью с проблемой ХЗ, ранее уже использовал различные методы нормализации стула, включая диету с увеличенным объемом клетчатки и воды, применение доступных слабительных средств, в связи с чем для врача особенно актуальным становится вопрос подбора рациональной лекарственной терапии.
Несмотря на обилие диагностических критериев, для рутинного скрининга ХЗ, как правило, достаточно всего двух вопросов: «Частота Вашего стула менее 3 раз в неделю?» и «Приходится ли Вам сильно тужиться при дефекации?» [2, 6, 7]. Положительный ответ на оба вопроса подтверждает наличие запора у пациента. Важно отметить, что симптомы должны присутствовать в течение по крайней мере последних 3 мес.
Имеющиеся на сегодня данные отчетливо свидетельствуют о том, что ХЗ ассоциирован не только с ухудшением качества жизни и снижением работоспособности, но и с повышенным риском неблагоприятных исходов у пациентов с хроническими заболеваниями. В последние годы накоплены доказательства двусторонней связи между запором и сердечно-сосудистыми заболеваниями (ССЗ), сахарным диабетом 2 типа (СД2), ожирением, гипотиреозом и неалкогольной жировой болезнью печени (НАЖБП). В крупном когортном исследовании было показано повышение риска сердечно-сосудистых событий в 6,5 раза при сочетании ХЗ и артериальной гипертонии (АГ) [8], другое исследование продемонстрировало, что наличие запора ассоциировалось с увеличением риска ишемического инсульта на 39%, но не с риском геморрагического инсульта [9]. Также данный эффект не наблюдался у женщин [9]. У больных СД2 наличие запора было ассоциировано с увеличением частоты диабетической нейропатии (49% против 32% у пациентов без запоров) и ишемической болезни сердца (ИБС) (27% против 13% у пациентов без запоров) [10].
Ключевым патогенетическим звеном, объединяющим ХЗ и кардиометаболические нарушения, признана дисбиоз-опосредованная дисфункция «синдром повышенной эпителиальной проницаемости — системное воспаление». У больных запором отмечается снижение численности лакто- и бифидобактерий, рост условно-патогенной флоры, снижение продукции короткоцепочечных жирных кислот (КЖК), прежде всего бутирата [11–13]. Дефицит КЖК приводит к уменьшению экспрессии белков плотных контактов, повышению кишечной проницаемости, транслокации бактериальных липополисахаридов (ЛПС) и развитию системного воспаления низкой степени [14]. Последнее, в свою очередь, ассоциировано с эндотелиальной дисфункцией, инсулинорезистентностью и активацией симпатоадреналовой системы, что ухудшает течение ССЗ, СД2 и ожирения.
Таким образом, проблема ХЗ выходит далеко за рамки гастроэнтерологии, формируя взаимно отягощающий каскад с кардиометаболической патологией. Разрыв этого порочного круга возможен при условии активного скрининга, начиная с общетерапевтического приема, и раннего назначения патогенетически обоснованной терапии, способной одновременно нормализовать транзит по толстой кишке и модулировать микробный пейзаж кишечника.
В российских национальных клинических рекомендациях предлагается ступенчатый подход к лечению запора, и в качестве препаратов первой линии медикаментозной терапии указана группа осмотических слабительных1. Среди них можно выделить лактулозу, которая, расщепляясь микробиотой кишечника до лактата и бутирата, восстанавливает объем и консистенцию стула, нормализует моторику и одновременно способствует росту числа «полезных» бактерий. Благодаря наличию у лактулозы пребиотических свойств, способствующих нормализации микробиоты кишечника, препарату свойственно развитие эффекта последействия. Так, в одном из исследований после 4 нед. приема препарата было отмечено сохранение эффекта в отношении регулярного стула до 4 мес. [15]. Сходные данные были получены в ходе исследования, проведенного в педиатрической популяции, где после курса приема лактулозы отмечалось отсутствие запора до 6 мес. [15, 16].
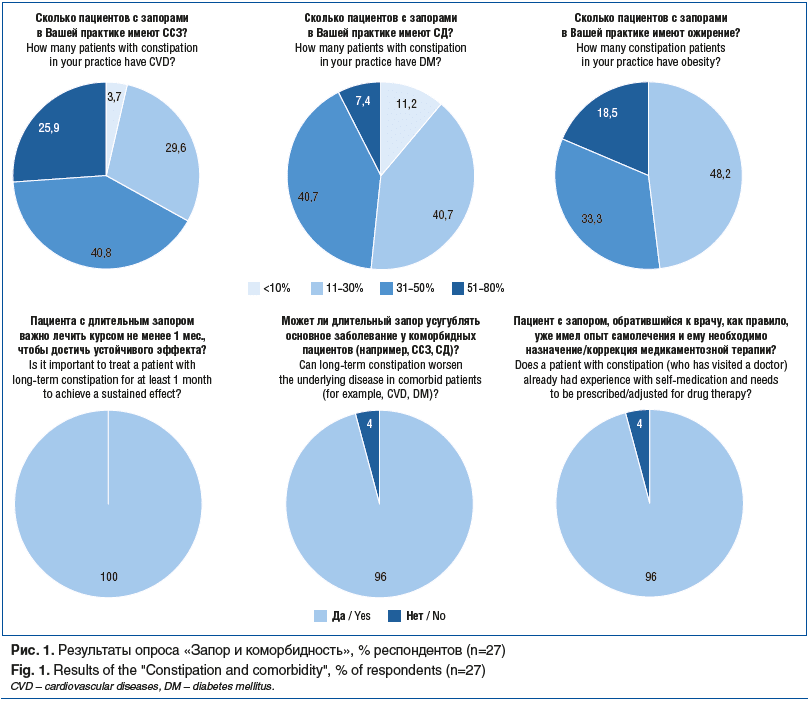
Цель обзора: систематизировать и критически оценить современные научные данные о взаимосвязи ХЗ с кардио-метаболической коморбидностью, а также сопоставить их с текущей оценкой проблемы на основании данных, полученных в ходе опроса специалистов здравоохранения «Запор и коморбидность», проводившегося в мае 2025 г. с участием 27 главных внештатных специалистов-гастроэнтерологов и ведущих экспертов в гастроэнтерологии (рис. 1). Кроме того, была поставлена задача определить оптимальные терапевтические подходы к лечению пациентов с данными состояниями.
Содержание статьи
Запор и ССЗ
Хронический запор тесно связан с ССЗ, образуя двусторонний патогенетический каскад: запор и модуляция микробиоты ® системное воспаление ® эндотелиальная дисфункция [17]. Дисбиоз, характерный для ХЗ, сопровождается снижением численности Bifidobacterium и Faecalibacterium, уменьшением продукции КЖК и ослаблением экспрессии белков плотных контактов кишечного эпителия. Повышенная проницаемость слизистой облегчает транслокацию ЛПС, что активирует провоспалительные каскады [11], индуцируя системное воспаление и последующее повреждение сосудистого эндотелия, что ускоряет процесс атерогенеза. Вегетативная нервная система играет важную роль в регуляции как вариабельности артериального давления (АД), так и процесса дефекации. Связь повышенной вариабельности АД и запоров может быть показателем автономной дисфункции. На этом фоне натуживание при дефекации действует как триггер, повышая АД (рис. 2).
![Рис. 2. Взаимосвязь запора и ССЗ (адаптировано из [17, 18]) Fig. 2. Association between constipation and CVD (adapted from [17, 18]) Рис. 2. Взаимосвязь запора и ССЗ (адаптировано из [17, 18]) Fig. 2. Association between constipation and CVD (adapted from [17, 18])](https://medblog.su/wp-content/uploads/2025/10/1760605837_573_Zapor-kishechnaya-mikrobiota-i-komorbidnaya-patologiya-poisk-optimalnogo-podhoda-k.png)
Связь ХЗ и ССЗ усугубляется часто назначаемыми пациентам с ССЗ лекарственными средствами, которые могут быть причиной вторичного запора. Так, блокаторы кальциевых каналов и β-адреноблокаторы снижают моторику гладких мышц кишечника; тиазидные и петлевые диуретики вызывают дегидратацию и гипокалиемию, что усиливает атонию кишки; секвестранты желчных кислот повышают вязкость кишечного содержимого; опиоидные анальгетики, используемые в онкологической практике, прямо подавляют перистальтику. С запором также связан прием других лекарственных препаратов, которые могут использоваться в том числе у пациентов с ССЗ: антихолинергические препараты, препараты железа, антидепрессанты [19]. Таким образом, медикаментозное лечение пациентов с ССЗ как основным или сопутствующим заболеванием нередко провоцирует или усугубляет запор, который в свою очередь приводит к повышению АД и увеличивает сердечно-сосудистые риски [20–22].
По данным японского популяционного исследования, запор наблюдали у 47% больных с ССЗ [17]. В другом когортном исследовании, в котором ретроспективно оценили более 3,3 млн карт ветеранов [23], было показано, что запоры ассоциировались с увеличением риска смертности от всех причин на 12%, ишемического инсульта — на 19%. Частота встречаемости АГ у пациентов без запоров составляла 58,8%, тогда как у пациентов с запорами — 71,5%. Таким образом, запоры ассоциируются со значительным увеличением риска ССЗ. Это подтверждается и данными реальной клинической практики экспертов-гастроэнтерологов согласно проведенному опросу «Запор и коморбидность» —более 60% респондентов отметили, что от 30 до 80% пациентов с запорами имеют ССЗ (см. рис. 1).
С учетом того, что распространенность запоров увеличивается с возрастом, а у пожилых людей часто встречается сопутствующая сердечно-сосудистая патология, при выборе терапии для кардиологических пациентов следует отдавать предпочтение осмотическим слабительным с низким потенциалом лекарственных взаимодействий. Лактулоза, действующая в просвете кишки и не влияющая на систему цитохромов P450, не ухудшает фармакокинетику антикоагулянтов, антиагрегантов и статинов [24]. Таким образом, у пациентов с АГ, ИБС и сердечной недостаточностью лактулоза позволяет нормализовать толстокишечный транзит и не оказывает влияния на эффективность препаратов базисной терапии.
Особое значение имеет доказанный профиль безопасности лактулозы у пожилых пациентов с ССЗ. В открытом исследовании А.В. Тимофеевой и соавт. [25] с участием 32 пациентов ≥65 лет (средний возраст 72,8±1,5 года) была продемонстрирована эффективность и безопасность применения лактулозы (Дюфалак) с оценкой эффективности препарата на 3-й и 14-й дни лечения. У большинства пациентов на 3-й день на фоне проводимой терапии значимо уменьшались проявления ХЗ (с 7,4±0,1 до 1,0±0,3 балла), а на 14-й день терапии у 96,8% пациентов исчезли практически все симптомы ХЗ (p<0,001). У всех пациентов за период наблюдения были выявлены положительная динамика гемодинамических показателей и повышение толерантности к физическим нагрузкам. Препарат в целом хорошо переносился. Ни у кого из пациентов не возникло статистически значимых отклонений от исходных биохимических показателей крови (печеночные ферменты, липиды, глюкоза, электролиты, мочевина, креатинин). Эти данные подтверждают, что лактулоза может безопасно использоваться у полиморбидных пожилых пациентов, обеспечивая мягкое осмотическое действие без риска межлекарственных взаимодействий.
Таким образом, ХЗ встречается почти у половины пациентов с ССЗ и существенно увеличивает риск неблагоприятных сердечно-сосудистых исходов. Клиническая значимость проблемы требует рутинного скрининга с использованием двух вопросов и раннего назначения безопасной, патогенетически обоснованной терапии, первой линией которой остается лактулоза.
Запор и СД2
В исследованиях показано, что ХЗ является наиболее распространенным желудочно-кишечным симптомом СД, однако патогенез остается не до конца изученным. Существует ряд потенциальных факторов риска запора у пациентов с СД, включая гипергликемическую полиурию, которая приводит к дегидратации, диабетическую нейропатию и миопатию, психологический стресс и образ жизни (снижение физической активности, питание с ограничением углеводов и продуктов, богатых клетчаткой) [26]. Взаимосвязь запора и СД нашла отражение и в результатах опроса «Запор и коморбидность» — 80% респондентов отметили, что у пациентов с запором СД встречается в 11–50% случаев (см. рис. 1).
Кроме того, в последние годы появились новые лекарственные препараты, которые могут влиять на функцию пищеварительного тракта, вызывая запор, в частности агонисты рецепторов ГПП-1 [27, 28]. Так, в инструкции по медицинскому применению семаглутида запор указан как частая нежелательная реакция.
В ретроспективном исследовании с участием 1339 пациентов с СД2, опубликованном в 2025 г., показано, что запоры ассоциировались с увеличением риска смертности от всех причин в 1,5 раза (отношение шансов 1,50, 95% доверительный интервал 1,01–2,22) [29]. Авторы исследования указывают на несколько потенциальных механизмов, которые могут лежать в основе связи между запором и повышенным риском смерти при СД2. Запор может быть проявлением автономной нейропатии, а также может быть ассоциирован с нарушением вегетативного контроля сердечно-сосудистой системы и повышенной восприимчивостью к скрытой ишемии миокарда [30–32].
Кроме того, запор тесно связан с дисбиозом кишечника [33, 34], что отрицательно влияет на гликемический контроль, усугубляет системное воспаление и нарушает энергетический обмен веществ — все эти процессы являются критически важными факторами при СД2 и его осложнениях [35, 36]. Вследствие нарушения барьерной функции кишечника у пациентов с СД2 происходит транслокация кишечной микробиоты и ее токсинов [37]. Помимо этого, нарушение состава кишечной микробиоты влияет на эффективность сахароснижающей терапии [38]: микробиота влияет на эффект от терапии через продукцию КЖК и оксида азота, регуляцию рецепторов ГПП-1, а поддержание микробного баланса способствует эффективности сахароснижающих препаратов.
Таким образом, для лечения запоров у пациентов с СД2 важным аспектом является гармонизация микробиома кишечника. Известно, что благодаря пребиотическим свойствам лактулоза способствует повышению представленности Bifidobacterium, Lactobacilus и Akkermansia muciniphila [39], параллельно снижая долю условно-патогенных бактерий. Важно отметить, что лактулоза гликемически нейтральна, что подтверждается данными исследования пациентов с СД2 и запором: уровни глюкозы в крови после приема 20 и 30 г кристаллической или жидкой лактулозы не изменялись [40].
Запор и ожирение
Ожирение и ХЗ часто сосуществуют, формируя патофизиологический круг. Согласно данным опроса от мая 2025 г. больше половины экспертов-гастроэнтерологов считают, что от 30 до 80% пациентов с запором имеют ожирение (см. рис. 1). В качестве взаимоотягощающих факторов риска между ХЗ и ожирением можно выделить гиподинамию, рацион с низким содержанием клетчатки и диету с большой долей продуктов высокой степени переработки. Другим связующим фактором может быть системное воспаление, характерное как для запоров, так и для ожирения [11, 41]. Гипертрофированная жировая ткань продуцирует провоспалительные адипокины и одновременно снижает секрецию адипонектина, формируя субклиническое воспаление, способствуя оксидативному стрессу и инсулинорезистентности. Задержка транзита при запоре в свою очередь усугубляет дисбиоз, модулируя метаболизм в кишечнике и повышая уровни аммиака, фенолов и вторичных желчных кислот, что усиливает провоспалительные цитокиновые каскады. Кишечный барьер представляет собой динамическую систему, на которую влияют состав кишечного микробиома, межклеточные связи, регулируемые гормонами, диетой и воспалительными компонентами. Нарушение этого барьера называется синдромом «дырявого кишечника» (синдром повышенной эпителиальной проницаемости) и характеризуется выбросом бактериальных метаболитов и эндотоксинов, таких как ЛПС, в кровоток [42]. Транслокация ЛПС повышает эндотоксемию и поддерживает хроническое воспаление, принимающее участие в патогенезе ожирения.
Другой возможный механизм, связывающий запоры и ожирение, включает нейропептиды кишечника и мозга, причем такие нейропептиды, как лептин, грелин, холецистокинин и ГПП-1, играют ключевую роль в контроле чувства голода и сытости, а также моторики желудочно-кишечного тракта. Нейропептиды могут ускорять транзит в толстой и тонкой кишке и оказывать мощное прокинетическое действие. Уровень грелина у людей с нормальной массой тела выше, чем у людей с ожирением [43].
Одна из важнейших функций кишечной микробиоты — расщепление пищевых волокон, конечным продуктом ферментации которых являются КЖК, выступающие субстратом для многих тканей: они участвуют в глюконеогенезе в печени, служат основным источником энергии для колоноцитов, являются лигандами G-протеинсвязывающих рецепторов. У людей с ожирением отмечено снижение количества бутиратпродуцирующих бактерий, уровня КЖК, лакто- и бифидобактерий, причем уровень абсолютного содержания всех КЖК имеет обратную умеренную корреляцию со значением индекса массы тела [44].
Таким образом, запор и ожирение представляют собой состояния, связанные через микробиоту, барьерную функцию кишечника, системное воспаление и метаболизм КЖК. Терапевтические стратегии при этом должны быть направлены на нормализацию регулярного ритма дефекации, восстановление микробиома и повышение продукции КЖК. Следовательно, лактулоза способна решить все эти задачи и разорвать патогенетический круг, улучшив метаболический прогноз пациентов.
Запор и НАЖБП
Неалкогольная жировая болезнь печени является одним из наиболее распространенных хронических заболеваний печени в мире, встречаясь примерно у 37,1% взрослого населения, при этом частота заболевания значительно выше у пациентов с СД2 и метаболическим синдромом [45, 46].
Несмотря на недостаток прямых эпидемиологических исследований, посвященных сочетанию запора и НАЖБП, существующие данные указывают, что по мере повышения тяжести НАЖБП (увеличение степени стеатоза, переход к неалкогольному стеатогепатиту (НАСГ) и последующему фиброзу) наблюдается тенденция к увеличению частоты запора и других кишечных симптомов. В одном из когортных исследований, включавшем пациентов с НАЖБП, кишечные расстройства в соответствии с Римскими критериям IV были выявлены у 20,4% обследованных, при этом функциональный запор встречался у 34,4% из них [47]. Таким образом, наличие ХЗ у пациентов с НАЖБП — частое явление, которое заслуживает целенаправленного поиска и специализированного подхода к диагностике и последующему ведению данной категории больных.
Патогенетические механизмы, связывающие два состояния, реализуются преимущественно через взаимодействие по оси «кишечник — печень», вовлекая метаболические, микробиотические и воспалительные компоненты. У пациентов с НАЖБП и сопутствующим запором отмечается значимое нарушение гомеостаза кишечника, что обеспечивает двустороннее неблагоприятное влияние этих состояний друг на друга. Одним из ключевых механизмов выступает нарушение барьерной функции кишечника, связанное с дисбиозом при НАЖБП: снижается экспрессия белков плотных контактов, возрастает проницаемость эпителия, что облегчает транслокацию бактериальных эндотоксинов (в первую очередь ЛПС) в печень по воротной вене. Это индуцирует хроническое воспаление и способствует прогрессированию стеатоза до стеатогепатита и фиброза печени [48, 50]. Ввиду этого для терапии пациентов с НАЖБП и сопутствующим запором наиболее рациональным выбором среди препаратов слабительного ряда является лактулоза в связи с наличием у нее дополнительного пребиотического действия.
Роль микробиоты в патогенезе НАЖБП также изучалась в рамках экспериментального исследования на модели НАСГ у крыс [50]. Подопытные животные были случайным образом разделены на модельную группу (24 крысы), группу терапии (12 крыс) и контрольную группу (6 крыс). Крысы модельной группы и группы терапии получали высокожировой рацион, контрольная группа — обычный рацион. Спустя 8 нед. животным группы терапии стали вводить лактулозу. Забор материала для гистологического исследования проводили через 16 нед. во всех группах, вместе с тем часть животных модельной группы были препарированы через 8 нед. У всех крыс модельной группы были обнаружены признаки стеатогепатита и повышение содержания трансаминаз в сыворотке крови. В группе терапии уровни аланинаминотрансферазы и аспартатаминотрансферазы, а также показатели активности воспалительного процесса в печени были значимо ниже по сравнению с модельной группой, однако степень стеатоза печени достоверно не различалась.
Обсуждая дисбиоз при НАЖБП, важно подчеркнуть, что он характеризуется снижением представленности Firmicutes (продуцентов КЖК) и увеличением доли условно-патогенных штаммов. Дефицит КЖК (бутирата, пропионата, ацетата) приводит к угнетению моторики кишечника и секреторной функции, что патогенетически способствует развитию запора [49]. Повышенная активность этанолпродуцирующих бактерий (например, Escherichia) усиливает местное воспаление и снижает эффективность барьерных механизмов тонкой и толстой кишки.
Метаболический синдром и инсулинорезистентность, характерные для большинства пациентов с НАЖБП, в свою очередь оказывают негативное влияние на моторику кишечника за счет нарушения нейрогуморальной регуляции, а также способствуют системному высвобождению провоспалительных цитокинов (фактор некроза опухоли α, интерлейкин 6), что дополнительно усугубляет дисфункцию нервной системы и ведет к формированию хронического запора [51, 52].
Запор у пациентов с НАЖБП представляет собой дополнительный клинический фактор риска, способный негативно влиять на течение основного заболевания и прогноз. Сочетание запора и НАЖБП сопровождается более выраженными симптомами, такими как вздутие живота, абдоминальный болевой синдром, утомляемость, что достоверно снижает качество жизни и увеличивает риск развития желудочно-кишечных осложнений [48, 49, 53]. Запор может снижать результативность усилий по изменению образа жизни за счет медиаторного воздействия на углеводный и липидный обмен, а также ограничивать эффект пробиотических или пребиотических препаратов из-за воздействия на состав и функциональность микробиоты.
Лактулоза может оказывать многоуровневое терапевтическое действие у пациентов с запором и НАЖБП, так как дополнительно выступает в качестве фактора нормализации микробиоты кишечника за счет продукции КЖК, которые в свою очередь оказывают противовоспалительный эффект, восстанавливают нарушенный кишечный барьер и уменьшают эндотоксемию. Интерес представляет также детоксицирующее действие КЖК, которое реализуется за счет превращения аммиака в свободные ионы аммония и их последующего выведения с калом [19], что может быть особенно важно для пациентов с запором и НАЖБП. Уменьшение гипераммониемии позволяет снизить нагрузку на печень [54] и потенциально уменьшить прогрессирование НАЖБП до НАСГ. Кроме того, лактулоза не взаимодействует с препаратами, применяемыми у пациентов с НАЖБП и сопутствующими СД2 и дислипидемией, включая гипо-гликемические и гиполипидемические средства [24].
Оптимизация терапии для коморбидных пациентов с ХЗ
Регуляция моторики толстой кишки определяется комплексным взаимодействием нервной системы, гладкомышечных клеток и гуморальных модуляторов. Дисфункция этих звеньев ослабляет пропульсивные сокращения толстой кишки, а дисбиотический сдвиг с дефицитом бутиратсинтезирующих бактерий усугубляет проблему, снижая трофику слизистой и разрушая плотные межклеточные контакты [55, 56]. Транслокация ЛПС поддерживает активацию провоспалительных каскадов, что ухудшает контроль основного заболевания и снижает ответ на стандартную терапию. Согласно опросу «Запор и коморбидность» более 90% респондентов ответили, что запор может усугублять течение основного заболевания у коморбидных пациентов, а также что пациенты с запором, которые обратились на прием, уже имели ранее опыт самолечения и им требуется назначение или коррекция медикаментозной терапии (см. рис. 1).
Несмотря на то, что данные исследований демонстрируют снижение риска ХЗ при потреблении ≥25 г пищевых волокон в сутки и достаточной физической активности [4, 57], существуют отдельные работы, согласно которым пациенты отмечают ухудшение симптомов запора при слишком большом количестве пищевых волокон в их рационе [58]. Основными проблемами, по мнению пациентов, являются:
отсутствие достаточного эффекта пищевых волокон;
увеличение твердости каловых масс — в результате процесс дефекации осложняется;
вздутие живота и неприятные ощущения в животе, повышенное газообразование с колющей болью или без нее;
трудности при глотании, что может вызывать рвоту;
диарея при чрезмерном потреблении волокон.
Также следует учитывать, что согласно инструкции пищевые волокна (например, псиллиум) следует размешивать в большом количестве жидкости (не менее 150 мл) и принимать несколько раз в день, разводить во времени с приемом препаратов для терапии основного заболевания, а для пациентов с СД может потребоваться коррекция дозы гипогликемических препаратов.
Вместе с тем с позиции российских клинических рекомендаций псиллиум рассматривается как диетотерапия, а не как средство для консервативного медикаментозного лечения1. Обсуждая подход к ведению пациентов с запором с позиции клинических рекомендаций, следует отметить, что терапией первой линии являются осмотические слабительные средства, а минимальный рекомендованный курс должен составлять 4–6 нед.1, тогда как лечение менее 1 мес. недостаточно для стойкого восстановления моторики, ремодуляции микробиоты и формирования стабильной привычки к дефекации.
Важность длительного курса терапии запора также подчеркивает опрос «Запор и коморбидность»: все респонденты были согласны с тем, что длительность терапии запора должна составлять ≥4 нед. (см. рис. 1). По мнению респондентов, наиболее важными критериями выбора препарата для коморбидного пациента являются низкая вероятность межлекарственных взаимодействий для реализации сочетаемости с терапией основного заболевания, способность обеспечивать длительный эффект нормализации стула, возможность принимать препарат без ограничения по длительности и влияние препарата на нормализацию микробиоты кишечника (рис. 3).

Данным характеристикам в полной мере отвечает слабительное на основе лактулозы (Дюфалак). В рандомизированном исследовании с участием 65 больных ХЗ было продемонстрировано, что 28-дневный курс лактулозы увеличивал долю Bifidobacterium, тогда как полиэтиленгликоль (ПЭГ 4000) снижал общий пул КЖК, включая бутират [59]. Таким образом, и лактулоза, и ПЭГ были эффективны и хорошо переносились, однако лактулозу можно считать предпочтительной для применения у коморбидных пациентов, учитывая ее влияние на восстановление микробиоты кишечника.
Важно отметить, что лактулоза характеризуется отсутствием риска межлекарственных взаимодействий с другими препаратами, что также является важным фактором при выборе терапии для коморбидных пациентов. В то же время, как указано в инструкции по медицинскому применению, прием ПЭГ 4000 может снижать абсорбцию других лекарственных препаратов, особенно средств с узким терапевтическим индексом или коротким периодом полувыведения, таких как дигоксин, противоэпилептические средства, кумарины и иммунодепрессанты, что приводит к снижению их эффективности. Как уже отмечалось выше, лактулозу возможно применять у коморбидных пациентов пожилого возраста и пациентов с СД2 [25, 40]. Инструкция допускает прием всей суточной дозы лактулозы однократно, что удобно для больных, уже получающих многокомпонентную терапию, тогда как ПЭГ и диетический псиллиум требуют большего объема жидкости и частых приемов, что снижает приверженность лечению.
Более 90% респондентов опроса «Запор и коморбидность» также были согласны с тем, что лактулоза (Дюфалак) является оптимальным выбором для коморбидного пациента, препарат подходит для длительного применения и не вызывает привыкания.
Таким образом, экспертный консенсус и клинические данные сходятся в том, что лактулоза удовлетворяет всем перечисленным требованиям, обеспечивая мягкое физиологичное послабление, а также благоприятно воздействуя на микробиоту кишечника, что в долгосрочной перспективе может снизить воспалительную нагрузку и улучшить прогноз у пациентов с коморбидными заболеваниями.
В терапии запора лактулоза сочетает прямое осмотическое действие с доказанным пребиотическим эффектом. Механизм действия лактулозы связан с ферментацией в просвете толстой кишки до КЖК — ацетата, пропионата, бутирата, лактата. Снижение рН стимулирует осмотический градиент, повышает содержание воды в стуле и активирует механочувствительные рецепторы стенки кишки, инициируя пропульсивные рефлексы. Наряду с этим КЖК ингибируют транскрипцию провоспалительных генов и способствуют восстановлению кишечного барьера [60, 61]. Эти механизмы критичны для пациентов с ССЗ, ожирением, СД2 и НАЖБП, где барьерная дисфункция и эндотоксемия усиливают инсулинорезистентность и системное воспаление [62]. Лактулоза не всасывается в тонкой кишке, действует исключительно в просвете кишечника, не ингибирует ферментные системы печени и не изменяет почечный клиренс совместно назначаемых препаратов, что делает препарат универсальным звеном многокомпонентной фармакотерапии.
Современная концепция ведения коморбидного пациента с ХЗ должна учитывать влияние основного заболевания на симптомы запора, выбор безопасного осмотического препарата с доказанной эффективностью при длительном применении и отсутствием лекарственных взаимодействий и комплексную коррекцию образа жизни. Совокупно имеющиеся данные обосновывают выбор лактулозы как препарата первой линии у коморбидных пациентов: она эффективна, безопасна при длительном применении, не взаимодействует с наиболее часто применяемыми при кардиометаболических заболеваниях лекарственными препаратами и обладает уникальным пребиотическим потенциалом.
Заключение
Хронический запор — часто встречающееся заболевание, которое может сопутствовать кардиометаболической патологии (АГ, ожирение, СД2, НАЖБП). Клинические и эпидемиологические данные позволяют сделать вывод, что своевременная коррекция запора может снизить сердечно-сосудистые риски, риски осложнений СД2, а также прогрессирования НАЖБП и ухудшения качества жизни. Лактулоза (Дюфалак) является препаратом, сочетающим двойной механизм действия: 1) осмотический эффект, обеспечивающий размягчение и выведение стула за счет локального повышения осмолярности; 2) пребиотическое действие, в том числе способствующее развитию противовоспалительного эффекта вследствие снижения уровня медиаторов воспаления. Сравнительные исследования показывают, что при сопоставимой с другими слабительными препаратами эффективности, лактулоза обладает достоинствами, особенно важными для коморбидных пациентов: минимальный риск межлекарственных взаимодействий, отсутствие влияния на гликемию, длительный эффект в нормализации стула (до 4 мес. нормализации стула после 4-недельного курса), отсутствие привыкания и удобство применения. Лактулоза отмечена в национальных клинических рекомендациях по ведению пациентов с запором как осмотическое слабительное первой линии, курс которого должен длиться не менее 4–6 нед.
Таким образом, лактулоза (Дюфалак) является препаратом с мягким слабительным эффектом и высоким профилем безопасности, что делает его оптимальным выбором у пациентов при сочетании запора с другими хроническими заболеваниями.
Сведения об авторах:
Ливзан Мария Анатольевна — член-корр. РАН, д.м.н., профессор, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017
Бордин Дмитрий Станиславович — д.м.н., заведующий отделом патологии поджелудочной железы, желчных путей и верхних отделов пищеварительного тракта ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, Энтузиастов ш., д. 86, стр. 6; профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии лечебного факультета НОИ клинической меди-
цины ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; профессор кафедры общей врачебной практики и семейной медицины ФПДО ФГБОУ ВО Тверской ГМУ Минздрава России; 170100, Россия, г. Тверь, ул. Советская, д. 4; ORCID iD 0000-0003-2815-3992
Абдулхаков Сайяр Рустамович — к.м.н., заведующий кафедрой внутренних болезней Института фундаментальной медицины и биологии ФГАОУ ВО Казанский (Приволжский) федеральный университет; 420008, Россия, г. Казань, ул. Кремлевская, д. 18; доцент кафедры поликлинической терапии и общей врачебной практики ФГБОУ ВО Казанский ГМУ Минздрава России 420012, Россия, г. Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0001-9542-3580
Контактная информация: Ливзан Мария Анатольевна, e-mail: mlivzan@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 12.07.2025.
Поступила после рецензирования 05.08.2025.
Принята в печать 28.08.2025.
About the authors:
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Faculty Therapy and Gastroenterology, rector, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017
Dmitry S. Bordin — Dr. Sc. (Med.), Head of the Department of Pathology of the Pancreas, Biliary Tract and Upper Digestive Tract, A.S. Loginov Moscow Clinical Scientific Center; 1 build. 1, Novogireevskaya str., Moscow, 111123, Russian Federation; Professor of the Department of Propaedeutics of Internal Diseases and Gastroenterology of the Faculty of Medicine of the Institute of Clinical Medicine, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; Professor of the Department of General Medical Practice and Family Medicine, Tver State Medical University; 4, Sovetskaya str., Tver, 170100, Russian Federation; ORCID iD 0000-0003-2815-3992
Sayyar R. Abdulkhakov — C. Sc. (Med.), Head of the Department of Internal Diseases at the Institute of Fundamental Medicine and Biology, Kazan (Volga Region) Federal University; 18, Kremlevskaya str., Kazan, 420008, Russian Federation; Associate Professor of the Department of Outpatient Therapy and General Medical Practice, Kazan State Medical University; 49, Butlerova str., Kazan, 420012, Russian Federation; ORCID iD 0000-0001-9542-3580
Contact information: Maria A. Livzan, e-mail: mlivzan@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 12.07.2025.
Revised 05.08.2025.
Accepted 28.08.2025.
[1] Клинические рекомендации. Запор 2024. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/274_3 (дата обращения: 5.07.2025).
Информация с rmj.ru



