Содержание статьи
Диагностика и прогнозирование развития атрофического гастрита с помощью математической модели
А.М. Субботин, С.А. Блашенцева, Д.К. Тюмиков, Н.Н. Савченков
Городская больница № 13, г. Нижний Новгород
Самарский государственный университет путей сообщения
С целью улучшения диагностики и прогноза развития атрофических изменений слизистой желудка у больных гастроэнтерологического профиля установлены частота и степень эндоскопических и морфологических признаков. На основании результатов комплексного обследования создана математическая модель, использование которой помогает в амбулаторных условиях установить правильный диагноз и прогноз развития поражений желудка.
По данным литературы последних лет, определяется повышенный интерес к проблеме диагностики атрофического гастрита как предракового заболевания желудка. Каскад патологических явлений в качестве модели развития рака желудка предложил в 1988 году Р. Соrrеа [1], однако в то время в этой модели не нашлось места для H. рylori. Двумя годами позже автор ввел H. рylori в качестве этиологической причины гастрита и соответственно рака желудка [2]. Таким образом, геликобактериоз, хронический гастрит, кишечная метаплазия, атрофия и рак желудка — звенья одной цепи, в которой инициирующую роль играет микроорганизм. В ответ на инвазию у человека развивается хронический воспалительный процесс в слизистой оболочке, сопровождающийся дисрегенеторными изменениями эпителия, создающими в свою очередь фон для развития рака желудка кишечного типа [3]. Именно кишечная метаплазия и атрофия слизистой оболочки создают предпосылки для дисплазии эпителия — практически облигатного предракового состояния [4].
Международная классификация хронического гастрита (Сиднейская система и ее Хьюстонская модификация) в последние годы была дополнена интегральным показателем выраженности воспаления — степенью и выраженностью атрофии — стадией хронического гастрита. Эта интерпретация морфологических признаков была разработана международной группой экспертов-патологов (Atrophy Club) и рабочей группой по оценке гастрита (OLGA — Operative Link on Gastritis Assessment) [5]. Несмотря на то, что в настоящее время установлено значение системы оценки биоптатов OLGA [6] для диагностики атрофического гастрита, остается много нерешенных вопросов, особенно выделение групп больных в стадии субатрофии, а также выделение групп риска по развитию рака желудка [7, 8, 9, 10, 11].
Однако эндоскопическая диагностика начинающейся атрофии, особенно без морфологического исследования, затруднена, отсутствие проведения серологического неинвазивного исследования на наличие атрофии тела и антрального отдела желудка в поликлиническом звене также не позволяет во время выявить атрофию.
В современной литературе отсутствуют работы по комплексной диагностике атрофического гастрита с учетом эндоскопического, гистологического, лабораторного и клинического методов. В Российской Федерации отмечается поздняя диагностика данной патологии, и отсутствуют четкие, приемлемые для первичного звена здравоохранения критерии диагностики и прогноза развития атрофического гастрита.
Под нашим наблюдением находились 156 пациентов, которые были разделены на 3 группы. В 1-ю группу вошли 76 больных с неатрофическим гастритом; во 2-ю группу — 40 больных с атрофическим гастритом без геликобактериоза; в 3-ю группу 40 больных с атрофическим гастритом и геликобактериозом. Разделение больных по группам проводили в соответствии с Сиднейской классификацией гастритов (1996). Всех больных в каждой группе разделяли по полу и возрасту, изучали характер жалоб, наследственные факторы и факторы риска, длительность заболевания и частоту обострений в год.
Средний возраст больных мужчин 1-й группы составил 43,83 ± 0,99 года, женщин — 45,03 ± 0,92 года; средний возраст мужчин во 2-й группе — 56,00 ± 1,1 года, женщин — 56,14 ± 1,5 года; средний возраст мужчин в 3-й группе — 57,61 ± 1,7 года, женщин — 58,82 ± 1,9 года.
При обследовании применяли клинический, эндоскопический, морфологический и лабораторный методы. Клинический метод включал изучение жалоб и анамнеза пациента, а также пальпацию живота. Эндоскопический метод включал проведение эзофагогастродуоденоскопии с внутрижелудочной рН-метрией и биопсией слизистой желудка. Эзофагогастродуоденоскопию проводили с использованием видеоэндоскопической системы Fujinon (Япония), включающей в себя Processor EPX-201H и эндоскоп EG 201FP. Для записи видеоизображения использовали Pioner HDD/DVD recorder DVR-555H. Для забора биопсийного материала использовали эндоскопические щипцы фирмы СООК ADFS-2.2-160.
При гастроскопии оценивали характер складок слизистой в теле и антруме, вид слизистой, ее цвет, наличие или отсутствие отечности, рельеф. Для более детального осмотра выявляемых патологических участков слизистой применяли метод «акваэндоскопии», которая позволяла более четко определить границы и размеры патологических очагов. С целью улучшения визуальной картины, ее трактовки, прицельной биопсии из патологически измененных участков, а также для определения точных границ поражения, применяли технику прижизненной окраски слизистой — хромоскопию. Для подтверждения и выявления очагов кишечной метаплазии использовали метиленовый синий, для более детального осмотра слизистой применяли контрастирующий краситель — 0,5% раствор индигокармина.
При морфологическом методе биоптаты слизистой желудка брались и исследовались в соответствие с модифицированной Сиднейской системой (Хьюстон, 1994) и с визуально-аналоговой шкалой, которая включала оценку локализации поражения, степени выраженности воспаления, активности хронического гастрита, морфологического варианта хронического гастрита.
Для определения кислотопродуцирующей способности слизистой оболочки желудка применяли методику эндоскопической рН-метрии. С этой целью использовали прибор ацидогастрометр «АГМ-01» и эндоскопический рН-зонд с накожным хлорсеребряным электродом сравнения Г1-Э (Россия, НПП «Исток-Система» г. Фрязино, Московской обл.). Активность кислотообразования оценивали по данным рН в теле и своде желудка: рН > 5,0 — анацидное состояние; рН 5,0 — 2,1 — гипоацидное состояние; рН 1,2 — 2,0 — нормацидное состояние; рН<1,2 — гиперацидное состояние. Ощелачивающую функцию антрального отдела считали сохраненной при рН>5 в средней трети антрального отдела.
Для определения Helicobacter pylori при ЭГДС применяли уреазный экспресс-тест для НР (Кат. № 602 015) фирмы «Biohit» (Финляндия).
Иммуноферментный анализ (ИФА) с определением уровней биомаркеров — пепсиногена — I (биомаркер атрофии тела), гастрина — 17 (биомаркер атрофии антрума), титра антител к HР проводили с помощью тестовой системы «Гастропанель» (Biohit Plc., Хельсинки, Финляндия). Иммуноферментный анализ проводился на ИФА анализаторе Stat fax 2100 awareness tehnologic (США).
При эндоскопическом обследовании в группах больных с атрофическим гастритом признаки атрофии слизистой в виде истончения слизистой были выявлены у всех 80 пациентов (100%) (рис. 1,2), причем во 2-й группе диффузное истончение слизистой было отмечено у 12 больных (30,0%), очаговое — у 28 (70%), в 3-й группе соответственно — в 13 (32,5%) и 27 (67,5%).
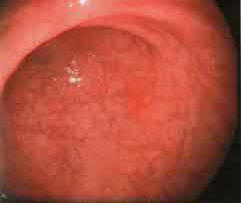
Рисунок 1.
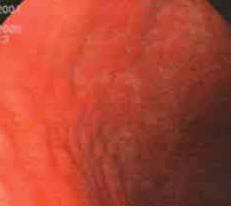
Рисунок 2.
В 1-й группе больных с хроническим поверхностным гастритом истончение слизистой не выявлялось (рис. 3,4)
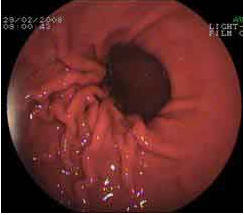
Рисунок 3.

Рисунок 4.
Подчеркнутость сосудистого рисунка в 1-й группе выявлялась только у 5 пациентов (6,6%), во 2-й группе она была у 34 (85,0%), в 3-й группе — у 36 (90,0%). При постановке эндоскопического заключения по классификации OMED признаки атрофии антрума и тела в 1-й группе не выявлялись. Атрофия антрума во 2-й группе определялась у 45 пациентов (45%), в 3-й группе — у 25 (62,5%). Признаки атрофии антрума и тела — соответственно у 12 (30%) и 13 (32,5%). Признаки атрофии тела во 2-й группе определялись у 10 (25%), в 3-й группе — у 2 (5,0%). При проведении хромоэндоскопии с 0,5% раствором метиленового синего очаги кишечной метаплазии выявлены во 2-й группе у 9 пациентов (22,%), в 3-й группе — у 18 (45,0%). При хромоэндоскопии с 0,5% индигокармином определены нарушения архитектуры слизистой во 2-й и 3-й группах у всех пациентов.
Определение кислотопродуцирующей способности слизистой оболочки желудка при эндоскопической рН-метрия (рис. 5) позволило оценить кислотопродуцирующую способность желез желудка. В 1-й группе сохраненная или усиленная кислотопродукция отмечена у всех 76 пациентов (100%). Во 2-й группе нормоацидность была у 16 (40%), гипоацидность — у 14 (35,0%), и анацидность — у 10 (25,0%). В 3-й группе нормоацидность была у 16 (40%), гипоацидность — у 12 (30,0%), анацидность — также у 12 (30,0%). Выявленные данные подтвердили снижение или почти полное отсутствие кислотопродукции у большинства пациентов с атрофическим гастритом- 48 (60%). Сохраненная кислотопродукция у больных с атрофическим гастритом в 32 случаях (40%) может быть объяснена или достаточным кислотообразованием, или компенсаторным усилением синтеза соляной кислоты в оставшихся железах. Что касается 1-й группы пациентов, то снижение кислотопродукции у них зафиксировано не было, нормоацидность была у 6 (7,9%), гиперацидность — у 69 (91,1%).
По результатам морфологического исследования биоптатов, полученных при гастроскопии, в 1-й группе у всех 76 пациентов (100,0%) выставлено заключение хронического гастрита без атрофии, во 2-й группе атрофия антрума — у 16 (40,0%), атрофия антрума и тела (рис. 6) — у 14 (35,0%), атрофия тела — у 10 (25,0%). В 3-й группе атрофия антрума установлена у 23 (57,5%), атрофия антрума и тела — у 15 (37,5%), атрофия тела — у 2 (5,0%). Одновременное наличие атрофии в теле и в антральном отделе желудка свидетельствует о прогрессировании атрофического гастрита и о длительности его течения. Изолированное выявление атрофии слизистой только тела желудка позволяет говорить о наличии аутоиммунного гастрита.
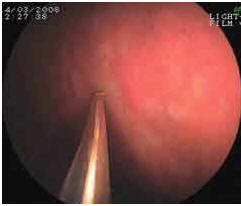
Рисунок 5.
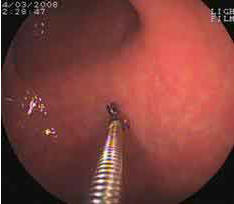
Рисунок 6.
В 1-й группе активность гастрита I-й стадии была выявлена у 12 (15,8%), II-й стадии — у 38 (50,0%), III-й стадии — у 20 (26,3%). Во 2-й группе соответственно — 25 (62,5%), 12 (30%), 3 (7,5%). В 3-й группе активность I-й стадии определилась у 4 (10,0%), II-й стадии — у 23 (57,5%) и III-й — у 13 пациентов (32,5%). Большая активность гастрита среди пациентов 1-й и 3-й групп объясняется присутствием H. pylori в слизистой желудка.
Степень атрофии во 2-й и 3-й группах соответственно была умеренной у 16 (40,0%) и 13 (32,5%) больных, выраженной у 24 (60,0%) и 27 (67,5%). Степень атрофии выставлялась с учетом уменьшения числа нормальных желез в слизистой. Структурная перестройка слизистой по типу кишечной метаплазии в 1-й группе произошла у 34 (85,0%), в 3-й группе — у 35 (87,5%) пациентов, пилорическая метаплазия соответственно — у 4 (10,0%) и 3 (7,5%). Дисплазия (неоплазия) развилась во 2-й группе у 9 (22,5%), в 3-й группе — у 12 пациентов (30,0%).
Лабораторное исследование с помощью Гастропанели в 1-й группе выявило нормальную слизистую в 10 случаях (13,2%), неатрофический геликобактерный гастрит в 66 (86,8%). Признаков атрофии слизистой в данной группе выявлено не было. Что касается групп с атрофическим гастритом, то во 2-й группе без геликобактериоза атрофия антрума была установлена у 27 (67,5%), атрофия антрума и тела — у 3 (7,5%), только атрофия тела — у 10 пациентов (25,0%). В 3-й группе с геликобактериозом — соответственно в 26 (65,0%), 12 (30,0%) и 2 случаях (5,0%).
Предварительное статистическое обследование выборки не позволило принять классические предпосылки корреляционного, регрессионного и дисперсионного анализов, а использование методов робастного оценивания могло изменить феноменологическое содержание медицинских исследований. Было принято решение обработать выборку тремя многомерными мерами статистических связей: корреляционными (множественный и парные коэффициенты корреляции), дисперсионными (множественное дисперсионное отношение, парные дисперсионные отношения, дисперсионные отношения эффектов взаимодействия, дисперсионные отношения эффектов взаимосвязей) и информационными (многомерная информационная мера, парная информационная мера и парная условная информационная мера).
Проведя дополнительный статистический анализ, мы выявили ведущие признаки, которые имеют большее значение в формировании заключения, и разработали математическую модель, позволяющую на основании использования этих наиболее значимых признаков устанавливать диагноз атрофического гастрита. Этими признаками являются: возраст, наличие сопутствующей эритематозной и застойной гастропатии, морфологически подтвержденные признаки хронического гастрита без атрофии, результаты рН-метрии тела и антрума, уровни гастрина-17, стимулированного гастрина-17 и титра антител к Helicobacter pylori, результат уреазного теста на Н.р.
На основании выявленных ведущих признаков построили регрессионную модель, которая позволяет с высокой степенью вероятности отнести пациента к определенной группе.
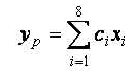
Непрерывный диапазон значений регрессионной модели был разбит на поддиапазоны. Определение номера группы проведено в зависимости от того, в какой диапазон попало значение:
От 0,5 до 1,5 — 1-я группа (хронический поверхностный гастрит),
От 1,5 до 2,5 — 2-я группа (атрофический гастрит без геликобактериоза),
От 2,5 до 3,5 — 3-я группа (атрофический гастрит с геликобактериозом).
Построенная модель позволяет с высокой степенью вероятности отнести пациента в группу хронического гастрита без атрофии, атрофического гастрита без геликобактериоза или атрофического гастрита с геликобактериозом.
Описанная выше модель для практического применения врачами-гастроэнтерологами представлена в виде компьютерной программы. Врачу достаточно внести значения рН-метрии, уровней гастрина 17 и стимулированного гастрина 17, результаты эндоскопии в таблицу, чтобы получить заключение о виде гастрита.
Таким образом, в условиях амбулаторно-поликлинического звена, когда у врача-эндоскописта нет возможности выполнения биопсии в необходимом объеме, а также невозможен анализ морфологического материала в соответствие с системой OLGA, применение математической модели, основанной на возрасте, наличия сопутствующей эритематозной и застойной гастропатии, морфологически подтвержденных признаков хронического гастрита без атрофии, результатах рН-метрии тела и антрума, уровней гастрина-17 и стимулированного гастрина-17, уровня титра антител к Helicobacter pylori, результата уреазного теста на Н.р. позволяет не только определить принадлежность пациента к той или иной группе, но и выявить пациентов, относящихся к группе риска по развитию хронического гастрита или к группе риска по развитию рака желудка. Это особенно важно в двух клинических ситуациях: когда по результатам эндоскопического исследования врач-эндоскопист устанавливает диагноз «хронический атрофический гастрит», основываясь только на визуальной картине (имеет место гипердиагностика); когда эндоскопическое исследование не дает подтверждения наличия предраковых изменений слизистой (имеет место гиподиагностика).
Литература
- Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992; 52: 6735—6742.
- Correa P. A human model of gastric carcinogenesis. Cancer Res. 1998; 48: 3554—3560.
- Correa P. The biological model of gastric carcinogenesis. JARC Sci. Publ. 2004; 157: 301-310.
- Kokkola A., Sipponen P., Pautelin. H. et al. The effect of Helicobacter pylore eradication on the natural course of atrophic gastritis with dysplasia. Aliment. Pharmacol. Ther. 2002; 16: 515-520.
- Ramírez-Mendoza P, González-Angulo J, Angeles-Garay U, Segovia-Cueva GA. Evaluation of Gastric Atrophy. Comparison between Sidney and OLGA Systems. Rev Med Inst Mex Seguro Soc. 2008 Mar-Apr; 46 (2): 135-9. Spanish.
- Rugge M., Correa Р., Di Mario F., El-Omar E , Fiocca R., Geboes K., Genta R.M., Graham D.Y., Hattori T., Malfertheiner P., Nakajima S. , Sipponen P., Sung J., Weinstein W., Vieth M. OLGA staging for gastritis: A tutorial. Digestive and Liver Disease (2008).
- Блашенцева С.А. , Морозова О.В. , Таранова Л.Н. , Ильина Е.А. , Лейбов М.И. Экспресс-диагностика геликобактерной инфекции у больных гастроэнтерологического профиля. VII Международный конгресс по эндоскопической хирургии; 2003; М.
- Блашенцева С.А., Субботин А.М., Ефимова Е.И. Прогнозирование развития атрофического гастрита с использованием математического моделирования. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2009; 5: 23.
- Субботин А.М., Разумовский А.В. Опыт внедрения скрининга раннего рака и предраковых изменений слизистой желудка в условиях практической медицины. Сибирский журнал гастроэнтерологии и гепатологии 2005; 19: 165-166.
- Субботин А.М. Возможности гастроскопии и тест системы «GASTROPANEL» в диагностике и лечении предраковых изменений слизистой желудка. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 2007; 5: 37.
- Субботин А.М. Эндоскопическое выявление атрофии слизистой, как предракового состояния слизистой желудка у больных с хеликобактерным гастритом. Материалы научно-практической конференции «Актуальные вопросы эндоскопии»; 28 марта 2008 г.; Казань. С.120-124.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru
