Содержание статьи
Эпидемиология, патофизиология и возможная связь ВГЧ-6 с клиническими синдромами
Вирус герпеса человека 6 типа (ВГЧ-6) впервые был обнаружен в 1986 г. у ВИЧ-положительного пациента, который страдал от лимфопролиферативного заболевания [1].
Так же как цитомегаловирус и вирус герпеса 7 типа, ВГЧ-6 относят к бета-герпесвирусам. Имеются его две различные подгруппы: ВГЧ-6А и ВГЧ-6В, которые на 95% генетически тождественны. Через 20 лет после открытия ВГЧ-6 различия между его вариантами достигли такой значимости, что их стали рассматривать как два разных вида.
ВГЧ-6 состоит из капсида икосаэдрической формы, окруженного тегументом в липидной оболочке диаметром около 200 нм [2].
Более 90% людей приобретают ВГЧ-6В в раннем детстве в виде внезапной экзантемы между 6 мес. и 2 годами после утраты материнских протективных антител. Инфицирование ВГЧ-6А происходит в более позднем возрасте и не сопровождается какими-либо симптомами. Антитела к ВГЧ-6 обнаруживают более чем у 90% населения развитых стран [3]. После первичной инфекции ВГЧ-6А и ВГЧ-6В пожизненно остаются в организме в латентном состоянии и могут реактивироваться, вызывая литическую инфекцию. В макроорганизме ВГЧ-6А и ВГЧ-6В обнаруживают в различных тканях и органах: в клетках головного мозга, в миндалинах, слюнных железах, почках, печени, лимфатических узлах, яичках, в эндотелиальных клетках, моноцитах и макрофагах. ВГЧ-6А и ВГЧ-6В — Т-лимфотропные вирусы, но предпочтительными локусами латентной инфекции являются клетки центральной нервной системы (ЦНС), костного мозга и мононуклеары периферической крови [4]. Латентный вирус может реактивироваться у иммунокомпетентных, и, что бывает значительно чаще, у иммунокомпрометированных лиц. Реактивация ВГЧ-6 ассоциирована с эпилептическими припадками, энцефалитом и отторжением трансплантата [5–7].
ВГЧ-6 инфицирует CD4+-лимфоциты, приводя к снижению их уровня, что может быть кофактором прогрессии СПИДа, однако для доказательства требуются дальнейшие исследования [8].
ВГЧ-6 обладает тропизмом к нейронам и дендритным клеткам ЦНС. Из двух вариантов более нейровирулентным является ВГЧ-6А, что подтверждается его повышенной концентрацией в бляшках головного мозга при рассеянном склерозе. Другие герпесвирусы человека при латенции находятся в виде кольцевидной эписомы в ядре клеток хозяина. Однако ВГЧ-6А и ВГЧ-6В могут интегрироваться в хромосомы и передаваться вертикально через герминативные клетки. Частота хромосомной интеграции в популяции здоровых доноров крови составляет 0,8–1,5% [9]. Интегрированный геном вируса локализуется в концевых областях хромосом — теломерах. У лиц, которые унаследовали хромосомную интеграцию ВГЧ-6, обнаруживают одну копию вируса на клетку организма. Подозревать вирусную интеграцию следует при концентрации вируса 105 копий/мл и выше.
Данные за участие ВГЧ-6 в возникновении болевых синдромов немногочисленны. Так, А. Krumina et al. [10] сообщают о достоверной ассоциации ВГЧ-6 с фибромиалгией. У 23 из 43 пациентов с этим заболеванием была обнаружена ДНК ВГЧ-6 в периферической крови, в то время как в группе контроля инфекцию выявляли лишь у 3 из 50 человек. При этом у 29 из 43 больных фибромиалгией имелись различные степени повреждения А-дельта- и С-нервных волокон, нарушения температурной и болевой чувствительности.
Кроме того, уже более 25 лет обсуждают роль ВГЧ-6 при рассеянном склерозе [11, 12]. Среди прочих причин ВГЧ-6 рассматривают в качестве одного из самых значимых инфекционных триггеров, запускающих аутоиммунный процесс при этом заболевании. Вирусы обнаруживали в пробах тканей ЦНС, а серологические исследования по выявлению анти-ВГЧ-6 антител сыворотки крови и ликвора указывают на ассоциацию этого вируса с рассеянным склерозом. Кроме того, имеются данные in situ детекции вирусной ДНК. При этом частота болевого синдрома (в том числе тазового) у пациентов с рассеянным склерозом достигает 50–80%.
Следует отметить, что диагностировать инфекцию ВГЧ-6 на основе клинических проявлений зачастую трудно, что препятствует назначению этиологически обоснованного лечения. Лабораторную диагностику инфекции ВГЧ-6 проводят с помощью серологических и молекулярно-генетических исследований. Наиболее информативным является количественное определение вирусной ДНК в периферической крови и в других биологических жидкостях с помощью полимеразной цепной реакции (ПЦР) в реальном времени. Так как при первичном заражении и даже при реактивации ВГЧ-6 инфекция может протекать бессимптомно, условно определены концентрации ДНК ВГЧ-6, которые характеризуют активную, клинически выраженную инфекцию — 1000 копий/мл и выше.
Против герпесвирусных инфекций, вызываемых альфа-, бета- и гамма-ВГЧ, используют такие лекарственные препараты, как валацикловир, ганцикловир, фоскарнет (не зарегистрирован в РФ) и цидофовир (не зарегистрирован в РФ). В то же время показания для лечения инфекций, вызванных ВГЧ-6, на сегодняшний день официально не утверждены.
В связи с тем что многие вопросы патогенеза, диагностики и лечения инфекций ВГЧ-6 пока не решены, представляет интерес клиническое наблюдение с успешной попыткой практического решения данных вопросов.
Клиническое наблюдение
Пациент О., 49 лет, обратился с жалобами на жжение в уретре, боль периодического характера в промежности, мошонке, неприятные ощущения при мочеиспускании, во время и после эякуляции.
Из анамнеза: в течение длительного времени болеет хроническим простатитом. Ежегодно проходил терапию антибактериальными и противовоспалительными препаратами, физиолечение — с временным эффектом. В юности отмечал частые рецидивы генитального герпеса. Другие инфекции, передаваемые половым путем, отрицает.
Сопутствующие заболевания: болезнь Паркинсона, принимает леводопу 200 мг/сут, бенсеразид 50 мг/сут. По рекомендации врача-невролога выдерживает режим повышенных физических нагрузок (езда на велосипеде 25–40 км в день). Болезнь проявляется периодически возникающим тремором пальцев рук.
Пальцевое ректальное исследование: предстательная железа 4×4 см, болезненная, мягко-эластической неоднородной консистенции, асимметрична за счет увеличенной правой доли, без очаговых уплотнений, слизистая над железой подвижна.
Индекс симптомов хронического простатита (chronic prostatitis symptom index) CPSI — 15 (боль — 8, нарушения мочеиспускания — 2, влияние симптомов на повседневную жизнь — 5), качество жизни (quality of life) QoL — 4, что соответствует умеренной степени тяжести тазовой боли.
Методом ПЦР Chlamydia trachomatis, Mycoplasma genitalium, Trichomonas vaginalis, Neisseria gonorrhoeae, Ureaplasma spp., Mycoplasma hominis, вирус простого герпеса (ВПГ) 1, 2 типа не выявлены.
При исследовании секрета предстательной железы (СПЖ) содержание лейкоцитов 0–4 в поле зрения, лецитиновые зерна — скудно. Общий анализ мочи в пределах нормы, в мазке из уретры выявлены лейкоциты 0–1–0 в поле зрения.
При бактериологическом исследовании до постмассажной пробы мочи: Staphylococcus epidermidis 104 КОЕ/мл в обеих пробах, что соответствует абактериальному ХП/СХТБ.
В ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России проведено исследование методом ПЦР в реальном времени (ПЦРрв) для определения ДНК пяти ВГЧ: ВПГ-1, ВПГ-2, вируса Эпштейна — Барр, цитомегаловируса, ВГЧ-6. Использовали наборы реактивов для ПЦР «АмплиСенс HHV1/HHV2-cкрин-FL» и «АмплиСенс EBV/CMV/HHV6-cкрин-FL», (ООО «ИнтерЛабСервис», Россия). В качестве эндогенного внутреннего контроля использовали β-глобиновый ген.
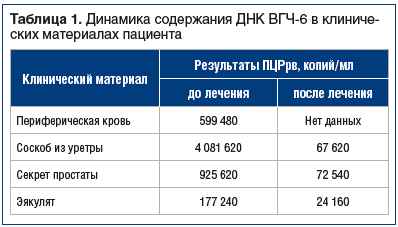
Клиническим материалом служили: цельная кровь, соскоб из уретры (СУ), СПЖ, эякулят. Получены следующие результаты: ДНК ВПГ-1, ВПГ-2, вируса Эпштейна — Барр и цитомегаловируса не обнаружена. ДНК ВГЧ-6 обнаружена в высоких концентрациях во всех изученных клинических материалах: в СУ — свыше 4 млн копий/мл, в СПЖ — 925 тыс. копий/мл, в эякуляте — 177 тыс. копий/мл. Высокое содержание ВГЧ-6 в крови (600 тыс. копий/мл) позволило предположить хромосомную интеграцию вируса.
При урофлоуметрии: максимальная скорость потока мочи (Qmax) — 17,3 мл/с, средняя скорость (Qav) — 8,6 мл/с, при объеме мочеиспускания — 157 мл. При ТРУЗИ: объем предстательной железы — 46 см3 без очагов узловой гиперплазии, визуализируются кальцинаты вдоль уретры.
При получении результатов вирусологического исследования пациент подтвердил, что ранее у него уже выявляли ВГЧ-6 и он проходил лечение в одной из клиник г. Москвы за 2 года до обращения по данному поводу.
Диагноз: синдром хронической тазовой боли IIIВ, хроническая герпесвирусная инфекция 6 типа.
Проведено лечение: валацикловир 500 мг по 1 таблетке 2 р/сут в течение 3 мес., ВИФЕРОН® (интерферон α-2b с антиоксидантами — витаминами Е и С) в форме ректальных суппозиториев, по 1 суппозиторию 3 млн МЕ 2 р/сут в течение 10 дней, затем 3 р/нед. еще в течение 3 нед.
В ходе лечения у пациента двукратно проводили повторные исследования СПЖ — через 2 нед. и 4 нед. от начала лечения. Содержание лейкоцитов составило 40–60 в поле зрения, ввиду чего первоначальный диагноз был изменен на ХП/СХТБ IIIА.
К концу терапии самочувствие субъективно улучшилось. Наиболее заметное улучшение проявлялось в виде снижения жжения уретры, уменьшения болей во время и после семяизвержения. Оценка по шкале CPSI на 90-й день составила 8 (4+1+3) баллов, по шкале QoL — 2 балла, т. е. отмечено снижение всех показателей.
Микроскопия СПЖ: лейкоциты 10–15 в поле зрения, содержание лецитиновых зерен — умеренно. Вирусологическое исследование обнаружило значительное снижение концентрации ВГЧ-6 (табл. 1).
Пальцевое ректальное исследование: предстательная железа 4×4 см, практически безболезненная при пальпации, мягко-эластической консистенции, асимметричная за счет увеличения правой доли, без очаговых уплотнений, слизистая над железой подвижна.
Субъективно течение имеющегося нейродегенеративного заболевания не изменилось за время наблюдения.
Таким образом, у пациента единственным вероятным этиологическим агентом ХП/СХТБ IIIА явился ВГЧ-6. На фоне специфической противогерпетической терапии и интерферонотерапии отмечалось уменьшение боли, симптомов дизурии, улучшение клинических и лабораторных показателей (концентрация вируса, оценка по шкале CPSI). Высокие конечные концентрации ВГЧ-6 при хорошем клиническом ответе можно объяснить возможной хромосомной интеграцией вируса, при которой каждая клетка организма содержит его генетический материал.
Важно отметить, что основной жалобой пациента было жжение в уретре, при этом максимальная концентрация вируса оказалась именно в этом урогенитальном локусе. В результате противовирусной терапии, включавшей препарат ВИФЕРОН® (интерферон α-2b с антиоксидантами — витаминами Е и С) в форме ректальных суппозиториев, удалось снизить концентрацию вируса в содержимом уретры на два порядка, что оказалось достаточным для устранения уретральных симптомов.
Последующие годы наблюдения за данным пациентом показали, что симптомы ХП/СХТБ имели легкую степень тяжести и не заставляли пациента обращаться за медицинской помощью. В будущем более действенной терапией в данном случае может быть геномное редактирование с помощью коротких палиндромных повторов, регулярно расположенных группами, которое показало хороший антивирусный эффект на лабораторных животных [13].
Данный случай, насколько нам известно, является первым сообщением о хромосомно интегрированном ВГЧ-6, ассоциированном с ХП/СХТБ.
Заключение
Широкое распространение ВГЧ-6 и возможность его верификации с помощью ПЦР послужили началом интенсивного изучения этого вируса. Оказалось, что ВГЧ-6 может быть ассоциирован с энцефалитом, эпилептическими припадками, болевыми синдромами, что обусловлено его нейротропизмом. Особенно большая концентрация ВГЧ-6 наблюдается в случае его хромосомной интеграции в околотеломерную область. При этом вирус начинает передаваться по наследству по законам Менделя.
В представленном клиническом случае ВГЧ-6 явился вероятной причиной абактериального хронического простатита. Противовирусная терапия, направленная на подавление репликации ВГЧ-6 и активацию антивирусной активности организма, показала хороший вирусологический эффект в виде снижения вирусной нагрузки, что сопровождалось достижением устойчивой клинической ремиссии у пациента с тазовым болевым синдромом.
Благодарность
Редакция благодарит компанию ООО «Ферон» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru





