Введение
Идиопатический легочный фиброз (ИЛФ) относится к наиболее распространенному типу интерстициальных заболеваний легких (ИЗЛ), на его долю приходится около 20% всех ИЗЛ [1]. Распространенность и заболеваемость ИЛФ неуклонно увеличиваются во всем мире. Эпидемио-логические данные свидетельствуют о том, что распространенность этой патологии в мире составляет от 0,33 до 4,51 на 10 000 человек, а заболеваемость — от 0,09 до 1,30 на 10 000 [2]. ИЛФ характеризуется неблагоприятным прогнозом, средняя продолжительность жизни после постановки диагноза при отсутствии лечения не превышает 3,2 года, что сопоставимо с некоторыми видами онкологических заболеваний [3]. Средние показатели выживаемости пациентов с ИЛФ соответствуют 88% в течение 2 лет и 31% в течение 5 лет и более от момента постановки диагноза [4]. Хотя при ИЛФ могут наблюдаться периоды временной клинической стабильности, прогрессирование заболевания неизбежно [3].
Содержание статьи
Идиопатический легочный фиброз и антифибротическая терапия
В настоящее время для лечения ИЛФ зарегистрированы 2 препарата: нинтеданиб и пирфенидон [5]. Оба препарата воздействуют на пути, подавляющие активацию фибробластов, замедляя процессы фиброзирования, но не останавливают прогрессирование патологического процесса.
Нинтеданиб является антагонистом рецепторов, взаимодействует с несколькими тирозинкиназами, включая рецепторы фактора роста эндотелия сосудов (VEGF), фактора роста фибробластов (FGF) и фактора роста тромбоцитов (PDGF) [6]. Эффективность и безопасность нинтеданиба оценивались в рандомизированных клинических исследованиях (РКИ) III фазы INPULSIS-1 и INPULSIS-2 [6] и в открытом долгосрочном расширенном исследовании INPULSIS-ON [7]. В обоих исследованиях INPULSIS нинтеданиб значительно снизил скорость снижения форсированной жизненной емкости легких (ФЖЕЛ) в течение 52 нед. [6].
Антифибротические свойства пирфенидона были впервые выявлены в 1970-х годах [8]. Хотя точные механизмы действия пирфенидона до конца не изучены, признано, что препарат подавляет ключевые профибротические и провоспалительные процессы [9]. Одним из основных механизмов его действия является ингибирование трансформирующего фактора роста β (TGF-β), важнейшего цитокина, который запускает фиброзный процесс, способствуя активации фибробластов и выработке внеклеточного матрикса. Было показано, что помимо воздействия на TGF-β, пирфенидон регулирует уровень провоспалительных цитокинов, таких как фактор некроза опухоли α (TNF-α), интерлейкины 1, 6, интерферон γ и PDGF [10]. Эффективность и безопасность пирфенидона были исследованы в нескольких ключевых РКИ, в том числе CAPACITY (004 и 006) и ASCEND [11, 12]. Исследование CAPACITY 004 показало, что у пациентов, получавших пирфенидон, наблюдалось более медленное снижение объема форсированного выдоха за 1-ю секунду (ОФВ1) в течение 72-недельного периода лечения [11]. В исследовании ASCEND были отмечены значительное замедление снижения ОФВ1, увеличение толерантности к физической нагрузке и повышение выживаемости без прогрессирования заболевания в течение 52-недельного периода наблюдения [12].
В настоящее время в литературе широко обсуждается возможность применения пирфенидона при других заболеваниях, в основе которых лежит процесс формирования фиброза (в том числе гломерулосклероз, ишемическая болезнь сердца, цирроз печени, пролиферативная витреоретинопатия, глаукома, лечение рубцов), и заживлении ран при ожоговых травмах и др. [13].
O. Aycicek et al. [14] показали, что пирфенидон и нинтеданиб одинаково эффективны в предотвращении прогрессирования заболевания у пациентов с ИЛФ. В исследовании принимали участие 109 пациентов с ИЛФ, из них 82 (75,2%) получали пирфенидон, 27 (24,8%) — нинтеданиб. При сравнении показателей ФВД через 3, 6, 9 и 12 мес. с исходными в обеих группах не было выявлено статистически значимых различий ни по одному из параметров. Кроме того, не было выявлено существенных различий в отношении динамики изменений по данным компьютерной томографии высокого разрешения (КТВР) в конце 1 года наблюдения в обеих группах.
Важной гарантией эффективности антифибротической терапии (АФТ) является ее своевременное назначение. Анализ данных шведского регистра ИЛФ показал, что из 532 пациентов только 371 (69%) получал лечение антифибротическими препаратами. Основными причинами, по которым АФТ не была назначена, были стабильное течение заболевания, сохранная функция легких и пожилой возраст [15]. В то же время Y. Lei et al. продемонстрировали, что своевременное применение пирфенидона у пациентов с ИЛФ (при наличии следующих критериев: ФЖЕЛ ≥50% и прогнозируемая диффузионная способность легких ≥35%) значительно улучшает функцию легких, повышает физическую выносливость, уменьшает побочные реакции и подтверждается положительной динамикой изменений на КТВР.
Достижения в исследованиях патогенеза ИЛФ, попытки эндотипирования заболевания, выделение моделей медленно- и быстропрогрессирующего ИЛФ, ИЛФ с частыми обострениями, развитие персонализированной медицины показали, что универсальный подход к лечению не является оптимальной стратегией [17]. Исследования последних лет подтверждают, что ИЛФ является гетерогенным заболеванием с множественными вариантами течения [18]. Так, полиморфизм в промоторной области MUC5B (rs35705950) приводит к более высокой экспрессии MUC5B, нарушению регуляции защиты слизистой и в конечном итоге увеличивает риск развития ИЛФ почти в 6 раз [18]. В этой связи актуальной является разработка новых диагностических инструментов, которые позволят улучшить раннюю и точную диагностику ИЛФ с учетом различных эндотипов заболевания и использовать персонализированный подход к терапевтической тактике, способствующей остановке прогрессирования процессов фиброза при наличии высокого профиля безопасности.
Опыт Экспертного центра по профилю «Пульмонология»
В мае 2023 г. в соответствии с распоряжением Комитета по здравоохранению в СПб ГБУЗ «ГМПБ № 2» был организован Экспертный центр по профилю «Пульмонология» (далее — Центр). Одним из основных направлений деятельности Центра является оказание высококвалифицированной лечебной, диагностической и профилактической помощи пациентам с ИЗЛ, в том числе с ИЛФ, в связи с чем разработан проект маршрутизации пациентов с этой патологией. В Центре проводится дифференциальная диагностика ИЛФ, врачебной комиссией принимается решение о назначении АФТ и обеспечивается дальнейшее наблюдение пациентов. Создание Центра позволило оптимизировать маршрутизацию пациентов, осуществить динамическое наблюдение пациентов, своевременно выявлять развитие нежелательных явлений (НЯ) на фоне АФТ и проводить их лечение. При возникновении серьезного НЯ корректируется доза препарата, а при необходимости проводится его замена. С момента начала работы Центра на регулярной основе заполняется регистр пациентов с ИЛФ. В настоящее время в регистр включено 125 пациентов. Ведение регистра позволит уточнить и дополнить клинико-биологические маркеры прогрессирования фибротического процесса и ответа на АФТ.
Маршрутизация пациентов с ИЛФ в Центр позволила выявить ряд дефектов в оказании медицинской помощи на амбулаторном этапе в лечебно-профилактических учреждениях по месту жительства: отсутствие динамического наблюдения (14 (18%) пациентов), недостаточная осведомленность пациентов о возможных НЯ АФТ и способах их коррекции и, как следствие, низкая приверженность терапии (36 (45%) пациентов).
В настоящее время в Центре наблюдается 79 пациентов с ИЛФ, получающих АФТ: 35 (44%) из них получают пирфенидон и 44 (56%) — нинтеданиб. Наблюдаемые в Центре пациенты относятся к старшей возрастной группе и в большинстве случаев имеют длительный стаж курения (табл. 1). У 73 (93%) пациентов диагностирована клинически значимая сопутствующая патология — преимущественно заболевания сердечно-сосудистой системы и ГЭРБ. У 11 (14%) пациентов выявлены обструктивные нарушения, требующие регулярной бронхолитической терапии. Полученные результаты сопоставимы с данными литературы. Так, в исследовании S. Kette et al. [19] 77 (76,2%) пациентов имели по крайней мере одну сопутствующую патологию, а 27 (26,7%) — три или более коморбидных заболевания. Примечательно, что 24 (23,8%) имели сопутствующие респираторные заболевания, а 75 (74,3%) — нереспираторные.
Онкологические заболевания легких выявлены у 5 пациентов, наблюдающихся в Центре. ИЛФ и рак легких часто сосуществуют, при этом распространенность рака легких среди пациентов с ИЛФ составляет примерно 3–48% [20]. Риск развития рака легких при ИЛФ примерно в 6–8 раз выше, чем в общей популяции, даже с учетом возраста и курения [21]. У этих заболеваний есть общие клинические факторы риска, такие как старение, факторы окружающей среды (например, сигаретный дым и загрязнение воздуха), а также совпадающие биологические сигнальные пути развития патологического процесса. АФТ связана с улучшением выживаемости пациентов с ИЛФ, у которых развился рак легких, даже несмотря на то, что заболеваемость раком легких выше у тех, кто получал АФТ, по сравнению с теми, кто ее не получал [22]. Несколько исследований in vitro и in vivo с использованием пирфенидона продемонстрировали потенциальное противоопухолевое действие препарата за счет обратного развития эпителиально-мезенхимального перехода в связи с подавлением TGF-β и FGF и за счет индукции апоптоза альвеолярных фибробластов [23, 24]. В модели опухоли in vitro пирфенидон продемонстрировал противоопухолевый эффект, не только подавляя TGF-β, но и изменяя метаболизм. Так, на фоне терапии пирфенидоном снижается выработка лактата и аденозин-5′-трифосфата, тем самым подавляя гликолиз [25].
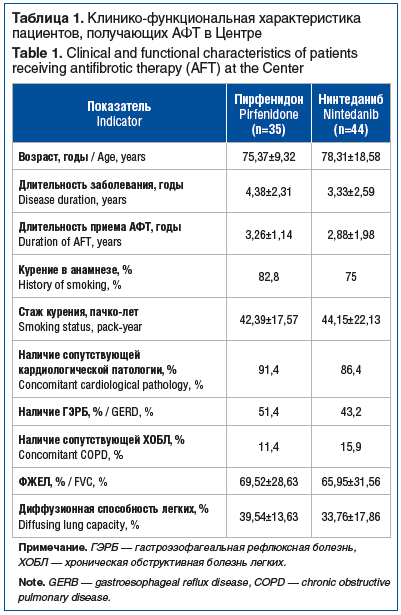
Прогрессирование фибротического процесса на фоне АФТ по результатам КТВР и/или комплексного исследования функции внешнего дыхания (КИФВД) было зафиксировано у 27 (34,2%) пациентов, наблюдаемых в Центре, стабилизация — у 52 (66%), достоверно не различаясь в зависимости от применяемого препарата (см. рисунок).
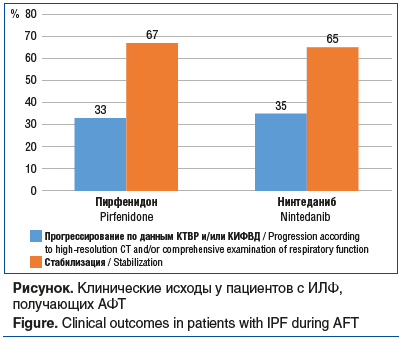
Нежелательные явления были зафиксированы у 48 (60,8%) пациентов, получающих АФТ в Центре (табл. 2), что сопоставимо с данными литературы [8, 26, 27]. При применении нинтеданиба желудочно-кишечные расстройства, такие как тошнота, диарея, боль в животе, чаще возникали в начале лечения, но со временем (в течение 3–5 мес.) существенно уменьшались у большинства (85%) пациентов. У 13 (16%) пациентов отмечалось транзиторное повышение уровня ферментов печени (аланинаминотрансферазы и аспартатаминотрансферазы). При применении пирфенидона основными НЯ были тошнота и головокружение.
В основном НЯ расценивались как легкие или среднетяжелые и не приводили к отмене препарата. Однако в ряде случаев была проведена временная коррекция дозы. Среди пациентов, получающих нинтеданиб, коррекция дозы потребовалась 15 (34%) пациентам (снижение дозы с 300 до 150 мг/сут). Четырем (11,4%) пациентам, получающим пирфенидон, пришлось сократить прием препарата с 3 капсул (801 мг) 3 р/сут до 1 капсулы (267 мг) 3 р/сут — до купирования НЯ. Для управления побочными эффектами и улучшения приверженности лечению у пациентов, получающих пирфенидон, часто применяются снижение дозы и/или перерывы в терапии. Апостериор-ный анализ объединенных РКИ пирфенидона III фазы показал, что 76,9% пациентов в группе пирфенидона испытали по крайней мере одно снижение дозы, а 46,5% — одно прерывание приема дозы [27]. Японское РКИ показало, что суточная доза пирфенидона обычно составляла ≤1200 мг/сут примерно у 62% пациентов в связи с непереносимостью более высоких доз [28]. Аналогичным образом, датское исследование показало, что 15,9% участников прекратили лечение из-за НЯ, а 45,2% потребовалась корректировка дозы для продолжения приема пирфенидона [29]. Следует отметить, что, согласно результатам исследований, применение пирфенидона в сниженной дозе (1 капсула (267 мг) 3 р/сут) не уступает по эффективности стандартной дозе (3 капсулы (801 мг) 3 р/сут (2403 мг/сут)) [30]. В нашем Центре пациенты получают препарат по одной из указанных схем.
В настоящее время разрабатываются варианты минимизации НЯ, в том числе применение новых лекарственных форм доставки уже известных препаратов. Так, проводится РКИ, оценивающее безопасность, переносимость и эффективность ингаляционного пирфенидона (AP01) при ИЛФ. Как известно, аэрозольное введение препаратов повышает эффективность и безопасность за счет увеличения лечебной концентрации в легочной ткани и снижения нежелательного системного воздействия. Наиболее распространенными НЯ при применении AP01 легкой или умеренной степени тяжести были кашель (у 14 (15,4%) пациентов), сыпь (у 11 (12,1%)), тошнота (у 8 (8,8%)), раздражение горла (у 5 (5,5%)), усталость (у 4 (4,4%)), нарушение вкуса, головокружение и одышка (у каждого из 3 (3,3%) пациентов), что сопоставимо с плацебо [31].
Заключение
Заболеваемость, распространенность и смертность от ИЛФ, несмотря на значительные успехи в диагностике и лечении, достигнутые за последнее десятилетие, применение одобренных препаратов — пирфенидона и нинтеданиба, продолжают увеличиваться. Клиническая эффективность применяемых антифибротических препаратов, подтвержденная данными исследований и реальной практикой, а также безопасность проводимого лечения подчеркивают значимость этого направления для лечения ИЛФ.
Терапевтический режим приема пирфенидона предполагает использование превентивных стратегий для минимизации рисков возникновения НЯ и улучшения переносимости препарата. Необходимо контролировать уровень ферментов печени в начале лечения и в процессе дальнейшей терапии для своевременного выявления возникающих отклонений. При выраженных побочных эффектах со стороны желудочно-кишечного тракта может потребоваться корректировка дозы, а последующее постепенное увеличение дозы может увеличить переносимость пирфенидона.
Ключевое значение имеет обучение пациентов. Они должны быть проинформированы о возможных побочных эффектах, о том, как важно своевременно сообщать о необычных симптомах, а также, в случае приема пирфенидона, о мерах по снижению светочувствительности, таких как защита от солнца. Динамическое наблюдение, предполагающее регулярные осмотры врачом-специалистом, должны включать оценку эффективности и переносимости лечения, своевременное вмешательство в случае возникновения НЯ, коррекцию терапии сопутствующих заболеваний, своевременное выполнение прививок согласно прививочному календарю.
Дальнейшее изучение механизмов, лежащих в основе развития и прогрессирования фиброза при ИЛФ, способствует выявлению новых мишеней для терапии, тем самым расширяя спектр доступных альтернативных вариантов лечения. Понимание молекулярных и генетических основ ИЛФ будет способствовать разработке индивидуальных планов лечения, которые оптимизируют терапевтическую эффективность, минимизируют побочные эффекты применяемых препаратов, что полностью соответствует принципам прецизионности в медицине.
Сведения об авторах:
Кузубова Наталия Анатольевна — д.м.н., заместитель директора по научной работе НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; начальник Экспертного центра по профилю «Пульмонология» СПб ГБУЗ «ГМПБ № 2»; 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-1166-9717
Титова Ольга Николаевна — д.м.н., директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-4678-3904
Склярова Дарья Борисовна — к.м.н., заведующая амбулаторно-консультативным отделением № 2 Экспертного центра по профилю «Пульмонология» СПб ГБУЗ «ГМПБ № 2»; 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0001-7052-6903
Волчков Владимир Анатольевич — д.м.н., заведующий кафедрой анестезиологии и реаниматологии медицинского факультета СПбГУ; 199034, Россия, г. Санкт-Петербург, Университетская наб., д. 7-9; ORCID iD 0000-0002-5664-7386
Контактная информация: Склярова Дарья Борисовна, e-mail: darya_sklyarova@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.05.2025.
Поступила после рецензирования 23.06.2025.
Принята в печать 16.07.2025.
About the authors:
Nataliya A. Kuzubova — Dr. Sc. (Med.), Deputy Director for Research, Research Institute of Pulmonology, Pavlov First
Saint-Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; head of the Expert Center for Pulmonology, City Multidisciplinary Hospital No. 2; 5, Uchebnyy lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0002-1166-9717
Olga N. Titova — Dr. Sc. (Med.), Professor, Director, Research Institute of Pulmonology of the Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904
Darya B. Sklyarova — C. Sc. (Med.), Head of the Outpatient Consultative Department No. 2, Expert Center for Pulmonology, City Multidisciplinary Hospital No. 2; 5, Uchebnyy lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0001-7052-6903
Vladimir A. Volchkov — Dr. Sc. (Med.), Head of the Department of Anesthesiology and Resuscitation of the Medical Faculty, St. Petersburg State University; 7–9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0002-5664-7386
Contact information: Darya B. Sklyarova, e-mail: darya_sklyarova@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 27.05.2025.
Revised 23.06.2025.
Accepted 16.07.2025.
Информация с rmj.ru





