Содержание статьи
Активность интерферона в комбинации с антиоксидантами против ДНК- и РНК-содержащих вирусов человека
А. А. Штро
А. В. Слита, кандидат биологических наук
Л. А. Карпинская
А. В. Галочкина
В. В. Зарубаев, кандидат биологических наук
ФГБУ НИИ гриппа Минздравсоцразвития России, Санкт-Петербург
Несмотря на успехи в разработке новых вакцин и противовирусных препаратов, грипп продолжает оставаться трудноконтролируемой инфекцией. Благодаря особенностям репродукции и организации генома, вирус гриппа способен к изменчивости двух типов — генному дрейфу (постепенной смене антигенных свойств) и генному шифту (появлению в человеческой популяции вируса с принципиально новыми антигенными характеристиками). Высокая скорость изменчивости позволяет вирусу, с одной стороны, ускользать от иммунного ответа хозяина, а с другой — в течение нескольких вирусных поколений вырабатывать устойчивость к противовирусным препаратам.
Новые вирусы гриппа птиц H5N1 и свиней H1N1, инфицирующие людей в последние годы, являются опасными патогенами человека. Большинство человеческих изолятов вируса устойчивы к действию современных противогриппозных препаратов — амантадина и римантадина [1], а некоторые и осельтамивира [2, 3], а также способны эффективно подавлять интерфероновый ответ организма [4]. Помимо этого, поверхностные антигены этих вирусов являются новыми для иммунной системы человека, вследствие чего к ним отсутствует коллективный иммунитет. Перечисленные свойства делают неэффективными такие способы защиты человека, как химиотерапия, специфический иммунный ответ и система интерферона.
На сегодняшний день лишь две вирусные мишени используются для направленного действия химиопрепаратов. Это, во-первых, белок М2 вируса гриппа, играющий роль ионного канала в вирусной мембране, который блокируют препараты адамантанового ряда — римантадин и амантадин [5]. Во-вторых, мишенью для лекарственного вмешательства является вирусная нейраминидаза — фермент, необходимый для почкования вирусных частиц и проявления инфекционных свойств вируса, против которой эффективны нейраминидазные ингибиторы занамивир (5-(ацетиламино)-4-[(аминоиминометил)-амино]-2,6-ангидро-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-еноновая кислота), осельтамивир [6] и перамивир ((1S,2S,3S,4R)-3-[(1S)-1-ацетамидо-2-этил-бутил]-4-(диаминометилиденамино)-2-гидрокси-циклопентан-1-карбоновая кислота) [7].
Обе группы соединений имеют свои недостатки. В отношении группы производных адамантана можно отметить сравнительно высокую токсичность, узкий спектр действия и быстрое формирование устойчивости к ним вируса. Для ингибиторов нейраминидазы также характерно формирование резистентности и высокая стоимость синтеза, что делает эти препараты менее доступными для широкого использования.
Герпетические инфекции представляют собой группу инфекционных заболеваний, вызываемых вирусами герпеса человека. На территории России и в странах СНГ от хронической герпетической инфекции страдает не менее 22 миллионов человек [5]. Этому возбудителю принадлежит преобладающая роль в этиологии спонтанных абортов и преждевременных родов, в нарушении эмбрио- и органогенеза, врожденной патологии новорожденных. В целом, почти треть населения Земли поражена герпетической инфекцией и у 50% из них ежегодно наблюдаются рецидивы заболевания, так как иммунитета против этой вирусной инфекции нет. Около 90% городского населения во всех странах мира инфицировано одним или несколькими типами вируса герпеса, а рецидивирующие герпесные инфекции наблюдаются у 9–12% жителей разных стран. Инфицированность и заболеваемость постоянно растут, опережая естественный прирост населения Земли. Особенно быстро увеличивается число зарегистрированных случаев генитального герпеса (увеличилось на 168% за последнее десятилетие).
В настоящее время существуют специфические противовирусные препараты для лечения инфекций, вызываемых вирусом простого герпеса, вирусом Varicella zoster, и цитомегаловирусной инфекции. Препаратами выбора для терапии герпеса являются аналоги нуклеозидов — ацикловир, ганцикловир, валацикловир, пенцикловир и фамцикловир. Среди препаратов, рекомендуемых в настоящее время для лечения герпетической инфекции, аналоги нуклеозидов являются единственными, обладающими доказанной эффективностью.
Несмотря на наличие на рынке набора перечисленных препаратов, вирусы герпеса способны вырабатывать к ним устойчивость, что существенно снижает эффективность противовирусной химиотерапии, а в тяжелых случаях и ставит под угрозу жизнь пациента. Поэтому по-прежнему актуальными являются поиск и разработка эффективных и дешевых противогерпетических препаратов возможно более широкого спектра действия.
Проблема иммунотерапии представляет интерес для врачей практически всех специальностей в связи с широким спектром противовирусной активности иммуномодулирующих препаратов из-за неуклонного роста инфекционно-воспалительных заболеваний на фоне низкой эффективности проводимой базовой терапии, злокачественных новообразований, аутоиммунных и аллергических заболеваний, системных заболеваний, вирусных инфекций, обусловливающих высокий уровень заболеваемости, смертности и инвалидности.
При терапии как гриппозной, так и герпетической инфекций в настоящее время широко применяются препараты интерферонов в инъекционной и местной формах. При составлении лекарственной формы в конечную комбинацию добавляются антиоксиданты, препятствующие окислительному разрушению молекул интерферона и способствующие сохранности биологической активности лекарственного продукта. В то же время ряд исследований [1, 2] указывает на наличие противовирусной активности и у самих антиоксидантов. Однако результаты контролируемых клинических испытаний подобных комбинаций не выявили достоверных различий в их эффективности по сравнению с монопрепаратом интерферона [3, 8–11]. Целью настоящего исследования было экспериментальное изучение противовирусной активности рекомбинантного человеческого интерферона альфа-2b (далее ИФН альфа-2b) в комбинации с антиоксидантами в культуре клеток в отношении вируса гриппа и вируса простого герпеса человека.
Материалы и методы
Препараты. В работе использовали препараты: ИФН альфа-2b, аскорбиновая кислота, Унитиол, бензокаин, альфа-токоферола ацетат, таурин. Из полученных препаратов готовили комбинации, соблюдая следующие соотношения:
- ИФН альфа-2b + аскорбиновая кислота (в соотношении 10 000 МЕ: 0,16 мг);
- ИФН альфа-2b + аскорбиновая кислота + альфа-токоферола ацетат (в соотношении 10 000 МЕ:0,16 мг:1,1 мг);
- ИФН альфа-2b + таурин (в соотношении 10 000 МЕ:0,2 мг);
- ИФН альфа-2b + таурин + бензокаин (в соотношении 10 000 МЕ:0,2 мг:1,1 мг);
- ИФН альфа-2b + Унитиол (в соотношении 10 000 МЕ:0,2 мг);
- контроль — ИФН альфа-2b.
Соотношения препаратов были основаны на содержании антиоксидантов в конечных лекарственных формах интерферона.
Из полученных комбинаций готовили серии трехкратных разведений на среде МЕМ (minimal essential medium) для культур клеток («Биолот», Санкт-Петербург, кат. № 1.3.3), начиная с концентрации по интерферону 5 × 106 МЕ/мл, и использовали полученные разведения для тестирования противовирусной активности комбинаций.
Вирусы. В работе использовали вирус гриппа А/Калифорния/07/09 (H1N1)pdm09 и вирус простого герпеса 1-го типа (штамм ЕС) из коллекции вирусных штаммов ФГБУ НИИ гриппа. Вирус гриппа пассировали в клетках MDCK (Madin-Darby canine kidney cell line) (ATCC #CCL-34), вирус герпеса — в клетках Vero (клетки почек зеленой мартышки) (ATCC #CCL-81) при 36 °C в атмосфере 5% CO2.
Оценка токсичности препаратов. Для контроля токсичности полученных препаратов и их комбинаций соединения вносили в лунки отдельных планшетов и инкубировали 2 суток при 37 °C. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37 °С в атмосфере 5% СО2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО (диметилсульфоксид), после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. Концентрацию считали токсической, если оптическая плотность соответствующих лунок была в два и более раз меньше, чем в контроле клеток без вируса и препаратов. Минимальную использованную концентрацию, приводящую к такому эффекту, считали минимальной токсической дозой (MTD).
Титрование вируса гриппа. Тестируемые препараты вносили в лунки 96-луночных планшетов с монослоем клеток MDCK и инкубировали в течение 1 часа. Из исходной вируссодержащей жидкости готовили серию десятикратных разведений на среде МЕМ. Клетки заражали серийными десятикратными разведениями материала от 100 до 10-6 и инкубировали в термостате при 36 °C в атмосфере 5% CO2 в течение 48 часов. По окончании срока инкубации культуральную жидкость переносили в лунки планшета для иммунологических реакций, после чего добавляли равный объем 1% куриных эритроцитов в физиологическом растворе и инкубировали 1 час при комнатной температуре.
Уровень репродукции вируса в лунках панели оценивали по реакции гемагглютинации (РГА) эритроцитов. За титр вируса принимали величину, противоположную десятичному логарифму наибольшего разведения вируса, способного вызвать положительную РГА, и выражали в логарифмах 50% экспериментальной инфекционной дозы вируса (lgEID50). О вирусингибирующем действии препаратов судили по снижению титра вируса в присутствии препарата по сравнению с соответствующими контрольными лунками без препаратов.
Титрование вируса герпеса. Тестируемые препараты вносили в лунки 96-луночных планшетов с монослоем клеток Vero и инкубировали в течение 1 часа при 36 °C в атмосфере 5% CO2. Десятикратные разведения вируссодержащего материала добавляли к клеткам и инкубировали в тех же условиях в течение 48 часов. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ), как описано выше («Оценка токсичности препаратов»). Вирус считали присутствующим в лунке (реакция положительна), если ее оптическая плотность была в два и более раз ниже, чем в контрольных лунках без вируса и без препарата. За титр вируса принимали величину, противоположную десятичному логарифму наибольшего разведения вируса, способного вызвать положительную реакцию, и выражали в логарифмах 50% экспериментальной инфекционной дозы вируса (lgEID50).
Обработка данных. Обработку результатов (расчет 50% эффективных доз) проводили при помощи программы линейной регрессии пакета Microsoft Excel. На основании полученных данных для каждого препарата и для интерферона в каждой комбинации препаратов рассчитывали 50% ингибирующую концентрацию (IC50), т. е. концентрацию соединения, снижающую вирусную продукцию вдвое, а также индекс селективности, представляющий собой отношение MTD к IC50.
Результаты исследования и их обсуждение
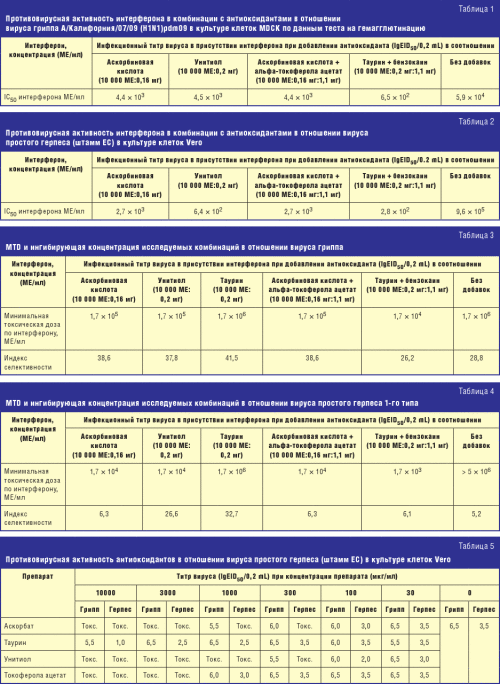
Результаты тестирования противовирусной активности испытуемых препаратов против вирусов гриппа и герпеса суммированы в табл. 1–4.
Уровень противовирусной активности испытанных комбинаций, оцениваемый по значению IC50, существенно различался, в ряде случаев достигая 100 раз («интерферон + таурин + бензокаин» по сравнению с монопрепаратом интерферона в случае вируса гриппа). Все добавки антиоксидантов повышали уровень противовирусной активности интерферона по сравнению с монопрепаратом интерферона.
С учетом уровня токсичности были рассчитаны индексы селективности, показывающие, во сколько раз уровень цитотоксичности превосходит уровень противовирусной активности для каждой комбинации. По этому показателю оптимальной комбинацией, превосходящей все остальные, оказалась комбинация интерферона с таурином, превосходящая интерферон в виде монопрепарата примерно в полтора раза в случае вируса гриппа и в шесть раз — в случае вируса герпеса.
Для выяснения вопроса о наличии противовирусной активности у самих препаратов антиоксидантов в отдельной группе опытов были изучены вирусингибирующие свойства антиоксидантов. Результаты экспериментов суммированы в табл. 5.
Как следует из представленных результатов, по уровню токсичности антиоксиданты в виде монопрепаратов существенно не отличались от антиоксидантов в составе комбинаций с интерфероном. В то же время два из них — таурин и Унитиол — обладали прямой противовирусной активностью, которая была более выраженной у таурина. Уровень ее был несколько ниже, чем в комбинации с интерфероном, что позволяет предполагать синергидное действие этих препаратов при сочетанном применении.
Выводы
Проведенная нами научно-исследовательская работа позволила наглядно продемонстрировать, что комбинация интерферона с тем или иным антиоксидантом обладает более высокой противовирусной активностью по сравнению с монопрепаратом интерферона (как в отношении пандемического штамма вируса гриппа, так и в отношении вируса простого герпеса 1-го типа). По результатам нашего исследования установлено, что наибольшей противовирусной активностью обладает комбинация «интерферон + таурин + бензокаин», а самым высоким индексом селективности — «интерферон + таурин». Интересным наблюдением стало то, что таурин, как и другие антиоксиданты, проявляет собственную противовирусную активность, но в отличие от других даже в максимальных исследованных дозах (5000 мкг/мл) это вещество не оказывает цитотоксического действия на клеточную культуру.
С учетом полученных результатов представляется целесообразным проведение экспериментов по изучению противовирусной активности и цитопротективного действия рассмотренных в настоящей работе комбинаций на животных моделях вирусных инфекций — летальной гриппозной пневмонии и летального герпетического энцефалита. В таких условиях могут быть реализованы как прямые противовирусные эффекты препаратов, как показано в настоящем исследовании, так и опосредованные эффекты, требующие для своего проявления взаимодействия клеточных субпопуляций и наличия иных, не прямых вирусных факторов патогенности, которые есть при инфекции в целостном организме и отсутствуют в гомогенной клеточной культуре.
Литература
- Васильев А. Н. Оценка влияния антиоксидантов на специфическую противовирусную активность интерферона альфа-2b человеческого рекомбинантного в отношении вируса простого герпеса в культуре клеток // Антибиотики и химиотерапия. 2010, № 7, с. 20–25.
- Васильев А. Н., Дерябин П. Г., Галегов Г. А. Противовирусная активность антиоксидантов и их комбинаций с интерфероном альфа-2b человеческим рекомбинантным в отношении вируса гриппа птиц A/H5N1 // Цитокины и воспаление. 2011, т. 10, № 2, с. 32–36.
- Зайцев А. А., Алпенидзе Д. Н., Салафет О. В., Синопальников А. И. Терапевтическая эффективность препаратов интерферона в лечении острого бронхита // Фарматека. 2011, № 5, с. 80–85.
- Горелов А. В., Грачева Н. М., Феклисова Л. В., Погорелова О. О. Результаты сравнительного исследования эффективности и безопасности препаратов интерферона-альфа в суппозиториях у детей, больных острыми респираторными вирусными инфекциями // Инфекционные болезни. 2009, № 3, с. 40–47.
- Scholtissek C., Quack G., Klenk H. D., Webster R. G. How to overcome resistance of influenza A viruses against adamantane derivatives // Antiviral Res. 1998; 37: 83–95.
- Woodhead M., Lavanchy D., Johnston S., Colman P., Fleming D. Neuraminidase inhibitors: progress in the management of influenza // Int J Clin Pract. 2000, Nov; 54 (9): 604–610.
- Mancuso C. E., Gabay M. P., Steinke L. M., Vanosdol S. J. Peramivir: an intravenous neuraminidase inhibitor for the treatment of 2009 H1N1 influenza // Ann Pharmacother. 2010, Jul-Aug; 44 (7–8): 1240–1249.
- Зайцев А. А., Клочков О. И., Горелов А. В. Острые респираторные вирусные инфекции: перспективы противовирусной терапии // Вестник семейной медицины. 2009, № 5, с. 4–11.
- Горелов А. В., Феклисова Л. В., Грачева Н. М., Каннер Е. В., Погорелова О. О., Целипанова Е. Е., Ше Ю. Ф., Черняева Е. В. Иммунотропная терапия острых респираторных вирусных инфекций в педиатрической практике — опыт клинического применения препаратов интерферона альфа // Consilium Medicum. Педиатрия. 2010, № 1, с. 72–80.
- Горелов А. В., Феклисова Л. В., Плоскирева А. А., Мескина Е. Р., Литвинчук О. А., Черняева Е. В. Комплексная терапия вирусной диареи у детей — первые результаты открытого сравнительного рандомизированного клинического исследования препаратов интерферона // Педиатрическая фармакология. 2011, т. 8, № 4, с. 106–114.
- Горелов А. В., Феклисова Л. В., Грачева Н. М., Алпенидзе Д. Н., Линькова Ю. Н., Салафет О. В., Черняева Е. В. Экзогенная интерферонизация как аспект этиопатогенетической терапии острых респираторных вирусных инфекций // Фарматека. 2011, № 15, с. 77–85.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru

