Материал и методы: 34 пациента (40 глаз) с возрастной макулярной дегенерацией (ВМД) были разделены на 2 группы. 1-ю группу составили пациенты с классической ХНВ (19 глаз), 2-ю — пациенты со скрытой ХНВ (21 глаз). В обеих группах уровень ВГД измеряли за 1 ч до инъекции, через 1 ч после нее, а также на 7-й день и через 1 мес. после интравитреального введения ранибизумаба 0,05 мл (0,5 мг).
Результаты исследования: уровень ВГД в 1-й группе через 1 ч после инъекции повысился (p0,05). Во 2-й группе уровень ВГД оставался стабильным в течение всего срока наблюдения (p0,05). Не было отмечено статистически значимой разницы в толщине сетчатки до и после интравитреального введения в обеих группах (p>0,05). Вместе с тем была установлена достоверная разница значений корригированной остроты зрения до и после лечения при межгрупповом сравнении (p
Выводы: у больных с классической ХНВ отмечено повышение уровня ВГД через 1 ч после интравитреального введения anti-VEGF препаратов. Различий в уровне офтальмотонуса у пациентов с возрастной макулодистрофией в группе с классической ХНВ и в группе со скрытой ХНВ через 1 ч, на 7-й день и через 1 мес. после введения препарата anti-VEGF не было установлено.
Ключевые слова: anti-VEGF препараты, уровень ВГД, хориоидальная неоваскуляризация, возрастная макулярная
дегенерация.
Для цитирования: Куроедов А.В., Захарова М.А., Гапонько О.В., Городничий В.В. Влияние интравитреального введения anti-VEGF препаратов на показатели офтальмотонуса у пациентов с классическими и скрытыми хориоидальными неоваскулярными мембранами // РМЖ «Клиническая Офтальмология». 2018. №2. С. 102-106
Kuroyedov A.V.1,2, Zakharova M.A.3, Gaponko O.V.1, Gorodnichy V.V.1
1 Central Military Clinical Hospital named after P. V. Mandryka, Moscow
2 Pirogov Russian National Research Medical University, Moscow
3 S. Fyodorov Eye Microsurgery Federal State Institution, Moscow
Aim: to study the changes in the level of intraocular pressure (IOP) in the early period after the intravitreal administration of anti-VEGF drugs in patients with classical and occult choroidal neovascularization (CNV).
Patients and Methods: 34 patients (40 eyes) with age-related macular degeneration were divided into 2 groups. Group 1 —
the patients (19 eyes) with classic CNV, group 2 — the patients (21 eyes) with occult CNV. In all patients the IOP were measured an hour before the treatment, on the 7-th day after the injection of ranibizumab and at the 1-month follow-up visit.
Results: in group 1 the level of IOP increased an hour after the injection, but on the 7th day it was already at the initial level, which persisted after 1 month (p>0,05). In the second group, the IOP level remained stable throughout the follow-up period
(p <0.05). Differences in the level of IOP in an hour, on the 7th day and 1 month after intravitreal injection in patients of both groups and between groups were not detected (p> 0.05). There was no significant difference in retinal thickness before and after intravitreal injection in both groups (p> 0.05). However, significant difference was noted in patients of both groups in corrected visual acuity before and after treatment (p<0.05).
Conclusions: in patients with a classical choroidal neovascularization, an increase in the IOP level was observed one hour after the intravitreal administration of anti-VEGF drugs. The difference in the IOP-level in patients with age-related macular degeneration in the group with classical CNV and in the group with occult CNV after intravitreal injection of the anti-VEGF was not detected in an hour, on the 7th day and 1 month after the administration of the anti-VEGF preparation.
Key words: anti-VEGF drugs, IOP-level, choroidal neovascularization, age-related macular degeneration.
For citation: Kuroyedov A.V., Zakharova M.A., Gaponko O.V., Gorodnichy V.V. The effect of intravitreal injection of anti-VEGF drugs on the ophthalmotonus values in patients with classic and occult choroidal neovascularization.
RMJ “Clinical ophthalmology”. 2018;2:102–106.
Влияние интравитреального введения anti-VEGF препаратов на показатели офтальмотонуса у пациентов с классическими и скрытыми хориоидальными неоваскулярными мембранами
Возрастная макулярная дегенерация (ВМД) — одна из ведущих причин потери зрения среди людей старше 50 лет в развитых странах и третья причина слепоты в мире [1, 2]. Внедрение в клиническую практику ингибиторов фактора роста эндотелия сосудов расширило возможности лечения данной патологии, а доказанная эффективность anti-VEGF препаратов позволила им стать терапией первой линии для неоваскулярной ВМД. Однако по мере накопления клинического опыта, вместе с установленной так называемой «резистентной» формой заболевания, был выявлен и ряд побочных эффектов, характерных для интравитреальных инъекций данной группы препаратов. К одному из них относится повышение уровня внутриглазного давления (ВГД) [3, 4]. Было установлено, что непосредственно после введения anti-VEGF препаратов уровень ВГД резко повышается, а значения его могут варьировать в зависимости от размера глазного яблока, вводимого объема препарата, толщины и ригидности склеры [5, 6]. В дальнейшем уровень ВГД постепенно снижается до исходных значений в течение 30–60 мин после инъекции [6–8]. Однако в некоторых исследованиях отмечается появление устойчивой офтальмогипертензии, которая встречается в 3,1–11,6% случаев [9–13]. Патофизиологические механизмы развития стойкой послеоперационной гипертензии в настоящее время изучены недостаточно [14]. В ряде публикаций имеется указание на факторы риска повышения уровня ВГД в отдаленные сроки после интравитреальных инъекций. К ним относятся количество инъекций, интервал между инъекциями, применяемый anti-VEGF препарат, сопутствующая глаукома, нарушение целостности задней капсулы хрусталика после дисцизии вторичной катаракты и др. [13, 15–18].
Однако другие исследователи не выявили достоверной зависимости между факторами риска и развитием стойкой офтальмогипертензии после интравитреального введения препаратов anti-VEGF [19–22]. Была выдвинута гипотеза о том, что развитие офтальмогипертензии после интравитреальных инъекций может быть связано с CD36 генным полиморфизмом [23]. Таким образом, имеющиеся данные о возможных причинах и факторах риска, которые приводят к стойкому повышению уровня ВГД после инъекций препаратов anti-VEGF, противоречивы. В этой связи целью исследования стало изучение особенностей уровня ВГД в ранние сроки после интравитреального введения препаратов anti-VEGF у пациентов с классическими и скрытыми хориоидальными неоваскулярными мембранами (ХНВ).
Содержание статьи
Материал и методы
Исследование было проведено на базе офтальмологического отделения ФКУ «Центральный военный клинический госпиталь им. П. В. Мандрыка» Минобороны России в период с мая 2016 по январь 2017 г. Финальный протокол обследования включал данные 34 пациентов (40 глаз) с «влажной» формой ВМД. Верификация диагноза, включая наличие хориоидальной неоваскуляризации, была подтверждена с помощью флюоресцентной ангиографии (ФАГ) и оптической когерентной томографии (ОКТ) на приборе спектрального типа (Spectralis, Heidelberg Engineering, Германия).
Все пациенты были разделены на 2 группы: 1-ю группу составили пациенты с классической ХНВ (19 глаз), 2-ю группу — пациенты со скрытой ХНВ (21 глаз). В обеих группах проводились интравитреальные инъекции 0,05 мл (0,5 мг) препарата ранибизумаб двумя сертифицированными хирургами. Критерием включения пациентов в данное исследование, помимо основного диагноза, было отсутствие сопутствующей глаукомы. Уровень ВГД измеряли за 1 ч до инъекции, через 1 ч после нее, а также на 7-й день и через 1 мес. после интравитреального введения anti-VEGF препарата с использованием метода тонометрии по Маклакову (груз 10 г). Исследования офтальмотонуса проводились в клинике в интервале от 10:00 до 12:00. Определение остроты зрения у всех пациентов проводилось в стандартных условиях освещения по таблицам Снеллена. Наилучшая корригированная острота зрения проверялась в условиях оптимальной коррекции. Срок наблюдения пациентов в данном исследовании ограничивался интервалом наблюдения 35–45 дней, что было определено предварительно дизайном исследования вследствие планирования повторной инъекции anti-VEGF препарата.
Методы статистической обработки
Полученные результаты вносились в общую таблицу данных на сертифицированном оборудовании с использованием лицензированной программной операционной оболочки. Статистическая обработка анализируемых данных выполнялась одним исследователем с помощью программы Statistica, версия 10.0 (StatSoft, Inc., США). Приводимые параметры проверялись на соответствие закону нормального распределения (критерий Шапиро — Уилка, p>0,05). Числовые данные, имеющие нормальное распределение, представлены в формате: М±σ, где М — среднее значение, σ — стандартное отклонение среднего значения. При распределении, отличном от нормального (критерий Шапиро — Уилка, p
Результаты и обсуждение
Среди обследованных было 61,8% мужчин (21 человек) и 38,2% женщин (13 человек). Средний возраст всех пациентов составил 76,79±7,13 года. Средний возраст мужчин составил 76,00±7,27 года, женщин — 78,08±6,98 года. Средний возраст пациентов в 1-й группе составил 78,06±6,92 года, во 2-й группе — 76,15±6,94 года. Достоверных отличий по возрасту у пациентов в обеих группах установлено не было (p>0,05).
Длительность установленного ранее диагноза на момент включения в исследование в 1-й группе составила 11 (3; 24) мес., во 2-й группе — 12 (7; 34) мес. Количество интравитреальных инъекций anti-VEGF препарата до момента включения в 1-й группе составило 2 (1; 3) инъекции, во 2-й группе — также 2 (0; 3) инъекции. Достоверных отличий по длительности верифицированного диагноза и количеству предыдущих интравитреальных инъекций у пациентов в обеих группах выявлено не было (p>0,05).
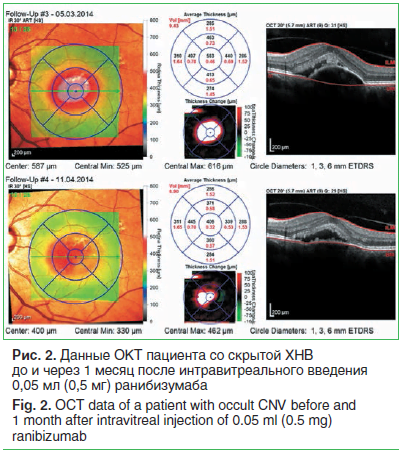
По данным ОКТ, толщина сетчатки в 1-й группе до интравитреального введения anti-VEGF препарата составила 353 (307; 460) мкм, во 2-й группе — 375 (312; 416) мкм (рис. 1, 2). Корригированная острота зрения у пациентов 1-й группы до начала лечения составила 0,2 (0,05; 0,3), во 2-й группе этот же показатель был равен 0,4 (0,2; 0,6), p=0,008. После интравитреального введения anti-VEGF препарата в 1-й группе толщина сетчатки в макуле снизилась до 316 (263; 428) мкм, во 2-й группе — до 291 (268; 394) мкм. Вместе с тем статистически значимой разницы между показателем «толщина сетчатки в макуле» до интравитреального введения и этим же показателем после введения в обеих группах выявлено не было (p>0,05). Корригированная острота зрения после инъекции повысилась в обеих группах: в 1-й группе составила 0,3 (0,05; 0,3), во 2-й группе —
0,4 (0,4; 0,6), и эти различия были статистически достоверны у пациентов обеих групп (p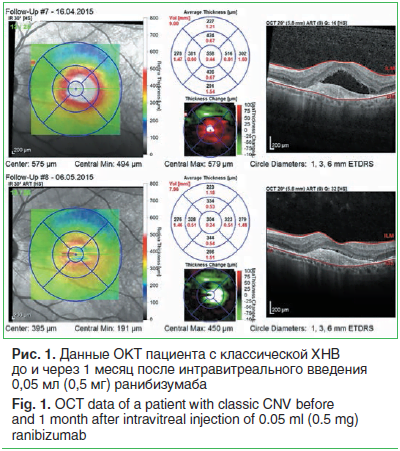
Уровень ВГД в 1-й группе через 1 ч после инъекции повысился до 20 (17; 22) мм рт. ст., однако на 7-й день находился уже на исходном уровне, который сохранялся и через 1 мес. Медикаментозное местное гипотензивное лечение не назначалось. Во 2-й группе уровень ВГД оставался стабильным в течение всего срока наблюде-
ния. Результаты исследования уровня ВГД до и после интравитреального введения anti-VEGF препарата в обеих группах представлены в таблице 1.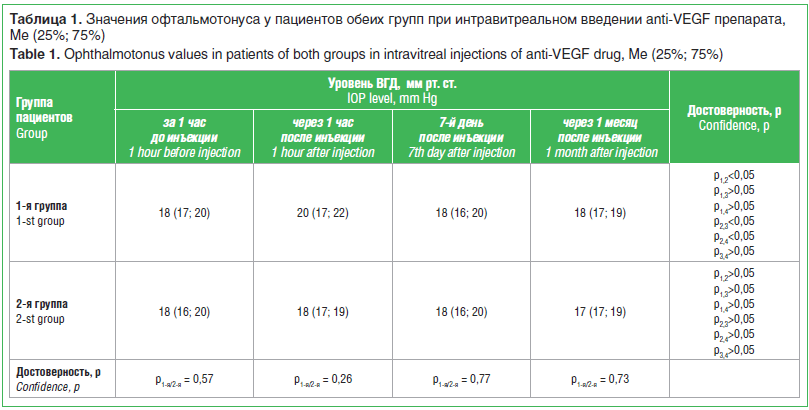
В 1-й группе была обнаружена статистически достоверная разница между уровнем ВГД через 1 ч после инъекции и уровнями офтальмотонуса до введения препарата, а также через 7 дней и 1 мес. после инъекции (p0,05). Во 2-й группе статистически достоверных отличий в уровне ВГД через 1 ч, на 7-й день и через 1 мес. после интравитреальной инъекции у пациентов 2-й группы не выявлено (p>0,05). При сравнении уровня офтальмотонуса в обеих группах на разных сроках наблюдения не было отмечено статистически достоверной разницы этих параметров (p>0,05).
Согласно представленным в таблице данным, мы не обнаружили повышения уровня ВГД через 7 дней и 1 мес. по сравнению с исходными показателями на фоне применения anti-VEGF препаратов. Следует отметить, что количество ранее выполненных интравитреальных введений в обеих группах составило от 0 до 6 инъекций. В течение всего периода наблюдения (1 мес., 4 измерения уровня ВГД) показатели офтальмотонуса находились в «коридоре» (min/max) от 14 до 21 мм рт. ст. в группе пациентов с классической ХНВ и в интервале от 13 до 24 мм рт. ст. у лиц со скрытой ХНВ. Таким образом, с учетом различий «тонометрических коридоров» вероятность колебаний офтальмотонуса у лиц со скрытой ХНВ существует, но в нашем наблюдении, даже у пациентов с шестикратным введением ранибизумаба из этой группы не было отмечено повышения уровня ВГД.
Ограничения исследования
Следует учитывать, что срок наблюдения составлял всего 1 мес. Кроме того, в нашем исследовании не было разделения пациентов в зависимости от площади распространения ХНВ, а также разделения в зависимости от количества ранее выполненных инъекций на дополнительные подгруппы, в т. ч. отдельно не выделяли тех пациентов, кому она была сделана впервые.
Выводы
У больных с «влажной» формой ВМД и классической ХНВ отмечено статистически достоверное повышение уровня ВГД через 1 ч после выполнения интравитреальной инъекции (p0,05). Наличие классической ХНВ может являться фактором риска для кратковременного повышения уровня ВГД при использовании повторной anti-VEGF терапии в дозе 0,05 мл (0,5 мг).
Существует необходимость продолжения исследования показателей офтальмотонуса у лиц с классической и скрытой ХНВ и разными исходными уровнями ВГД на фоне повторных введений anti-VEGF препаратов.
Сведения об авторах: 1,2Куроедов Александр Владимирович — д.м.н., профессор, начальник офтальмологического отделения; 3Захарова Мария Андреевна — к.м.н., врач-офтальмолог; 1Гапонько Олеся Владимировна — к.м.н., врач-офтальмолог; 1Городничий Виталий Владимирович — врач-офтальмолог. 1ФКУ «ЦВКГ им. П. В. Мандрыка» Минобороны России. 107014, Российская Федерация, г. Москва, ул. Б. Оленья, д. 8а. 2ФГБОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России. 117997, Российская Федерация, г. Москва, ул. Островитянова, д. 1. 3ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С. Н. Федорова» Минздрава России. 127486, Российская Федерация, г. Москва, Бескудниковский бульв., д. 59а. Контактная информация: Куроедов Александр Владимирович, e-mail: akuroyedov@hotmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 14.11.2017.
About the authors: 1,2Aleksander V. Kuroyedov — professor, Сhief of ophthalmology Department; 3Maria A. Zakharova — PhD, ophthalmologist; 1Olesya V. Gaponko — PhD, ophthalmologist; 1Vitaly V. Gorodnichy — ophthalmologist. 1Central Military Clinical Hospital named after P. V. Mandryka. 8А, B. Oleniya str., Moscow, 107014, Russian Federation. 2Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation. 3S. Fyodorov Eye Microsurgery Federal State Institution. 59а, Beskudnikovskaya str., Moscow, 127486, Russian Federation. Contact information: Aleksander V. Kuroyedov, e-mail: akuroyedov@hotmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.11.2017.
Литература
1. Wong W.L., Su X., Li X. et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2(2):106–116.
2. Pascolini D., Mariotti S.P. Global estimates of visual impairment: 2010. Br J Ophthalmol. 2012;96(5):614–618.
3. Rosenfeld P.J., Brown D.M., Heier J.S. et al. MARINA study group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1419–1431.
4. Brown D.M., Kaiser P.K., Michels M. et al. ANCHOR study group. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355(14):1432–1444.
5. Kotliar K., Maier M., Bauer S. et al. Effect of intravitreal injections and volume changes on intraocular pressure: Clinical results and biomechanical model. Acta Ophthalmol Scand. 2007;85(7):777–781.
6. Gismondi M., Salati C., Salvetat M.L. et al. Short-term effect of intravitreal injection of ranibizumab (lucentis) on intraocular pressure. J Glaucoma. 2009;18(9):658–661.
7. Sharei V., Hohn F., Kohler T. et al. Course of intraocular pressure after intravitreal injections of 0.05 mL ranibizumab (Lucentis). Eur J Ophthalmol. 2010;20(1):174–179.
8. Lee J.W., Park H., Choi J.H. et al. Short-term changes of intraocular pressure and ocular perfusion pressure after intravitreal injection of bevacizumab or ranibizumab. BMC Ophthalmol. 2016;31(16):69–76.
9. Good T.J., Kimura A.E., Mandava N., Kahook M.Y. Sustained elevation of intraocular pressure after intravitreal injections of anti-VEGF agents. Br J Ophthalmol. 2011;95(8):1111–1114.
10. Аветисов С.Э., Еричев В.П., Будзинская М.В. и др. Возрастная макулярная дегенерация и глаукома: мониторинг внутриглазного давления после интравитреальных инъекций. Вест. офтальмол. 2012;6:3–6 [Avetisov S.E., Erichev V.P., Budzinskaia M.V. et al. Age-related Macular Degeneration and Glaucoma: Intraocular Pressure Monitoring after Intravitreal Injections. Ophthalmol. Bull. 2012;6:3–6 (in Russ.)].
11. Dedania V.S., Bakri S.J. Sustained elevation of intraocular pressure after intravitreal anti-vegf agents what is the evidence? Retina. 2015;35(5):841–858.
12. Mathalone N., Arodi-Golan A., Sar S. et al. Sustained elevation of intraocular pressure after intravitreal injections of bevacizumab in eyes with neovascular age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol. 2012;250(10):1435–1440.
13. Reis G.M., Grigg J., Chua B. et al. Incidence of Intraocular Pressure Elevation following Intravitreal Ranibizumab (Lucentis) for Age-related Macular Degeneration. J Curr Glaucoma Pract. 2017;11(1):3–7.
14. Аветисов С.Э., Еричев В.П., Будзинская М.В., Карпилова М.А. Возрастная макулярная дегенерация и внутриглазная гипертензия. Глаукома. 2013;1:62–67 [Avetisov S.E., Erichev V.P, Budzinskaya M.V., Karpilova M.A. Age-related macular degeneration and ocular hypertension. Glaucoma. 2013;1:62–67 (in Russ.)].
15. Hoang Q.V., Tsuang A.J., Gelman R. et al. Clinical predictors of sustained intraocular pressure elevation due to intravitreal anti-vascular endothelial growth factor therapy. Retina. 2013;33(1):179–187.
16. Pershing S., Bakri S.J., Moshfeghi D.M. Ocular hypertension and intraocular pressure asymmetry after intravitreal injection of anti-vascular endothelial growth factor agents. Ophthalmic Surg Lasers Imaging Retina. 2013;44(5):460–464.
17. Adelman R.A., Zheng Q., Mayer H.R. Persistent ocular hypertension following intravitreal bevacizumab and ranibizumab injections. J Ocul Pharmacol Ther. 2010;26(1):105–110.
18. Куроедов А.В., Авдеев Р.В., Александров А.С. и др. Степень взаимного влияния и характеристики морфофункциональных взаимоотношений между первичной открыутогольной глаукомой и макулодистрофией. Офтальмолог. ведомости. 2014;1:19–27 [Kuroyedov A.V., Avdeev R.V., Aleksandrov A.S. et al. A cross-impact degree and morpho-functional correlation characteristics between primary open-angle glaucoma and age-related macular degeneration // Ophthalmology Journal. 2014;1:19–27 (in Russ.)].
19. Wehrli S.J., Tawse K., Levin M.H. et al. A lack of delayed intraocular pressure elevation in patients treated with intravitreal injection of bevacizumab and ranibizumab. Retina. 2012;32(7):1295–1301.
20. Choi D.Y., Ortube M.C., McCannel C.A. et al. Sustained elevated intraocular pressures after intravitreal injection of bevacizumab, ranibizumab, and pegaptanib. Retina. 2011;31(6):1028–1035.
21. Kim Y.J., Sung K.R., Lee K.S. et al. Long-term effects of multiple intravitreal antivascular endothelial growth factor injections on intraocular pressure. Am J Ophthalmol. 2014;157(6):1266–1271.
22. Мамиконян В.Р., Галоян Н.С., Будзинская М.В. и др. Особенности внутриглазного давления и глазного кровотока при интравитреальном введении препаратов, ингибирующих фактор роста сосудистого эндотелия. Вестн. офтальмол. 2014;5:16–21 [Mamikonyan V.R., Galoyan N.S., Budzinskaya M.V. et al. Intraocular pressure and ocular blood flow features intravitreal infection of anti-vascular endothelial growth factor agents. Ophthalomol. Bull. 2014;5:16–21 (in Russ.)].
23. Matuskova V., Balcar V.J., Khan N.A. et al. CD36 gene is associated with intraocular pressure elevation after intravitreal application of anti-VEGF agents in patients with age-related macular degeneration: Implications for the safety of the therapy. Ophthalmic Genet. 2017;30:1–7.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
