Цветное допплеровское сканирование как метод оценки эффективности декомпрессии орбиты у пациентов с эндокринной офтальмопатией
Введение
Эндокринная офтальмопатия (ЭОП) — это аутоиммунное заболевание, поражающее ткани орбиты и проявляющееся ретракцией век, отеком, экзофтальмом, диплопией и оптической нейропатией [1, 2]. Тяжесть и активность заболевания не отличаются у пациентов с одно- или двухсторонним поражением орбиты, а также у пациентов с гипер- или гипотиреоидизмом [2, 3]. Отдельно стоит отметить, что наряду с воспалительными изменениями тканей орбиты у больных с ЭОП формируются определенные гемодинамические изменения в полости орбиты, которые прямо или косвенно отражаются на клинической картине течения заболевания [3–5].
В частности, имеются данные о снижении кровотока по верхней глазной вене (ВГВ) при проведении цветного допплеровского сканирования (ЦДС) [3–7]. ЦДС, являясь достаточно безопасным и неинвазивным методом оценки регионарного кровотока, может давать информацию о характере кровотока не только по ВГВ, но и по глазной
артерии (ГА), центральной артерии сетчатки (ЦАС), центральной вене сетчатки, задним цилиарным артериям [8].
Несмотря на высокую эффективность консервативной терапии больных с ЭОП, тем не менее достаточно большой группе пациентов требуется выполнение декомпрессии орбиты [1]. Возможности ЦДС в оценке гемодинамических изменений мягких тканей глазницы до и после декомпрессии орбиты представлены лишь в нескольких работах [9]. В основном они отражают изменения венозного кровотока, не касаясь оценки артериального кровоснабжения. Нами была проведена комплексная оценка артериального и венозного кровоснабжения до и после декомпрессии орбиты у пациентов с ЭОП методом ЦДС.
Содержание статьи
Клинический опыт
Нами были обследованы 7 пациенток (11 орбит) с ЭОП легкой и средней степени тяжести, в неактивной фазе течения заболевания — CAS<3 (Clinical Activity Score — Шкала клинической активности эндокринной офтальмопатии), которым проводили ЦДС сосудов орбиты до и после декомпрессии орбиты в период с июля по октябрь 2018 г. Возраст варьировал от 32 до 47 лет. Все пациентки имели стабильное эутиреоидное состояние на протяжении не менее 6 мес. У всех больных определялась смешанная форма ЭОП на основании предоперационных компьютерных томограмм орбит. Предоперационное офтальмологическое обследование включало визометрию, тонометрию, биомикроскопию, офтальмоскопию, экзофтальмометрию по Гертелю, компьютерную периметрию, исследование цветового зрения. Экзофтальм до операции составлял 26,5±2,8 мм (от 23 до 30 мм). В 3 случаях экзофтальм был односторонним.
Пациентки с оптической нейропатией, поражением роговицы, системными заболеваниями (сахарный диабет, сердечно-сосудистые заболевания), имевшейся ранее декомпрессией орбиты, а также курящие были исключены из исследования.
ЦДС было выполнено одним специалистом на дооперационном этапе, а также на 1-е, 10-е сут и через 1 мес. после операции на аппарате Philips iU22 с датчиком 12,5 МГц. Исследование проводилось в положении лежа на спине с приподнятым на 30° головным концом. Были измерены пиковая систолическая скорость (ПСС) и пиковая диастолическая скорость (ПДС), рассчитан индекс резистентности (ИР), определяемый как ПСС-ПДС/ПСС, для ГА и ЦАС. Были определены максимальная и минимальная скорость кровотока по ВГВ (рис. 1).
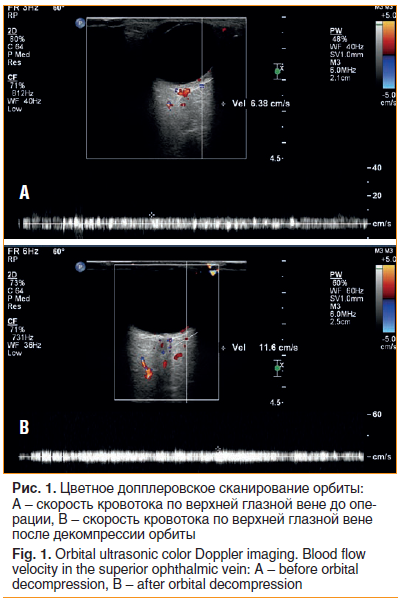
Транскарункулярным (медиальная стенка) и латеральным ретрокантальным доступом (латеральная стенка) были выполнены наружная и внутренняя декомпрессия орбиты по эстетическим показаниям для регресса экзофтальма и грыж верхнего и нижнего век. Подробности и технические особенности проведения операции представлены в нашей предыдущей работе [10].
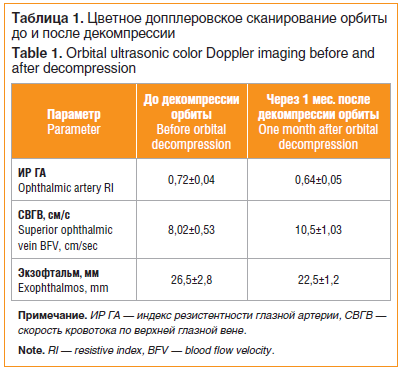
Только «глубокая» латеральная орбитотомия была выполнена на 8 орбитах, а в сочетании с медиальной орбитотомией — на 3 орбитах. Внутренняя декомпрессия (липэктомия) проводилась у всех пациенток. Экзофтальм после операции составил 22,5±1,2 мм (от 21 до 24 мм). Гемодинамические характеристики кровотока в орбите значительно улучшились после декомпрессии орбиты (табл. 1).
Обсуждение
Снижение кровотока по ВГВ среди пациентов с ЭОП показано во многих работах [3–7]. Современных работ, посвященных данной проблеме, недостаточно, что делает эти публикации незаменимыми в изучении данной тематики. Наши результаты показывают, что, несмотря на различие максимальной и минимальной скорости кровотока по ВГВ у пациентов, прослеживается четкая тенденция к ее увеличению после декомпрессии орбиты. Это подтверждает тот факт, что ведущей причиной гемодинамических нарушений является внешняя компрессия сосудистых образований у больных с ЭОП гипертрофированными мягкотканными образованиями орбиты (клетчатка, глазодвигательные мышцы). Другие возможные факторы нарушения венозного оттока в виде повышенного системного артериального давления или повышенного внутриглазного давления являются малозначимыми [1, 11].
Очевидно, что нарушение венозного оттока ввиду внешнего сдавления способствует усугублению экзофтальма, хемоза, отека век у пациентов с ЭОП. Внешняя компрессия может привести не только к снижению кровотока, но и к тромбозу ВГВ (рис. 2). По мнению некоторых авторов, именно венозный стаз, являющийся одним из элементов триады Вирхова, предрасполагает к тромбообразованию [12]. Тромбоз ВГВ — редкое состояние, которое может привести к потере зрения по причине компартмент-синдрома или вторичной глаукомы [12, 13].
![Рис. 2. Тромбоз правой верхней глазной вены у пациента с эндокринной офтальмопатией (указан стрелкой) [13] Рис. 2. Тромбоз правой верхней глазной вены у пациента с эндокринной офтальмопатией (указан стрелкой) [13]](https://medblog.su/wp-content/uploads/2019/08/1567174522_190_tsvetnoe-dopplerovskoe-skanirovanie-kak-metod-otsenki-effektivnosti-dekompressii-orbity-u-patsientov-s-endokrinnoj-oftalmopatiej-kalandari-a-a-nosova-a-g-kutrovskaya-n-yu-levchenko-o-v.png)
По нашим предварительным результатам, декомпрессия орбиты, направленная на увеличение объема орбитальной полости и приводящая к снижению застойных явлений в глазнице, способствует увеличению скорости кровотока по ВГВ и ГА. М. Pérez-López et al. на 26 орбитах также показали значительное снижение ИР ГА и ЦАС после декомпрессивной орбитотомии [9].
Существуют две гипотезы относительно высоких показателей ИР ЦАС и ГА на дооперационном этапе [5]. Первая гипотеза основывается на наружной компрессии сосудов орбиты измененными глазодвигательными мышцами или гипертрофированной жировой клетчаткой как последствиями перенесенного воспаления. Вторая гипотеза коррелирует непосредственно с характером и степенью выраженности воспалительных изменений интраорбитальных структур в момент манифестации заболевания или активизации процесса [5].
Наши результаты и результаты М. Pérez-López et al. [9] подтверждают первую гипотезу (все пациенты по шкале CAS имели показатель ниже 3 и стабильное эутиреоидное состояние).
Проведенное исследование имеет определенные ограничения, в частности малое количество пациентов и отсутствие группы контроля. Однако предварительные результаты подчеркивают преимущества использования ЦДС как метода объективного контроля эффективности декомпрессии орбиты у пациентов с ЭОП. Безопасность и информативность метода определяют возможность использования дооперационных данных ЦДС наряду с результатами клинического и лабораторно-инструментальных исследований в качестве одного из критериев при определении показаний для хирургического лечения. Особенно актуальным является проведение оценки гемодинамики внутри орбиты у пациентов с оптической нейропатией до и после проведения хирургического лечения. Не в полной мере известна степень влияния различных видов декомпрессии орбиты на венозное и артериальное кровообращение у пациентов с ЭОП. Для ответа на эти вопросы нами планируется проведение рандомизированного исследования.
Заключение
ЦДС является информативным неинвазивным ультразвуковым методом исследования сосудов орбиты у пациентов с ЭОП, а также с осложнениями этого аутоиммунного заболевания, такими как оптическая нейропатия. Данные ЦДС в комплексном дооперационном обследовании больных с ЭОП могут быть использованы при определении показаний к хирургическому лечению. Выявление снижения ЛСК по ВГВ и увеличения ИР ГА может способствовать выбору метода декомпрессии орбиты у больных с ЭОП. Проведение ЦДС у пациентов с ЭОП после проведения костной декомпрессии орбиты выявило увеличение венозного оттока по ВГВ и снижение ИР ГА, что позволяет оценивать эффективность оперативного лечения пациентов с ЭОП.
Сведения об авторах:
Каландари Алик Амиранович — к.м.н., врач-нейрохирург, заместитель директора по лечебной работе КМЦ, ORCID iD 0000-0003-4161-0940;
Носова Анастасия Геннадьевна — врач ультразвуковой диагностики КМЦ, ORCID iD 0000-0003-3066-0117;
Кутровская Наталья Юрьевна — к.м.н., нейроофтальмолог КМЦ, ORCID iD 0000-0002-3202-570X;
Левченко Олег Валерьевич — д.м.н., проректор по лечебной работе, ORCID iD 0000-0003-0857-9398.
ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России. 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1.
Контактная информация: Каландари Алик Амиранович, e-mail: kalandarialik@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 08.11.2018.
About the authors:
Alik A. Kalandari — MD, PhD, neurosurgeon, Deputy Medical Director of CMC, ORCID iD 0000-0003-4161-0940;
Anastasiya G. Nosova — MD, specialist in ultrasound examination of CMC, ORCID iD 0000-0003-3066-0117;
Natal’ya Yu. Kutrovskaya — MD, PhD, neuro-ophthalmologist of CMC, ORCID iD 0000-0002-3202-570X;
Oleg V. Levchenko — MD, PhD, Medical Prorector, ORCID iD 0000-0003-0857-9398.
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov. 20/1, Delegatskaya str., Moscow, 127473, Russian Federation.
Contact information: Alik A. Kalandari, e-mail: kalandarialik@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 08.11.2018.
материал rmj.ru
