Введение
В число наиболее актуальных проблем современной офтальмологии входит вопрос долгосрочного сохранения зрительных функций у больных глаукомой при, казалось бы, достигнутом уровне целевого внутриглазного давления (ВГД). Характерное ухудшение светочувствительности на фоне истончения ганглиозного комплекса сетчатки и слоя нервных волокон, выявляемое при динамическом наблюдении, свидетельствует о прогрессирующем течении глаукомной оптической нейропатии и встречается, по данным разных источников, у 10–15% пациентов [1–3].
Прогрессирование заболевания, несмотря на снижение ВГД до нормальных значений любым из возможных способов (назначением местного гипотензивного режима, путем применения лазерных или хирургических методов), происходит из-за непрекращающейся гибели (апоптоза) ганглиозных клеток сетчатки и их аксонов, что является следствием грубых изменений метаболических процессов в тканях глаза [4].
Большинство исследователей связывают этот патологический процесс с изменениями в системной гемодинамике. По результатам проведения суточного мониторирования системного артериального давления (СМСАД) у пациентов с нестабилизированной глаукомой наиболее часто выявляются: повышение среднего дневного систолического артериального давления (АД), нарушение суточных биологических ритмов (циркадности) АД, повышенная выраженность колебаний систолического АД в дневные и, особенно, в ночные часы, увеличение степени снижения диастолического АД в ночные часы — на этом фоне усугубляется течение глаукомного процесса, когда зрительный нерв становится более уязвимым под действием даже незначительных колебаний ВГД из-за нарушения кровоснабжения и обменных процессов в зрительном нерве. Дополнительно на фоне длительного периода гипотонии в ночные часы происходит ишемизация тканей вследствие сдавливания сосудов сетчатки и зрительного нерва даже на фоне нормальных или пограничных значений ВГД [2, 4]. Результаты экспериментального исследования свидетельствуют о том, что ночная гипотензия при наличии других сосудистых факторов риска может снижать кровоток в головке зрительного нерва ниже критического уровня и, таким образом, играть роль в патогенезе передней ишемической оптической нейропатии и глаукомной оптической нейропатии; т. е. ночная гипотензия может быть последним решающим звеном в многофакторной ситуации [5]. Наиболее важным патогенетическим звеном в цепи каскада этапов апоптоза ганглиозного комплекса сетчатки является выраженное снижение перфузионного давления, которое напрямую зависит от уровня АД в сосудах заднего отдела глаза и диска зрительного нерва (ДЗН), уровня ВГД и оказываемого сопротивления кровотоку [6].
Испытывая острую необходимость сохранения работоспособности аксонов ганглиозных клеток сетчатки и восстановления функции нервных волокон, находящихся в процессе дегенерации, клиницисты продолжают поиск дополнительной лекарственной поддержки, воздействия на основные звенья патогенеза глаукомного процесса и предотвращения процесса апоптоза нервных клеток.
В условиях стабилизированного офтальмотонуса в числе наиболее эффективных средств нейропротективной терапии, таких как кортексин, нифедипин, мемантин и другие, может быть рассмотрен Ретиналамин® — комплекс тканеспецифичных полипептидов, оказывающих положительное влияние на процессы регенерации нейроэпителия. Экспериментальные исследования с повреждением тканей глаза показали, что на фоне применения данного пептидного комплекса количество выживших и сохранивших свои функции ганглиозных клеток сетчатки существенно выше, отмечено замедление интенсивности атрофических процессов в слое их аксонов. При этом наиболее устойчивыми к стрессовым факторам оказались мелкие и средние клетки. Принцип действия препарата заключается: в нормализации проницаемости клеточных мембран, что препятствует накоплению в них веществ, ускоряющих процессы апоптоза (например, глутамата и ионов кальция); улучшении продукции белка в клетках; торможении процессов перекисного окисления липидов; восстановлении энергетических запасов в результате повышения активности мюллеровских клеток. Кроме того, он способствует улучшению функционального контакта светочувствительных клеток, восстановлению нормальной проницаемости сосудистой стенки [7, 8]. Препарат оказывает нейтрализующее действие на последствия ишемического каскада, непосредственно влияя на количество выживших клеток, а следовательно, способен благоприятно воздействовать на поддержание и сохранение зрительных функций [8].
Цель исследования: изучить эффективность нейропротективного препарата (комплекса водорастворимых полипептидных фракций) у пациентов с нестабилизированным течением первичной открытоугольной глаукомы и нормализованным офтальмотонусом на основе отслеживания сохранности морфологических и функциональных параметров сетчатки и зрительного нерва.
Особенностью нашей работы было то, что мы заведомо включали в исследование пациентов с системными нарушениями гемодинамики для оценки возможности ингибирующего влияния исследуемого препарата на дегенеративные процессы в сетчатке в условиях дополнительного фактора риска — ишемии.
Материал и методы
Проведено проспективное рандомизированное сравнительное клиническое исследование, в которое было включено 30 больных (60 глаз) первичной открытоугольной глаукомой (ПОУГ) развитой и далеко зашедшей стадий и нестабилизированным течением. Каждый пациент был включен в исследование только после получения его согласия. Максимальная корригированная острота зрения пациентов составляла 0,7–0,8. У всех пациентов на момент обследования ВГД было компенсировано на местном гипотензивном режиме или хирургически и составляло в среднем 15,5±1,3 мм рт. ст. Однако, несмотря ни на что, при динамическом обследовании (период наблюдения от 3 до 6 мес.) у данных пациентов было выявлено прогрессирование глаукомной оптической нейропатии, что выражалось в ухудшении светочувствительности сетчатки, состояния ДЗН и комплекса ганглиозных клеток сетчатки и подтверждалось результатами обследований при динамическом наблюдении. Глаукома II стадии была диагностирована на 38, III стадии — на 22 глазах. Возраст больных варьировал от 54 до 65 лет, средний возраст — 59±2,74 года. Те или иные изменения системной гемодинамики, в частности наличие системной гипотонии, отмечали 10 пациентов, 19 пациентов имели в анамнезе установленный диагноз гипертонической болезни либо синдром артериальной гипертензии и получали системную гипотензивную терапию.
Критерии невключения в исследование: максимальная корригированная острота зрения хотя бы на одном глазу ниже 0,4; наличие в анамнезе любой патологии сетчатки и зрительного нерва неглаукомного характера; наличие в анамнезе любых воспалительных заболеваний глаз; светочувствительность сетчатки менее 10 dB как минимум в двух точках, ближайших к центральной зоне, по данным статической периметрии; отягощенный аллергологический анамнез; отсутствие возможности и/или желания проведения внутримышечных инъекций.
Для уточнения характера и наличия изменений параметров системного кровотока всем пациентам до включения в исследование проводилось СМСАД с использованием портативного монитора АВРМ-05 (Венгрия). Исследование проводилось с интервалами 20 мин днем (во время бодрствования пациента) и 40 мин ночью (во время сна) с последующим расчетом средних значений систолического и диастолического АД за сутки, в периоды бодрствования и сна. При этом оценивались основные показатели суточного профиля АД: средние величины систолического, диастолического и среднего АД за сутки, за день и ночь; максимальные и минимальные значения АД за различные периоды суток; вариабельность систолического, диастолического и среднего АД (стандартное отклонение от среднего АД за сутки); суточный индекс (степень ночного снижения артериального давления, СНСАД), выделяя следующие группы: нормальная СНСАД (dippers) — 10–20%, недостаточная СНСАД (non-dippers) — <10%, избыточная СНСАД (over-dippers) — >20%, устойчивое повышение ночного АД (night-peakers) — <0%; скорость утреннего подъема АД.
Все пациенты были разделены на 2 группы по 15 человек, сопоставимые по возрасту, исходным параметрам морфофункциональных исследований и количеству глаз в каждой группе с развитой и далеко зашедшей стадиями глаукомы. Пациенты 1-й группы получали Ретиналамин® 5,0 мг курсом 10 ежедневных инъекций внутримышечно, пациенты 2-й группы — Ретиналамин® 5,0 мг курсом 20 ежедневных инъекций внутримышечно. Подобная длительная терапия [9] уже успешно зарекомендовала себя в проведенном ранее многоцентровом клиническом исследовании, перед нами же стояла цель проверить эффективность ее применения у пациентов с подтвержденным наличием системных факторов риска прогрессирования глаукомы, а также оценить целесообразность применения ее в сравнении со стандартным курсом (решение локального биомедицинского этического комитета ФГБНУ «НИИГБ» № 81 от 19.02.2022). В течение всего периода наблюдения было проведено 3 контрольных обследования пациентов: до начала лечения, через 3 и 6 мес. после окончания курса лечения.
Внутримышечный путь введения препарата был выбран нами не только как самый удобный для пациентов по сравнению с парабульбарными инъекциями, но и как наиболее эффективный и безопасный в отношении риска получения осложнений в результате проведения парабульбарных инъекций [10].
Остроту зрения оценивали стандартным методом с использованием проектора знаков и набора корректирующих стекол. Уровень ВГД измеряли с помощью бесконтактного пневмотонометра (Reichart 7, США) с определением показателя роговично-компенсированного давления. Методом порогового тестирования при выполнении компьютерной статической периметрии по программе исследования центрального поля зрения «24–2» определяли стандартное отклонение светочувствительности (MD) и паттерн стандартного отклонения (PSD) (Humphrey Field Analiser II, Carl Zeiss Meditec, Германия).
Морфологические параметры: среднюю толщину слоя нервных волокон сетчатки, параметры головки зрительного нерва, объем головки зрительного нерва, объем экскавации, среднюю толщину ганглиозных клеток сетчатки — отслеживали по результатам оптической когерентной томографии (ОКТ).
Статистический анализ выполнен в программах MS Excel 2010 и Statistica 8.0. Согласно критерию Шапиро — Уилка данные выборок соответствовали нормальному распределению. Для описания количественных данных исследуемых групп было использовано среднее и стандартное отклонение, для качественных и порядковых данных — процентное выражение и общее количество наблюдений. При сравнении двух независимых групп был использован t-критерий Стьюдента. Различия в выборках считали статистически значимыми при уровне значимости меньше 5% (p<0,05).
Результаты и обсуждение
В ходе первого этапа исследования по результатам СМСАД у всех пациентов были выявлены отклонения от нормы АД. При сохранении нормальных (систолического АД ≤140 мм рт. ст. и диастолического АД ≤90 мм рт. ст.) среднесуточных значений АД у большинства (21 (70%)) пациентов в 60% случаев было выявлено существенное превышение среднего дневного нормального уровня систолического АД, резкое повышение среднеквадратичного отклонения значений систолического АД от среднего уровня в дневные (50%, 15 человек) и ночные (76,7%, 23 человека) часы, у 25 (83,3%) пациентов величина утреннего подъема АД значительно превышала нормальные значения и составила в среднем 33%. Особое значение мы придаем нарушению циркадности АД: практически у всех больных (27 (90%)) было отмечено избыточное снижение диастолического АД в ночные часы (более 20% по отношению к дневному уровню), значения суточного индекса колебались от 19% до 33% (медиана была равна 24%) (см. рисунок).
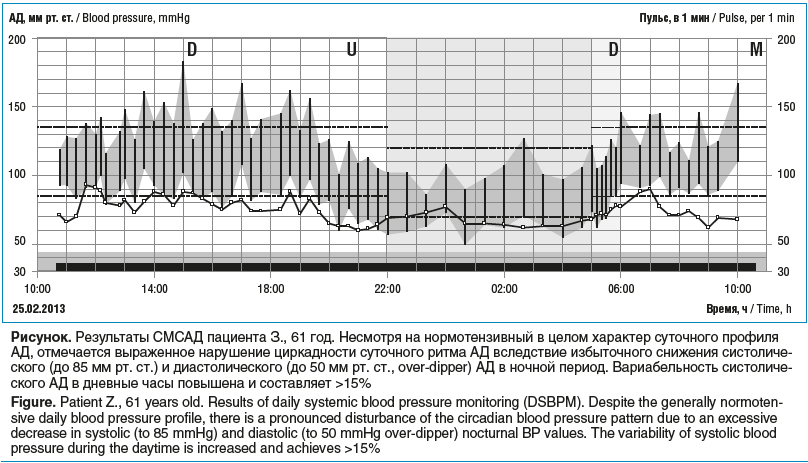
Приведенные данные подтверждали наличие у пациентов выраженных гемодинамических нарушений, сопровождающих нестабилизированное течение глаукомного процесса. Таким образом, длительный период обеднения центрального кровообращения в ночные часы может быть ключевым фактором, провоцирующим запуск ишемического каскада и последующей гибели нервных клеток сетчатки у пациентов с глаукомой.
Пациенты обеих групп к концу периода наблюдения отмечали улучшение качества зрения, что проявлялось, со слов, в положительной динамике контрастности и остроты зрения. При проверке остроты зрения на конечном этапе исследования (через 6 мес.) все пациенты демонстрировали положительную динамику: с 0,71±0,1 до 0,79±0,1 в 1-й группе (p>0,05) и с 0,78±0,1 до 0,90±0,1 во 2-й группе (p<0,05) (см. таблицу).
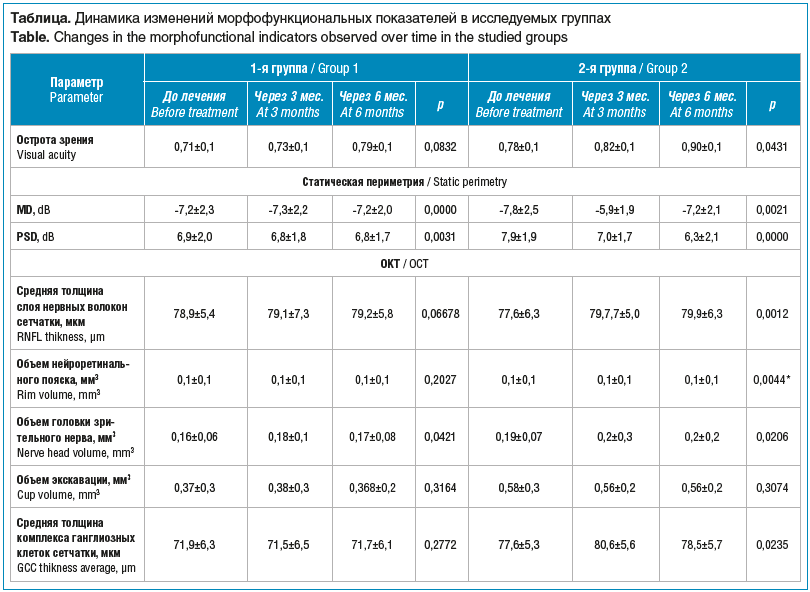
На 3-м месяце наблюдения у пациентов обеих групп была отмечена стабилизация периметрических индексов. Однако на конечном этапе исследования значения индексов MD и PSD в исследуемых группах существенно различались. При практически неизменных величинах индексов MD и PSD в 1-й группе у пациентов 2-й группы, прошедших более длительный курс лечения, отмечалась не только стабилизация, но и достоверное (p<0,05) увеличение среднего значения MD: с -7,8±2,5 до -7,2±2,1 dB; среднее значение PSD с момента начала исследования также показывало положительную динамику, отмечалось его достоверное снижение с 7,9±1,9 до 6,3±2,1 dB (см. таблицу). Существенная положительная динамика периметрических индексов в обеих группах (как стабилизация, так и значительное повышение светочувствительности) может свидетельствовать о прямом нейропротективном действии исследуемого препарата на ганглиозные клетки сетчатки и их аксоны, что иллюстрирует принцип «сохранна функция — сохранна анатомия».
В отношении стереопараметров сетчатки, ДЗН и ганглиозного комплекса по данным ОКТ у пациентов 1-й группы на 3-м и 6-м месяце наблюдения отмечалась стабилизация практически по всем критериям: отсутствовали изменения объема нейроретинального пояска (p>0,05) при стабильном объеме головки зрительного нерва (см. таблицу).
Во 2-й группе к 6-му месяцу наблюдения были выявлены достоверная слабоположительная динамика параметров, характеризующих среднюю толщину слоя нервных волокон сетчатки, объем нейроретинального пояска и головки зрительного нерва (p<0,05) (см. таблицу). Величина объема экскавации ДЗН при этом недостоверно уменьшилась с 0,58±0,3 до 0,56±0,3 мм3 (p>0,05). Также наблюдалась стабилизация и заметное увеличение толщины слоя комплекса ганглиозных клеток сетчатки: с 77,6±5,3 до 78,5±5,7 мкм (p<0,05).
В целом по результатам проведенного исследования Ретиналамин® зарекомендовал себя как эффективный нейропротективный препарат, способствующий сохранению морфологических структур сетчатки и, как следствие, зрительных функций у пациентов с нестабилизированным течением ПОУГ и нормализованным офтальмотонусом. Включение данного лекарственного средства в схему ведения пациентов с глаукомной оптической нейропатией, с осложненным течением в условиях серьезных нарушений системной гемодинамики позволяет добиться стабилизации течения заболевания и/или даже улучшения качества зрения пациентов. Уже при назначении короткого курса лечения препаратом можно добиться улучшения качества и остроты зрения, что подтверждается достоверным (p<0,05) повышением остроты зрения, положительной динамикой показателей MD и PSD. Cтабилизации достигнутого результата и морфофункциональных параметров к концу периода наблюдения (6 мес.) позволил добиться более продолжительный курс из 20 инъекций.
Вышеуказанные результаты функциональных исследований полностью коррелировали с морфологическими, что проявлялось в достоверной стабилизации состояния слоя нервных волокон сетчатки и ганглиозного комплекса, объема головки зрительного нерва. При этом более продолжительный курс терапии препаратом сопровождался не только достоверным увеличением вышеописанных параметров, но и уменьшением объема экскавации ДЗН.
На сегодняшний день Ретиналамин® является активно используемым препаратом нейропротективной терапии при глаукоме. Разными группами ученых на больших репрезентативных выборках больных были проведены клинические исследования, показавшие эффективность его применения в амбулаторной практике с клинически значимой достоверной возможностью улучшения зрительных функций и морфометрических параметров сетчатки и зрительного нерва [10–15]. При этом основную часть обследованных составляли больные с начальными стадиями заболевания, ответная положительная реакция со стороны которых проявлялась, по результатам проводимых исследований, ярко и довольно быстро. Перед нами изначально стояла цель проверить возможность и эффективность применения исследуемого препарата при более поздних стадиях глаукомы в условиях воздействия дополнительного неблагоприятного системного фактора — ишемического стресса. Нами установлено, что в условиях нестабилизированного течения глаукомной оптической нейропатии на фоне компенсированного офтальмотонуса препарат способен влиять на процессы жизнедеятельности и каскад апоптоза клеток сетчатки, позволяя добиться не только остановки прогрессивного ухудшения остроты и поля зрения, качества зрительных функций и морфометрических параметров сетчатки, но и улучшения этих показателей, что должно способствовать сохранению зрения на протяжении всей жизни пациентов.
Ограничения исследования: исследование было проведено с участием небольшого количества (30) пациентов с нестабилизированным течением глаукомной оптической нейропатии на фоне установленных нарушений системной гемодинамики. У всех пациентов уровень ВГД был нормализован при помощи местного гипотензивного режима путем лазерного или хирургического вмешательства. Все пациенты были комплаентны, способны ответственно выполнять наши рекомендации, имели возможность и желание пройти курс внутримышечных инъекций препарата. Также необходимо отметить непродолжительный срок наблюдения пациентов и отсутствие группы сравнения без применения ретинопротективной терапии в нашей работе.
Выводы
Применение препарата Ретиналамин® у пациентов с прогрессирующим течением ПОУГ на фоне изменений системной гемодинамики действительно оправдано и позволяет добиться стабилизации и улучшения зрительных функций.
По результатам проведенного исследования препарат Ретиналамин® может быть рекомендован для назначения пациентам с ПОУГ и компенсированным ВГД в качестве нейропротективной терапии, при этом предпочтительным является курс из 20 внутримышечных инъекций.
Сведения об авторе:
Макарова Анна Сергеевна — к.м.н., научный сотрудник отдела глаукомы ФГБНУ «НИИГБ им. М.М. Краснова»; 119021, г. Москва, ул. Россолимо, д. 11А, Б.
Контактная информация: Макарова Анна Сергеевна, e-mail: dr.amakarova@gmail.com.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.09.2022.
Поступила после рецензирования 04.10.2022.
Принята в печать 27.10.2022.
About the author:
Anna S. Makarova — C. Sc. (Med.), researcher of the Glaucoma Department, Krasnov Research Institute of Eye Diseases; 11A, B, Rossolimo str., Moscow, 119021, Russian Federation.
Contact information: Anna S. Makarova, e-mail: dr.amakarova@gmail.com.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 10.09.2022.
Revised 04.10.2022.
Accepted 27.10.2022.
материал rmj.ru
