Введение
Первичная открытоугольная глаукома (ПОУГ) — хроническое прогрессирующее заболевание, приводящее к потере зрительных функций. Развитые стадии болезни часто становятся причиной слепоты и приводят к инвалидности по зрению [1]. Необходимость пожизненной терапии, к сожалению, значительно снижает качество жизни глаукомных пациентов [2]. Усилия офтальмологов направлены на снижение уровня ВГД с целью предотвращения развития глаукомной оптической нейропатии. Однако фатальные изменения полей зрения и гибель ганглиозных клеток сетчатки (ГКС) продолжают происходить даже при хорошо контролируемом уровне ВГД. Разработка дополнительных стратегий лечения, направленных на сохранение функциональной активности сетчатки и зрительного нерва, является весьма актуальной.
Интерес к использованию препаратов, оказывающих нейропротекторное действие, огромен. Известно, что высокий уровень ВГД активизирует апоптоз и способствует гибели ГКС. Для снижения ВГД в развитой стадии используют препараты с разным механизмом гипотензивного действия. Их комбинации обладают максимально выраженным
аддитивным эффектом. Альфа-2-адреномиметики (например, бримонидин 0,2%) широко используются в лечении глаукомы как в фиксированных, так и в раздельных комбинациях [3, 4]. Нейропротекторный эффект бримонидина изучался в экспериментальных и клинических исследованиях. Было доказано, что препарат предотвращает потерю ГКС и истончение внутреннего слоя сетчатки. Авторы предполагают, что бримонидин стимулирует выработку фактора роста нервов, нейротрофического фактора головного мозга и основного фактора роста фибробластов [5]. Исследования показали, что по данным статической периметрии бримонидин снижает скорость прогрессирования глаукомного процесса, сохраняя пациентам поля зрения. Авторы подчеркивают, что нейропротекторное действие препарата проявляется независимо от его гипотензивной эффективности [6].
Цель данного исследования — оценить целесообразность применения бримонидина 0,2% в аддитивной терапии пациентов с развитой стадией глаукомы.
Материал и методы
В исследовании принимали участие 99 пациентов (121 глаз) с развитой стадией ПОУГ в возрасте от 62 до 73 лет. Больные были разделены на 4 группы в зависимости от получаемой гипотензивной терапии. В группу I вошли 26 человек (32 глаза), использовавшие для лечения комбинацию аналогов простагландинов (АПГ) и бета-блокаторов (ББ) — латанопрост и тимолол. Группу II составили 20 пациентов (26 глаз), получавшие комбинацию ингибиторов карбоангидразы (ИКА) с ББ — дорзоламид и тимолол. Группа III состояла из 24 пациентов (28 глаз), которым к имеющейся комбинации АПГ и ББ (латанопрост и тимолол) добавляли бримонидин 0,2% (по 1 капле 2 р/сут). Группа IV включала 29 пациентов (35 глаз), которые получали бримонидин 0,2% по аналогичной схеме в дополнение к комбинации ИКА с ББ (дорзоламид и тимолол).
Все пациенты проходили стандартное офтальмологическое обследование: визорефрактометрия, биомикроскопия, тонометрия с помощью тонометра iCare (Icare Finland Oy, Финляндия), статическая автоматическая периметрия с помощью периметра HFA II (Carl Zeiss, Германия) (программа «24–2» в 54 точках), офтальмоскопия и оптическая когерентная томография (ОКТ) на приборе 3D OCT-1 (Topcon, Япония). Исследования выполнялись в начале наблюдения, через 6 мес. и 12 мес. Выполнен сравнительный анализ таких параметров, как MD (mean deviation) — среднее отклонение дефекта в исследуемой группе от возрастной нормы, PSD (pattern standart deviation) — среднеквадратическое отклонение. Показатель MD отражает, главным образом, дефекты поля зрения, а PSD — локализацию дефектов в холме зрения. Данные показатели являются одними из основных параметров, с помощью которых возможно оценить нейропротекторный эффект [7].
Статистический анализ проводили с помощью пакета программного обеспечения Statistical Package for Social Science 17 (IBM SPSS Statistics, США). Количественные данные были представлены как среднее значение ± стандартное отклонение. Уровень значимости был принят при значении p<0,05.
Результаты исследования
Аддитивная терапия с использованием бримониди-на 0,2% способствовала постепенному снижению уровня ВГД у пациентов III и IV групп, тогда как в группах I и II офтальмотонус оставался стабильным. Так, через 6 мес. у пациентов группы III, получавших комбинацию АПГ, ББ и бримонидина, уровень ВГД уменьшился с 15,3±4,1 мм рт. ст. до 14,4±3,7 мм рт. ст. (на 5,9%), а к концу исследования снизился до 12,8±3,5 мм рт. ст. (что составило 16,3%). У пациентов группы I, получавших лечение АПГ и ББ, офтальмотонус изменился с 15,2±4,3 мм рт. ст. до 14,7±4 мм рт. ст. (на 3,3%) за первые 6 мес. наблюдения и сохранялся на том же уровне через 1 год — 14,7±3,9 мм рт. ст. (рис. 1).
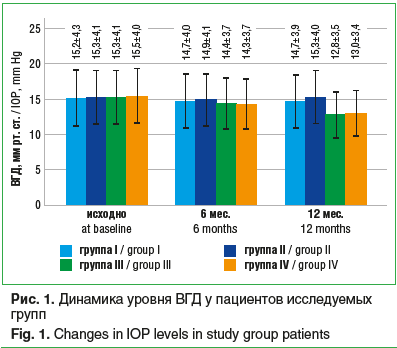
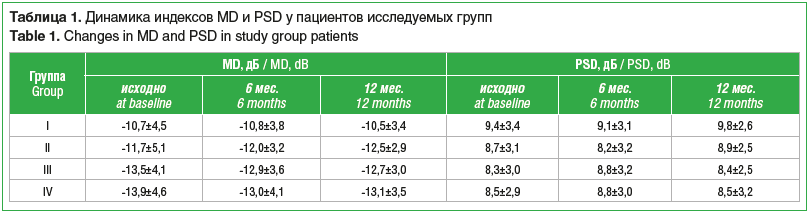
Статическая автоматическая периметрия показала положительную динамику значений MD у пациентов групп III и IV через 6 мес. и 12 мес. аддитивной терапии с использованием бримонидина. Так, в группе III индекс MD снизился с исходных -13,5±4,1 дБ до -12,9±3,6 дБ через 6 мес. после добавления бримонидина к гипотензивному лечению и снизился еще до -12,7±3 дБ через 1 год после начала исследования. У пациентов группы I, получавших лечение АПГ и ББ, индекс MD уменьшился с -10,7±4,5 дБ до -10,8±3,8 дБ через полгода, но через 1 год увеличился до -10,5±3,4 дБ. Индекс PSD оставался стабильным во всех исследуемых группах (табл. 1).
На протяжении всего исследования бримонидин хорошо переносился пациентами. Не отмечалось нежелательных явлений при взаимодействии бримонидина с другими гипотензивными препаратами и их комбинациями (латанопрост + тимолол, дорзоламид + тимолол).
Заключение
Применение бримонидина в аддитивной терапии развитой стадии глаукомы приводит к стойкому гипотензивному эффекту. Комбинированная терапия с использованием бримонидина способствует сохранению зрительных функций пациентов с ПОУГ даже в развитых стадиях заболевания. Нейропротекторная эффективность бримонидина в нашем исследовании подтверждается результатами статической автоматической периметрии — динамикой значений параметра MD для разных групп пациентов. Результаты исследования показывают, что бримонидин может быть использован в комплексном лечении пациентов с развитой стадией глаукомы с гипотензивной и нейропротекторной
целью.
Сведения об авторах:
1Газизова Ильмира Рифовна — д.м.н., заведующая отделением офтальмологии, ученый секретарь, ORCID iD 0000-0003-4611-9931;
2,3Корелина Виктория Евгеньевна — к.м.н., заведующая офтальмологическим отделением; преподаватель кафедры семейной медицины, ORCID iD 0000-0003-2022-5912.
1ИМЧ РАН. 197376, Россия, г. Санкт-Петербург, ул. Академика Павлова, д. 9.
2ООО «АМК». 190000,Россия, г. Санкт-Петербург, набережная реки Мойки, д. 78, литера А.
3ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России. 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41.
Контактная информация: Газизова Ильмира Рифовна, e-mail: ilmiraufa88@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 06.04.2021.
About the authors:
1Il’mira R. Gazizova — Doct. of Sci. (Med.), Head of the Department of Ophthalmology, academic secretary, ORCID iD 0000-0003-4611-9931;
2,3Viktoriya E. Korelina — Cand. of Sci. (Med.), Head of Ophthalmological Department, lecturer of the Department of Family Medicine, ORCID iD 0000-0003-2022-5912.
1N.P. Bekhtereva Institute of the Human Brain. 9, Academician Pavlov str., St. Petersburg, 197376, Russian Federation.
2LLC “American Medical Clinic”. 78 letter A, river Moika embankment, St. Petersburg, 190000, Russian Federation.
3I.I. Mechnikov North-Western State Medical University. 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation.
Contact information: Il’mira R. Gazizova, e-mail: ilmiraufa88@gmail.com. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 06.04.2021.
.
материал rmj.ru
