Содержание статьи
Введение
Эндоскопическая хирургия полости носа и околоносовых пазух получила широкое распространение по всему миру с начала XX в. и сегодня продолжает свою эволюцию на основе углубленного понимания анатомо-физиологических особенностей этой области, а также с использованием постоянно совершенствуемого хирургического оборудования. Оперативные вмешательства в полости носа и околоносовых пазухах имеют ряд особенностей: богатая васкуляризация, легкоранимая тонкая слизистая оболочка, узкие анатомические пространства, высокий риск кровотечения и рубцовых послеоперационных осложнений. Потребность в менее травматичных методах лечения заболеваний носа требует особого подхода к выбору оптимального хирургического инструмента. С учетом особенностей анатопcии полости носа выбор оптимального инструмента для ринохирургических вмешательств является непростой задачей. Идеальный инструмент для ринологии должен эффективно удалять как костную ткань, так и мягкие ткани, а также обеспечивать надежный гемостаз. В настоящее время не существует универсального хирургического инструмента, способного решить все эти задачи. Тем не менее широкое внедрение в практическую медицину лазерных и электрохирургических инструментов позволяет выполнять хирургические вмешательства в полости носа быстро и бескровно. Кроме того, высокая эффективность и минимальная травматизация тканей, способность обеспечить надежный гемостаз, хорошая визуализация при проведении хирургического вмешательства, оптимальные сроки регенерации тканей значительно расширяют возможности хирургических вмешательств в полости носа. Клиницисту необходимо знать основные технические особенности и понимать биологические эффекты «горячих» инструментов при работе на структурах полости носа. Эта информация позволит врачу решить, какие методы лечения лучше всего предложить пациенту, и подобрать оптимальный инструмент для конкре тной задачи.
Основой высокочастотной электрохирургии, или радиохирургии, является создаваемое генераторами электромагнитное поле в диапазоне радиоволн от 100 кГц до 105 МГц и выше. Характер влияния электрического тока на биологические ткани зависит от частоты колебаний, сопротивления тканей, характеристик электрического тока инaформы активного электрода. При достаточной мощности электрической энергии происходит стремительное разогревание ткани и испарение вне- и внутриклеточной жидкости с разрушением клеток и межклеточных связей, в результате чего достигается разрез [1].
При низких значениях высокочастотного напряжения происходит медленное разогревание биологической ткани без разрушения клеточных мембран, с эффектом коагуляции. Резкое повышение мощности в режиме коагуляции реализует режущий эффект с образованием струпа на интактной ткани. В ЛОР-хирургии наиболее часто применяются электроды в виде игл, петли, шара или округлого наконечника, пинцета с двумя контактными электр одами, монополярный электрод с каналом для аспирации. С целью выполнения разреза ткани рационально использование электрода с наименьшей площадью для достижения высокой плотности тока на ограниченном участке. Оптимальной считается скорость нанесения воздействия, составляющая Ц 2 режиме резания 5–10 мм/с. Замедление движения электрода может привести к выраженному термическому повреждению тканей с последующим формированием грубого рубца [2–4].
Поглощение лазерного излучения во многом зависит от длины его волны, в связи с чем в зависимости от определенной области спектра медицинские лазеры можно условно разделить на лазеры гемоглобинпоглощаемого спектра излучения — к ним относятся лазеры видимого спе ктра излучения (0,53 мкм, аргоновый, рубиновый, PDL), а также лазеры ближнего инфракрасного (ИК) спектра излучения (0,81–1,3 мкм), для которых преобладающим является поглощение в гемоглобине крови, и лазеры водопоглощаемого спектра (с длиной волны 1,32 мкм и выше), для которых максимальный пик абсорбции приходится на молекулы воды [5–8]. Не только длина волны и мощность лазерного излучения, но и качество обработки торца световода, наличие или отсутствие пигментного покрытия на нем оказывают значительное влияние на результат лазерного воздействия на биологическую ткань [9, 10]. При воздействии лазера видимого и ближнего ИК-спектра излучения с зачерненным то
‘f0цом оптоволокна ткань испытывает сочетанное воздействие как лазерного излучения, так и термического эффекта от разогретого кончика оптоволокна: поглощение лазерного излучения тканью и воздействие раскаленным торцом волокна вызывает обугливание ткани и формирование зоны абляции в виде кратера с осажденными продуктами горения вокруг него. Воздействие водопоглощаемого лазерного излучения на слизистую оболоч eaу полости носа при определенных условиях на малой мощности тщательно сколотым незачерненным торцом оптоволокна позволяет получить не резку тканей, а их коагуляцию за счет относительно низкой температуры в эпицентре лазерного воздействия, без образования угля.
На кафедре оториноларингологии с клиникой совместно с Центром лазерной медицины ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России в течение многих лет апробируются и внедряются в клиническую практику различные лазерные аппараты, ведется активная экспериментальная р e0бота по изучению биологических свойств электрохирургического и лазерного оборудования, подбору оптимальных параметров воздействия и разработке методик воздействия «горячих» инструментов при различных заболеваниях уха, горла, носа и гортани [11–26]. Ниже представлен опыт кафедры оториноларингологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова по применению лазерной и электрохирургической медицинской техники в ринохирургии.
Собственный опыт
Хронический ринит
Одним из ведущих симптомов ринита является затруднение носового дыхания вследствие увеличения объема слизистой оболочки нижних носовых раковин за счет ее гипертрофии или стойкой гиперемии кавернозных сосудов. Главной целью хирургического лечения хронического ринита являются уменьшение объема нижней носовой раковины и снижение сопротивления воздушной струи на вдохе. Подслизистая нижняя вазотомия, предложенная С.З. Пискуновым, является действенным способом восстановления носового дыхания [27]. Разрушение сосудов подслизистого слоя обеспечивает стойкое уменьшение объема нижней носовой раковины, однако данная методика имеет ряд недостатков: в fbполнение в условиях общей анестезии, высокие риски кровотечения и необходимость в тампонаде носа ограничивают выполнение подслизистой вазотомии у пациентов пожилого возраста, у лиц, имеющих противопоказания к общей анестезии. Альтернативой классической подслизистой вазотомии можно назвать интерстициальн f3ю коагуляцию нижних носовых раковин с помощью лазера или электрокаутера. Преимуществами данных методик являются возможность выполнения в условиях местной анестезии, в том числе амбулаторно, хорошие гемостатические свойства и отсутствие необходимости в тампонаде полости носа. При этом обеспечивается хороший функциональный результат. Лазерное и электрохирургическое интерстициальное воздействие на нижние носовые раковины мы выполняем следующим образом. Используется лазер с длиной волны 1,56 мкм или 1,94 мкм на низкой мощности излучения 1,5–2 Вт в непрерывном режиме. После местной анестезии проводится вкол очищенного сколотого торца оптоволокна через толщу раковины вдоль ее кости до дистального конца, затем волокно медленно возвращается по сформированному туннелю. Ориентиром продвижения волокна в толще подслизистого слоя служит маркер-пилот, вызывающий свечение на поверхности раковины. Для электрокаутера мы используем наконечник «вилка» с двумя параллельными игольчатыми электродами длиной 5 мм. На мощности 5 усл. ед. (мощность электрического тока, равная 50 Вт) в режиме «коагуляция» проводится дезинтеграция гипертрофированных участков нижней носовой раковины. Преимуществами данной методики являются практически полное отсутствие интра- и послеоперационного кров eeтечения, высокий профиль безопасности (у всех наших пациентов отсутствуют рубцовые и костно-деструктивные послеоперационные осложнения), хорошая переносимость процедуры в условиях местной анестезии. Часто мы сочетаем интерстициальную лазерную или электрохирургическую ко агуляцию нижних носовых раковин с эндоскопическими операциями на околоносовых пазухах — это позволяет нам не применять дополнительную тампонаду полости носа, сократить период послеоперационного восстановления пациентов.
При поверхностном контактном применении лазеров гемоглобинпоглощаемого спектра (0,81–0,98 мкм) излучение проникает на небольшую глубину и не ок азывает значительного термического влияния на окружающие ткани до тех пор, пока не будет абсорбировано молекулами гемоглобина. В зоне разреза формируется кратер абляции, на месте которого в послеоперационном периоде образуется рубцовая ткань, впоследствии фиксирующая слизистую оболочку к костной основе раковины (рис. 1A). Мы выполняем 3 линейных разреза вдоль медиального края нижней носовой раковины по всей ее длине от дистального конца к проксимальному.
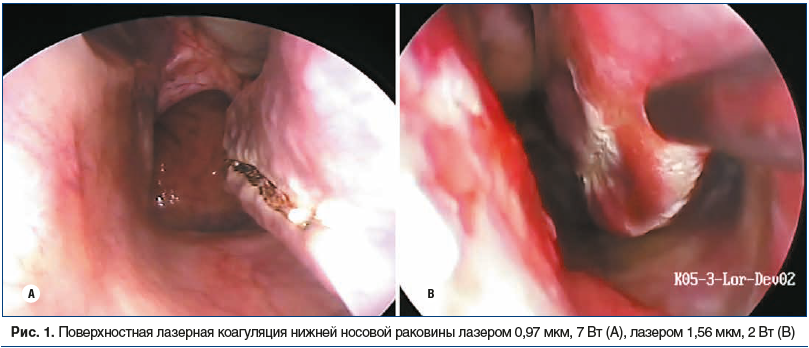
Иные эффекты наблюдаются при воздействии на нижние носовые раковины водопоглощаемым лазерным излучением волоконного лазера 1,56 мкм. При воздействии лазером 1,56 мкм на низкой мощности (1,5–2 Вт) в контактном непрерывном режиме сколотым незачерненным торцом оптоволокна формируется глубокая зона коагуляции без обугливания ткани и формирования кратера абляции (рис. 1B). Кровотечения ни в одном случае не было. Реактивные воспалительные явления в послеоперационном периоде были минимальными. К концу 1-го месяца после операции по данным передней активной риноманометрии носовое дыхание в большинстве случаев было удовлетворительным [28].
Синехии полости носа
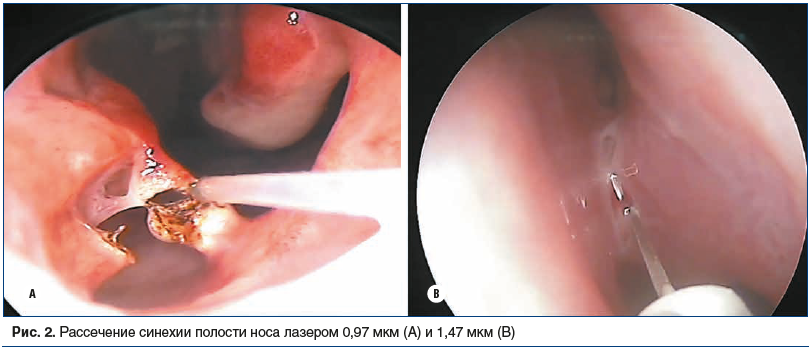
Частота рецидивов синехий после рассечения холодными инструментами достигает 80%, после рассечения лазером составляет около 7% [13, 29]. Преимущества лазерного рассечения синехий заключаются в обеспечении надежного гемостаза и исключении необходимости тампонады полости носа, что улучшает качество жизни пациентов в послеоперационном периоде и позволяет осуществлять оперативное вмешательство в амбулаторных условиях. Мы выполняем рассечение синехий полупроводниковым лазером с длиной волны 0,98 мкм и 1,47 мкм в контактном непрерывном режиме (рис. 2). Во всех случаях оперативное вмешательство выполняется в условиях местной аппликационной анестезии. При наличии протяженных синехий добавляется инфильтрационная анестезия. Подбор параметров лазерного излучения мы осуществляем на основании результатов выполненных ранее экспериментальных исследований биологических эффектов лазерного излучения. Непротяженные синехии полости носа рассекаем с помощью полупроводниковых лазеров с длиной волны 0,98 мкм при мощности 5–7 Вт в контактном непрерывном режиме. Отсутствие интраоперационного кровотечения исключает необходимость тампонады носа. Подобная методика позволяет обеспечить достаточный диастаз между раневыми поверхностями и отсутствие рестенозирования без применения дополнительных мер. В большинстве случаев полная эпителизация слизистой оболочки происходит в течение 2 нед. Воздействие водопоглощаемым лазером с длиной волны 1,47 мкм в непрерывном режиме на небольшой мощности (2–4 Вт) характеризуется ограниченным распространением лазерного излучения в ткани, давая при этом хороший коагуляционный эффект по сравнению с гемоглобинпоглощающим лазером и уменьшает вероятность нежелательного термического повреждения окружающих тканей даже для пр eeтяженных рубцовых сращений. Одномоментная коагуляция нижних носовых раковин и рассечение синехий между перегородкой носа и нижней носовой раковиной позволяют еще больше снизить риск рецидива синехии [13].
Рецидивирующие носовые кровотечения
Воздействие электрокаутером на источник кровотечения является одним из наиболее распространенных хирургических способов остановки носовых кровотечений [30]. С этой целью мы используем биполярные и монополярные электроды. Для остановки носовых кровотечений оптимально применять монополярный электрокаутер с каналом для аспирации. Коагуляция сосудов перегородки носа выполняется под аппликационной анестезией с инфильтрацией 0,5–1 мл лидокаина в переходную складку. При работе с биполярным каутером-пинцетом разведенные бранши каутера устанавливаются вдоль стенок сосуда. Оптимальная мощность воздействия — 5–6 усл. ед., режим «Би-коаг».
Монополярная коагуляция выполняется с помощью шаровидного наконечника в режиме «Моно-коаг», мощность — 4–5 усл. ед. Не рекомендуется выполнять коагуляцию большого количества крупных сосудов, а также одномоментную коагуляцию сосудов с двух сторон перегородки носа из-за термического повреждения тканей и риска развития перфорации перегородки носа [31].
В литературе представлены данные о применении лазеров гемоглобинпоглощаемого спектра излучения (КТР, аргоновый, диодные лазеры) для коагуляции эктазированных сосудов перегородки носа [32, 33]. Тем не менее из-за своих спектральных характеристик применение данных лазеров именно с целью коагуляции малоэффективно, так как их гемостатические свойства в околоконтактном режиме н езначительны, а воздействие в контактном режиме оправдано для сосудов небольшого диаметра (до 1 мм) из-за риска разрыва сосудистой стенки и внутрислизистого кровоизлияния [12, 34, 35]. С этой целью оптимально использовать лазерное излучение с преимущественным поглощением водой. Гемостатические свойства лазера обусловлены вскипанием крови в просвете сосуда, при этом стенки капилляра не разрушаются, а повреждается только сосудистый эндотелий, продуцирующий оксид азота — главный вазодилатирующий фактор. С этой целью мы предпочитаем лазер с e4линой волны 1,56 мкм на мощности 1 Вт в околоконтактном непрерывном режиме. Интраоперационно при дистантном воздействии по ходу движения торца оптоволокна над сосудом наблюдается спадение сосудистой стенки за счет вапоризации жидкой части крови и широкая зона побеления слизистой оболочки над сосудом. Отсутствие кровоизлияний при воздействии на сосуд свидетельствует о сохранении целостности его стенки, что позволяет провести процедуру быстро и бескровно, без необходимости дополнительных лазерных воздействий или механических способов остановки кровотечения.
Сосудистые новообразования полости носа
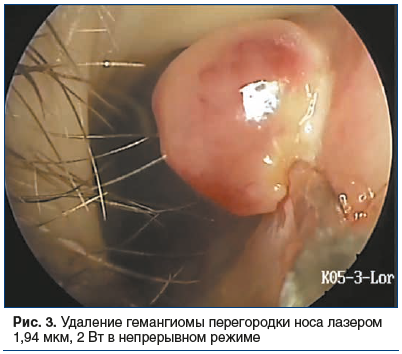
Инструментом выбора при работе с интенсивно кровоснабжаемыми образованиями является электрохирургическая и лазерная аппаратура [36]. Основным способом лечения гемангиом носа является хирургический: интраназальное удаление холодными инструментами или электрокаутером, радиоволновым скальпелем [37–40]. Для удаления небольших гемангиом перегородки носа на ножке оптимально использовать биполярный электрокаутер. Его выбор обусловлен более выраженными гемостатическими свойствами, чем у лазера. Манипуляция выполняется в условиях местной аппликационной и инфильтрационноЦ 9 анестезии под эндоскопическим контролем. Бранши биполярного электрокаутера устанавливаются в месте прикрепления гемангиомы к перегородке носа, воздействие осуществляется на мощности 4–5 усл. ед. Место прикрепления гемангиомы дополнительно коагулируется для более надежного гемостаза. Манипуляция бескровная, не требует тампонады. Более крупные гемангиомы перегородки носа или носовых раковин с широким основанием удобнее удалять с помощью лазера. Это обусловлено в первую очередь избыточным термическим повреждением окружающих тканей — необходимо выполнять более длительное воздействие каутером или несколько воздействий подряд для отсечения гемангиомы у основания, что приведет к формированию ожогового струпа, рубцовым осложнениям или перфорации перегородки носа. Несмотря на имеющийся опыт применения электрохирургических инструментов при удалении гемангиом в полости носа, в доступной литературе представлены единичные данные об удалении гемангиом полости носа с помощью лазера [41–45]. Наилучшим вариантом для удаления подобных гемангиом являются лазеры с хорошими коагуляционными свойствами — 1,47, 1,56 и 1,94 мкм (рис. 3). Воздействие на низкой мощности (1,5–2 Вт) в непрерывном режиме с незачерненным торцом оптоволокна позволяет избежать ожога окружающих гемангиому тканей, при этом обеспечивая необходимый гемостаз.
Заключение
Внедрение лазерной и электрохирургической техники в оториноларингологическую практику позволило повысить эффективность и безопасность операций на структурах полости носа за счет снижения интра- и послеоперационной кровопотери, рисков рубцовых осложнений, длитель edой тампонады, хорошего заживления в послеоперационном периоде, что позволяет сделать их инструментами выбора для целого ряда ринохирургических вмешательств. Тем не менее неправильный подбор режимов воздействия может привести к избыточному термическому повреждению окружающих тканей и выраженным реактивным воспалительным изменениям. Применение «горячих» инструментов в ринохирургии требует четкого соблюдения рекомендаций по выбору параметров воздействия в каждом конкретном случае для снижения риска интра- и послеоперационных осложнений, повышения качества жизни пациента в послеоперационном периоде, что особенно актуально для процедур, выполняемых в амбулаторных условиях.
.
материал rmj.ru
