Введение
Врожденная атрезия хоан (АХ) — аномалия развития, при которой задние отделы полости носа полностью или частично блокированы костной или костно-мембранозной пластиной и при которой отсутствует сообщение между носом и носоглоткой. На сегодняшний день разработано большое количество вариантов хирургического лечения, реабилитации и тактики ведения детей первых дней жизни с полной двусторонней врожденной АХ. Однако, несмотря на значительный технологический прогресс за последние 10 лет, АХ все еще остается одной из актуальных проблем в педиатрической практике.
Содержание статьи
Атрезия хоан: классификация, эпидемиология, патогенез и клиническая картина
Встречаемость АХ не превышает одного случая на 5–8 тыс. родившихся. Самая распространенная форма АХ — костная, которая встречается в 85–90% наблюдений. Мембранозный или смешанный типы АХ (с образованием пластинки костно-мембранозного вида) наблюдаются намного реже, составляя до 10% наблюдений. Новорожденные девочки страдают патологией в 2 раза чаще, чем мальчики. Также в 2 раза чаще наблюдается развитие патологического процесса с обеих сторон носовой полости, нежели одностороннее [1].
Перекрытию хоан с двух сторон зачастую сопутствуют иные патологии: CHARGE-синдром (колобома (Coloboma), сердечные дефекты (Heart defects), АХ (Atresia choanae), задержка роста и развития (growth Retardation), аномалии гениталий (Genital abnormalities), аномалии уха (Ear abnormalities)), синдром Аперта, синдром Крузона, синдром Дауна, а также другие варианты краниофациальных аномалий [2].
Клинические проявления АХ могут варьировать от критической обструкции верхних дыхательных путей, сопровождающейся угрозой жизни ввиду асфиксии, до хронического гнойного ринита, связанного с нарушением клиренса слизи и застойными воспалительными изменениями в полости носа и околоносовых пазухах, что обусловлено отсутствием аэрации.
Одним из самых важных аспектов физиологического развития ребенка в первые дни жизни является респираторная функция, особенно важно учитывать тот факт, что при рождении у большинства детей отсутствует возможность ротового дыхания, что обусловлено рядом анатомических и функциональных особенностей. Так, надгортанник новорожденного расположен выше, чем у взрослого. Когда младенец глотает, гортань поднимается выше надгортанника и касается носоглотки, тем самым гортань замыкается между мягким небом и стенкой носоглотки. Во время вдоха у новорожденного создается вакуум, при котором мягкие ткани дна полости рта перемещаются вверх и назад к мягкому небу. Во время выдоха давление в дыхательных путях заставляет мягкое небо выдвигаться вперед к мягким тканям и языку, также обтурируя дыхательные пути. Таким образом, дыхательный просвет ротоглотки новорожденного неизменно блокируется при носовом дыхании. Дыхание младенца через рот возможно только во время плача. Уменьшение просвета дыхательного пути через нос на одну треть увеличивает сопротивление носовых дыхательных путей в 8 раз, что приводит к серьезным респираторным расстройствам у новорожденных [3].
При двусторонней АХ новорожденный нуждается в реанимационных мероприятиях (искусственная вентиляция легких, трахеостомия, экстренная хоанотомия), при отсрочке которых здоровые доношенные дети могут получить серьезные гипоксические повреждения центральной нервной системы, возможен и летальный исход. В ряде случаев, как показывает практика, встречаются исключения, когда ребенок с рождения может дышать ртом, но при этом питание невозможно. Для исключения апноэ родители часто различными способами фиксируют нижнюю челюсть пластырем, устанавливают воздуховоды (рис. 1), различные приспособления для предотвращения западения языка. Данные меры позволяют избежать асфиксии, но значительно нарушают качество жизни ребенка и имеют высокие риски осложнений, поэтому могут использоваться лишь как временная мера.
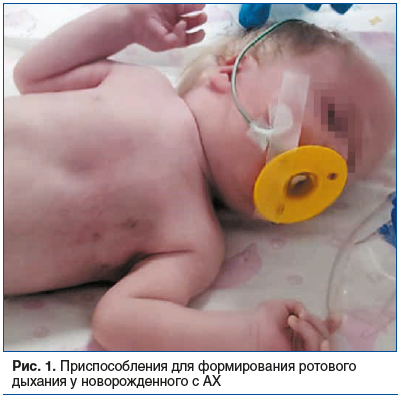
При односторонней АХ также отмечается выраженное затруднение носового дыхания, однако при определенных анатомических вариантах носовое дыхание может сохраняться какое-то время. Когда новорожденный засыпает, ротовое отверстие смыкается. В результате наблюдается стридор — затрудненное учащенное дыхание, сопровождающееся цианозом кожных покровов. Новорожденный незамедлительно просыпается, появляется плач, дыхание становится более свободным, цианотичная окраска кожи исчезает. Такой циклический процесс может продолжаться несколько часов. АХ также препятствует нормальному грудному вскармливанию ввиду невозможности одновременного дыхания, сосания и глотания. Появляются симптомы: отрыжка, склонность к поперхиванию. Среди других важных признаков АХ можно отметить такие симптомы, как: отставание в физическом развитии; цианоз лицевой зоны, кончиков пальцев, носа, ушей; общая бледность кожи; периодические выделения из носовой полости слизистого или гнойного характера; периоды высокого возбуждения, сменяемые периодами вялости; отставание в психическом развитии; анемия. Если к АХ присоединяется инфекционная составляющая, возможно развитие тех или иных форм ринита, воспаления в различных отделах уха. Если атрезия хоан носит односторонний характер, то симптоматика недостаточности дыхательной функции не так заметна. Она проявляется лишь при нагрузках и во время сна. Односторонняя АХ часто дает о себе знать воспалительными заболеваниями носоглотки, бронхитами, синуситами. В большинстве случаев попытки лечения таких осложнений не приносят результата [4].
Лечение АХ
Основной способ лечения АХ хирургический, его целью является восстановление сообщения левой, правой или одновременно обеих половин носовой полости с носоглоткой. На сегодняшний день не разработано хирургического способа лечения АХ, гарантирующего отсутствие рецидива [5]. Основное внимание в нашей работе будет уделено эндоназальному доступу, так как данный метод является наименее травматичным, сопровождается минимальной кровопотерей и, на наш взгляд, полностью заменяет травматичные доступы (транспалатинный, трансмаксиллярный) [6].
Хирургическое лечение АХ известно более 200 лет, первое современное описание хоанопластики с применением стентов относится к 1930 г. Далее рядом авторов были предложены различные модификации данной методики, а эндоскопический подход впервые был предложен в 1990 г. Позже были предложены различные варианты стентов, установку которых предполагают все описанные методики [6]. Краткая суть метода: удаляются патологические структуры мембранозного или костного типов; для исключения повторного стеноза в операционную рану помещается стент. Последний представляет собой особую трубку, не позволяющую поверхностям операционной раны контактировать, тем самым исключается появление рубцов. Но продолжительное нахождение стента в носовой полости (часто свыше 5–6 мес.) вызывает дискомфорт у ребенка, травмирует подлежащую слизистую полости носа, вызывая воспаление, повышенное формирование грануляционной ткани, пролежней. Такая ситуация повышает риск рестенозирования (рис. 2) после извлечения стента [7]. Нередко после удаления трубки-стента хоана вновь срастается и требуется повторное хирургическое вмешательство.
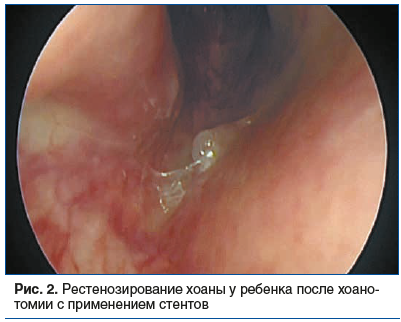
Длительное время в оториноларингологическом сообществе ведется дискуссия по поводу отказа от стентирования с целью улучшения качества жизни ребенка и минимизации рисков рестенозирования, ранее нами был предложен и успешно апробирован метод хоанопластики с фиксацией лоскутов слизистой баллоном ЯМИК без применения стентов (рис. 3) [8].
![Рис. 3. Фиксация верхнего и нижнего септальных лоскутов баллоном в сформированной апертуре хоаны [8] Рис. 3. Фиксация верхнего и нижнего септальных лоскутов баллоном в сформированной апертуре хоаны [8]](https://medblog.su/wp-content/uploads/2024/04/1712348681_333_Atreziya-hoan-u-detej-pervogo-goda-zhizni-tendentsii-poslednih-pyati.png)
С целью восстановления нормальной анатомии хоан удаляется дистальный конец сошника, тем самым подготавливаются слизистые лоскуты с задней части носовой перегородки. Эти лоскуты слизистой оболочки помещаются на нижнюю и верхнюю поверхности носовой полости (нижний и верхний лоскуты соответственно). В получившуюся неохоану помещается баллон-катетер ЯМИК, может также использоваться катетер Фолея. Баллон раздувают с помощью физиологического раствора, наружная часть баллона фиксируется пластырем к щеке. В носовые ходы также устанавливаются свободно расширяющиеся кровоостанавливающие тампоны (патент на изобретение № 2674876) [9]. Баллон-катетер ЯМИК находится в неохоане в течение 4–5 сут, затем он подлежит удалению. Данная методика позволяет полностью обеспечить реабилитацию ребенка без применения стентов, благодаря чему ребенок может самостоятельно дышать носом сразу после удаления баллона.
Единственным недостатком данной методики является то, что на время ношения баллона и тампонов пациент не может дышать носом, так как полость носа полностью блокирована. Восстановление собственного дыхания пациента, особенно в первые дни после рождения, является важным аспектом здоровья ребенка.
Нами был предложен и апробирован бесстентовый метод хоанопластики, при котором лоскуты фиксировались с помощью фибринового клея. Особенностью данного метода является клеевая фиксация слизистых лоскутов, при этом нет необходимости в установке стента или тампонов в полость носа. Сразу же после операции ребенок может дышать носом, что особенно важно для детей первого года жизни.
Описанный способ хирургического лечения для пациентов с врожденной АХ разработан для того, чтобы исключить необходимость ношения стента/трубки и каких-либо тампонов в полости носа после операции, он позволяет выполнять хирургические вмешательства в неонатальном периоде, и ребенок может дышать носом уже в первые часы после операции.
Собственный опыт ведения детей с АХ
За период с 2018 по 2023 г. коллективом авторов в ЛОР-отделении Института Вельтищева было проконсультировано свыше 60 детей с АХ (из них 17 детей с подтвержденным CHARGE-синдромом), осуществлено 55 хирургических вмешательств. Исследовательская работа [11] велась в отношении 31 ребенка в возрасте до 1 года (средний возраст 7,5 мес.): 19 (61,3%) девочек и 12 (38,7%) мальчиков, оперированных в период с 2019 по 2023 г. (законные представители всех детей подписали добровольное информированное согласие на публикацию фотографий в обезличенном виде). Односторонняя АХ была зарегистрирована у 16 (51,6%) пациентов (из них правосторонняя — у 13, левосторонняя — у 3 детей), двусторонняя АХ — у 15 (48,4%) детей.
Из 31 ребенка 9 (29,1%) детям, поступившим первично или с рецидивом после первичной операции, была проведена эндоскопическая бесстентовая хоанопластика с фиксацией лоскутов слизистой баллоном, 22 (70,9%) детям выполнена эндоскопическая бесстентовая хоанопластика с использованием метода фиксации лоскутов в хоане фибриновым клеем. До хирургического лечения АХ каждый пациент подвергся стандартному ЛОР-обследованию, включавшему эндоскопию полости носа, КТ носовой полости и синусов. В ряде случаев проводились консультации невролога, неонатолога, окулиста, генетика.
В 2023 г. авторы опубликовали клинические результаты катамнестического послеоперационного наблюдения большей части детей, включенных в исследование [10]. По данным клинического осмотра, у большинства детей восстановилась функция носового дыхания, отсутствовали симптомы назальной обструкции.
Однако для объективизации результатов проведенного лечения и сравнения оперативных методик необходимо проведение исследований, исключающих субъективные факторы. В связи с тем, что большинство детей, включенных в исследование, по возрасту не могут быть обследованы методами риноманометрии, оптимальным исследованием для оценки размеров сформированной хоаны стала КТ.
Компьютерная томография полости носа, околоносовых пазух и носоглотки проведена в лечебно-профилактических учреждениях по месту жительства пациентов, но данные были различны по качеству выполнения. Некоторые родители отказывались от проведения ребенку КТ под общей анестезией. Таким образом, были проанализированы данные КТ 44 (86,3%) пациентов. В группе первичной АХ проанализированы данные КТ 24 (88,8%) пациентов, в группе рецидива АХ — 20 (83,3%) пациентов.
Первым этапом анализа КТ мы определяли маркировку правой и левой стороны и сопоставляли с результатами риноскопии эндоскопического осмотра. Далее проводилась оценка в коронарной, аксиальной и сагиттальной проекциях КТ с двух сторон. Прежде всего нас интересовали размер воздушного пространства хоаны с каждой стороны и сопоставление данных КТ с данными эндоскопического осмотра. Размер (ширина) сошника при бесстентовом методе операции не имел принципиального значения, так как техника операции основана на формировании новой единой неохоаны. Размеры хоан по данным КТ представлены в таблице. Диаметр хоаны более 0,6 см считали нормальным (100%), диаметр 0,3–0,6 см — более 50% от нормального, диаметр менее 0,3 см — менее 50% от нормального, выделяли также тотальное закрытие хоаны.
Нормальные размеры хоаны слева (более 0,6 см) чаще встречались в группе первичной АХ, в группе рецидива — лишь в 2 (10,0%) случаях. Тотальное закрытие хоаны слева также чаще встречалось в группе первичной АХ. Размеры хоан более 50% от нормы или менее 50% от нормы слева чаще встречались в группе пациентов с рецидивом.
Нормальные размеры (более 0,6 см) хоаны справа чаще встречались в группе первичной АХ, как и тотальное закрытие хоаны справа. Размеры хоан более 50% от нормы или менее 50% от нормы справа также чаще встречались в группе с рецидивом.
Эндоскопия носовой полости проводилась на 4, 10 и 30-е сутки после оперативного вмешательства каждому ребенку. В дальнейшем прооперированные пациенты подвергались (или будут подвергнуты) осмотрам спустя полгода, год и через 2 года. В течение первых трех дней после операции у пациентов, которым проводили хоанопластику с фиксацией лоскутов слизистой баллоном, носовые ходы были полностью блокированы, проводилось раздувание и сдувание баллонов, последовательно удалялись тампоны. Дети оставались на энтеральном питании до восстановления носового дыхания. В то же время у детей, которым проводилась бесстентовая хоанопластика с фиксацией лоскутов в хоане фибриновым клеем, носовое дыхание восстанавливалось уже в палате интенсивной терапии после операции. Восемь (36,4%) детей на грудном вскармливании прикладывали к груди в первые часы после операции, 12 (54,5%) детей переведены с зондового питания на естественное в первые дни, 2 (9%) ребенка выписаны из стационара на зондовом питании с трахеостомой в связи с тяжелым соматическим статусом.
Баллоны после хоанопластики были удалены на 4–5-е сутки. У пациентов, которым проводили хоанопластику методом фиксации лоскутов в хоане фибриновым клеем, в первые сутки наблюдалось затрудненное носовое дыхание, но достаточное для естественного питания, слизисто-сукровичное отделяемое из носовых ходов, затем на 3–4-е сутки носовое дыхание восстанавливалось в полном объеме по мере регресса реактивных явлений со стороны слизистой оболочки носа.
После хоанопластики с фиксацией лоскутов слизистой баллоном пациентов выписывали на 10-е сутки после операции, тогда как после хоанопластики методом фиксации лоскутов в хоане фибриновым клеем пациентов выписывали на 4-е сутки. При эндоскопическом исследовании через 1 мес. у всех детей отмечали полноценное восстановление эпителия операционной раны. Созданные в процессе операции слизистые лоскуты полностью закрывали костные стенки носовой полости и поверхность сформированной в результате лечения хоаны. У всех пациентов отмечалось свободное дыхание без затруднений, не было выявлено ни одного рецидива.
В дальнейшем эффективность хирургического лечения планируется оценивать прежде всего по эндоскопической послеоперационной картине и данным повторного КТ через 12 мес. К сожалению, объективная оценка эффективности носового дыхания (риноманометрия), принятая для детей более старшего возраста, у детей до года технически невыполнима.
Для оценки качества жизни после операции родителям был предложен валидированный опросник, с помощью которого родители в баллах от 1 до 10 отмечали, как ребенок спит, ест, дышит, его настроение, степень беспокойства. Способ пластики хоан с применением фибринового клея с целью крепления лоскутов слизистой оболочки к костным структурам носовой полости сокращал реабилитационный период с 4–8 мес. до 2–3 сут и улучшал показатели качества жизни пациентов после операции.
Обсуждение
Оперативное вмешательство у детей до года с АХ должно быть: малоинвазивным, одномоментным, функциональным, с низкой частотой осложнений, с коротким восстановительным периодом, без болезненного послеоперационного ухода, не требующим дополнительного анестезиологического пособия. С развитием эндоскопической техники в течение последних 30 лет предпочтение при хирургии врожденной АХ отдается трансназальному эндоскопическому доступу, поскольку непосредственная визуализация операционного поля позволяет удалить атретическую пластинку и задние отделы сошника для увеличения хоан. Важнейшими аспектами выбора тактики операционного лечения АХ у детей являются, прежде всего, исключение опасности повторного стенозирования полости носа, сокращение частоты осложнений в процессе лечения, сокращение срока восстановления, улучшение качества жизни в послеоперационном периоде. Послеоперационный рестеноз остается самым распространенным осложнением эндоскопической трансназальной техники при врожденной АХ. Факторы риска рестеноза включают возраст, массу тела, двустороннее распространение процесса, недостаточную проходимость носа и чрезмерный рост грануляционной ткани на оголенной кости. Остается спорным вопрос о том, как снизить частоту послеоперационного рестеноза у этих пациентов.
Двумя наиболее распространенными предметами разногласий относительно хирургического восстановления хоаны являются использование стентирования после операции и создание лоскутов для покрытия оголенной кости. Для предотвращения рестеноза и последующей повторной операции многие исследователи выступают за сохранение слизистой оболочки для использования в качестве лоскутов, что в большинстве случаев сочетается с послеоперационным стентированием [11]. Однако следует тщательно учитывать недостатки, связанные со стентом, включая травмы и воспаление окружающих тканей, которые отмечаются в среднем через 31–33 дня после первичной операции. Между тем необходимость ревизии рестеноза после удаления стента остается еще одной проблемой для хирурга и пациентов [12]. Также многие авторы используют различные формы лоскутов слизистой оболочки (звездообразный разрез, Г-образный разрез и др.) [3, 7]. Этот метод использования септоназального лоскута обеспечивает отличную визуализацию сошника и боковой носовой кости для создания адекватной проходимости неохоаны и покрытия костной после-операционной поверхности. Соответственно, вся окружность неохоаны покрывается слизистой оболочкой. В двух исследованиях сообщалось об использовании новых биоабсорбируемых стентов, содержащих стероиды и используемых после операции при врожденной АХ, а также о безопасности и эффективности этого метода [13, 14]. Стент состоит из биоабсорбируемого полилактид-гликолидного полимера, покрытого 652 мкг кортикостероида (мометазона фуроат). Он имеет цилиндрическую ажурную форму и содержит пружинный механизм, позволяющий ему соответствовать форме полости, в которую он устанавливается. Преимущества этого типа стента включают удержание лоскутов слизистой оболочки в нужном положении и поддержание проходимости неохоаны. Кортикостероид высвобождается контролируемым образом примерно в течение 30 дней в окружающую слизистую оболочку [15], поэтому не требуется ревизионной операции для удаления. Такая комбинация техники использования септоназального лоскута и стентов со стероидным покрытием в месте атрезии позволяла не только минимизировать травму и осложнения, но и добиться постоянной функциональной проходимости за один этап операции. Однако в литературе появились сообщения о послеоперационных осложнениях, связанных с превращением этих стентов в инородные тела желудочно-кишечного тракта или верхних дыхательных путей [12]. Таким образом, возникает вопрос о фиксации стента в носоглотке, так как риск аспирации и смещения стента до периода рассасывания остается крайне высоким.
Заключение
Нами успешно применен способ пластики хоан с использованием фибринового клея для крепления лоскутов слизистой оболочки к костным структурам носовой полости. Этот малоинвазивный способ предельно сокращает реабилитационный период, улучшает показатели качества жизни пациента после операции, его можно считать «золотым стандартом» хирургического лечения АХ. Он позволяет в кратчайшие сроки восстановить просвет хоаны без применения травматичных стентов, с минимальными рисками кровотечения и рестенозирования, а также значительно сократить сроки пребывания в стационаре. Родители в послеоперационном периоде могут ухаживать за ребенком дома, при этом не требуется регулярное внимание со стороны ЛОР-врача. Представленная методика лечения АХ не несет риска повторного стенозирования в отдаленном периоде. Список литературы Вы можете найти на сайте http://www.rmj.ru
материал rmj.ru
