Введение
Актуальность остеопороза (ОП) обусловлена, прежде всего, высокой распространенностью среди пожилых женщин в постменопаузе и определяется возникновением переломов, из которых наиболее характерны переломы проксимального отдела бедренной кости, тел позвонков. Основной причиной ОП является потеря костной массы в постменопаузе, связанная с дефицитом эстрогенов. Другими важными факторами риска развития ОП в постменопаузе являются возраст, генетическая предрасположенность, курение, низкий индекс массы тела, сопутствующие заболевания и лекарственные препараты, которые снижают минеральную плотность кости (МПК) [1]. Переломы при ОП значительно снижают качество жизни, повышают вероятность инвалидности и смерти, особенно при переломах бедра и позвоночника [2, 3].
Коморбидность и мультиморбидность становятся ключевыми проблемами в клинике внутренних болезней. Мультиморбидность возникает у взрослых всех возрастов, но количество и сложность сопутствующих состояний обычно увеличиваются с возрастом, так что сердечно-сосудистые заболевания (ССЗ) у пожилых людей обычно возникают в контексте мультиморбидности. Текущие исследования и клиническая практика в области ССЗ способствовали развитию парадигмы терапии, специфичной для заболевания, которая фокусируется преимущественно на лечении одного заболевания и редко предусматривает сложности, обусловленные мультиморбидностью. Взаимодействие между лекарственными препаратами может непреднамеренно вызвать пагубные последствия в контексте мультиморбидности [4–7].
Существенный вклад в смертность от ССЗ вносит артериальная гипертензия (АГ) [8]. Менее 10% взрослых в возрасте 65 лет и старше имеют нормотензию без приема антигипертензивных препаратов. У взрослых в возрасте 65 лет и старше АГ является самым важным и распространенным фактором риска ССЗ. В течение жизни наблюдается кумулятивное воздействие эндотелиальных повреждений на сосудистую стенку, что увеличивает риск повышения артериальной жесткости, нарушения сосудистой реактивности и гемодинамических сдвигов, которые могут еще больше усугублять артериальную дисфункцию [9]. АГ — это самый значимый сердечно-сосудистый фактор риска во всем мире ввиду высокой распространенности и способности влиять на развитие различных сердечно-сосудистых и почечных последствий [10].
Остеопороз и ССЗ как возраст-ассоциированные патологии объединяют не только схожие факторы риска, но и общие молекулярные механизмы патогенеза, что обеспечивает их двунаправленную связь [11–13]. Одним из таких механизмов выступает участие системы белков костного происхождения — остеопротегерина, RANK, RANKL и сигнального пути Wnt в регуляции как костного метаболизма, так и процессов кальцификации сосудистой стенки [14–16].
Так, в работе M.H. Sharafi et al. [17] изучалась сложная связь между ОП и ССЗ, особое внимание было уделено общим путям патогенеза, таким как воспаление, окислительный стресс и система рецепторов активатора системы ядерного фактора κB — лиганда — остеопротегерина, которые способствуют как потере костной массы, так и сосудистой кальцификации. Показано, что у лиц с низкой МПК наблюдается повышенный риск развития ССЗ и увеличения смертности от них, что свидетельствует о тесной взаимозависимости состояния костной ткани и сердечно-сосудистой системы.
Ключевые биологические процессы, такие как остеогенная дифференциация клеток гладкой мускулатуры сосудов и активная роль белков костного происхождения — остеопонтина и остеопротегерина — еще раз подчеркивают тесную связь между метаболизмом костной ткани и сердечно-сосудистой системой. Общие факторы риска, такие как старение, дефицит эстрогена, недостаточность витамина D, и факторы образа жизни, такие как курение и отсутствие физической активности, дополнительно связывают ОП и ССЗ. Терапевтические вмешательства, включая бисфосфонаты, деносумаб и статины, показали потенциал в решении обоих состояний, что позволяет предположить, что методы лечения, направленные на МПК, могут принести пользу и при ССЗ [18]. Тем не менее точные молекулярные механизмы, лежащие в основе этих двойных эффектов, остаются неясными, что требует дальнейших исследований.
Кальцификация сосудистой стенки — патологический процесс отложения минеральных солей, преимущественно гидроксиапатита, в составе сосудистой стенки, ведущий к снижению ее эластичности и повышенной сосудистой жесткости [19]. Этот процесс является важным механизмом патогенеза атеросклероза и значительно увеличивает риск ССЗ [20, 21].
Результаты клинических исследований демонстрируют высокую коморбидность ОП и атеросклеротических заболеваний сосудов, включая ишемическую болезнь сердца (ИБС), с частотой встречаемости от 60 до 76%. Установлено, что у женщин в постменопаузе наличие ОП ассоциировано с повышенным риском ССЗ, причем этот риск является зависимым от степени выраженности остеопении на момент диагностики. Так, относительный риск ССЗ у женщин с ОП превышает таковой у женщин с нормальной МПК в 3,9 раза (95% доверительный интервал (ДИ) 2,0–7,7, p<0,001). Данная закономерность подтверждена в крупном метаанализе, что послужило основанием для рекомендаций по обязательному учету состояния сердечно-сосудистой системы у пациентов с ОП и переломами [22, 23].
В настоящее время данных крупных рандомизированных исследований и систематических метаанализов недостаточно для того, чтобы сделать окончательные выводы о причинно-следственной связи между сниженной МПК и риском ССЗ у женщин с ОП.
Цель исследования: оценить показатели сосудистой жесткости у женщин с постменопаузальным ОП и определить их взаимосвязь с сердечно-сосудистыми рисками.
Содержание статьи
Материал и методы
В 2013–2023 гг. на базе ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России проведено проспективное когортное исследование. Осмотрены 8250 женщин с постменопаузальным ОП, обратившихся в центр остеопороза ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, и проанализированы данные их медицинских карт. Все женщины подписали информированное согласие на участие в исследовании и обработку обезличенных персональных данных. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России.
По результатам анализа критериев включения и исключения в проспективный этап исследования было включено 500 пациенток. Для проведения сравнительного анализа были выделены две группы по 100 женщин с постменопаузальным ОП и без ОП, имеющих клинически значимые коморбидные заболевания, такие как ИБС и АГ. Группы были сопоставимы по возрасту, что позволило обеспечить корректность сравнительного анализа. Для дальнейшего углубленного исследования из каждой группы посредством метода рандомизации были отобраны по 30 пациенток. К ССЗ, связанным с атеросклерозом, отнесены стенокардия напряжения, ИБС, инфаркт миокарда и острое нарушение мозгового кровообращения (ОНМК). Диагнозы подтверждены по данным представленных медицинских карт и выписок. ОП диагностировали согласно рекомендациям Всемирной организации здравоохранения по Т-критерию, то есть в стандартных отклонениях от нормативных показателей пиковой костной массы здоровых женщин.
Критерии включения: 1) постменопаузальный ОП и коморбидные заболевания легкой или средней степени тяжести (ИБС, АГ, острый инфаркт миокарда, ОНМК, фибрилляция предсердий), один повторный перелом (вертебральный или невертебральный) и более; 2) подписанное и датированное письменное информированное согласие на участие в исследовании; 3) нахождение на амбулаторном лечении в постменопаузе с диагнозом «постменопаузальный остеопороз» (спонтанная аменорея в течение более 12 мес.).
С помощью мониторинга артериального давления (АД) (ООО «Петр Телегин», Россия) были проанализированы следующие параметры периферического АД: среднее систолическое артериальное давление (САД), среднее диастолическое АД (ДАД) и среднее пульсовое АД (ПАД). Параметры центральной гемодинамики и атеросклероза рассчитывали путем оценки формы осциллометрической кривой с использованием математических формул, встроенных в сфигмоманометр Vasotens 24 PLAB (ООО «Петр Телегин», Россия). Оценивали следующие параметры: среднее САД в аорте (САДао), среднее ДАД в аорте (ДАДао), среднее ПАД в аорте (ПАДао), скорость распространения пульсовой волны в аорте (СРПВао) [24]. Индекс эффективности кровотока под эндокардом рассчитывали в процентах от площадей систолического и диастолического срезов под кривой ПАД в аорте. Площадь систолической части отражает потребность миокарда в кислороде, а диастолическая часть — запас энергии. Оценивали индекс аугментации (ИА). В норме ИА, приведенный к частоте сердечных сокращений (ЧСС) 75 в 1 мин, имеет отрицательные значения, при повышении жесткости артерий его величина возрастает. Оптимальными значениями считаются менее -30%, диапазон от -30% до -10% является нормальным, от -10% до 10% — повышенным, а значения равные и выше 10% принято считать патологическими. Индекс ригидности артерий (arterial stiffness index, ASI) рассчитывается автоматически с учетом формы пульсовой волны. Верхняя часть сглаженного «колокола» (графическое изображение пульсовой волны) (по уровню 80% от максимума) заменяется равновеликой трапецией. Ширина этой трапеции на уровне 95% от максимума, выраженная в мм рт. ст. и умноженная на 10, принимается за величину ASI. Показано, что жесткость связана с шириной вершины осциллометрической кривой, имеющей форму «колокола» [25]. ASI можно использовать для ранней диагностики ИБС. Приняты соответствующие диапазоны значений для ASI: от 0 до 80 — отсутствует риск ИБС, от 81 до 209 — умеренный риск ИБС, от 210 до 309 — высокий риск ИБС, значения выше 310 соответствуют очень высокому риску ИБС. Амбулаторный ASI рассчитывался программой автоматически, исходя из коэффициента линейной взаимосвязи значений САД и ДАД. Для лиц старше 20 лет нормой AASI считается показатель <0,7 [26]. Амплификация ПАД — отношение ПАД в плечевой артерии к ПАД в аорте, данные рассчитывались с учетом ЧСС 75 в 1 мин.
Минеральную плотность кости оценивали на основании DXA Hologic Discoveri Wi в двух точках: поясничном отделе позвоночника (L1–L4) и шейке бедренной кости.
Прогноз 10-летней выживаемости обследованных пациенток определен с помощью индекса коморбидности Чарлсон (Charlson Comorbidity Index, CCI), предложенного M.E. Charlson в 1987 г. для оценки отдаленного прогноза полиморбидных больных. Данный индекс представляет собой балльную систему (от 0 до 40 баллов) определения наличия сопутствующих заболеваний и применим для прогноза летальности. При его расчете суммируют баллы, соответствующие сопутствующим заболеваниям, а также добавляют 1 балл на каждые 10 лет жизни при превышении пациентом 40-летнего возраста. Смертность больных при отсутствии полиморбидности составляет 12%, при 1–2 баллах — 26%, при 3–4 баллах — 52%, а при сумме более 5 баллов — 85%.
Статистический анализ проводили с использованием программ IBM SPSS Statistics 26 (SPSS Inc., США) и StatTech v. 3.1.8 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка. Ввиду отсутствия нормального распределения показатели представлены с помощью медианы (Me), нижнего и верхнего квартилей [Q1; Q3]. Сравнение двух групп по количественному показателю выполняли с помощью U-критерия Манна — Уитни. Направление и теснота корреляционной связи между двумя количественными показателями оценены с помощью коэффициента ранговой корреляции Спирмена (rs). Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разработана с помощью метода линейной регрессии.
Результаты исследования
Результаты мониторинга АД представлены в таблице.
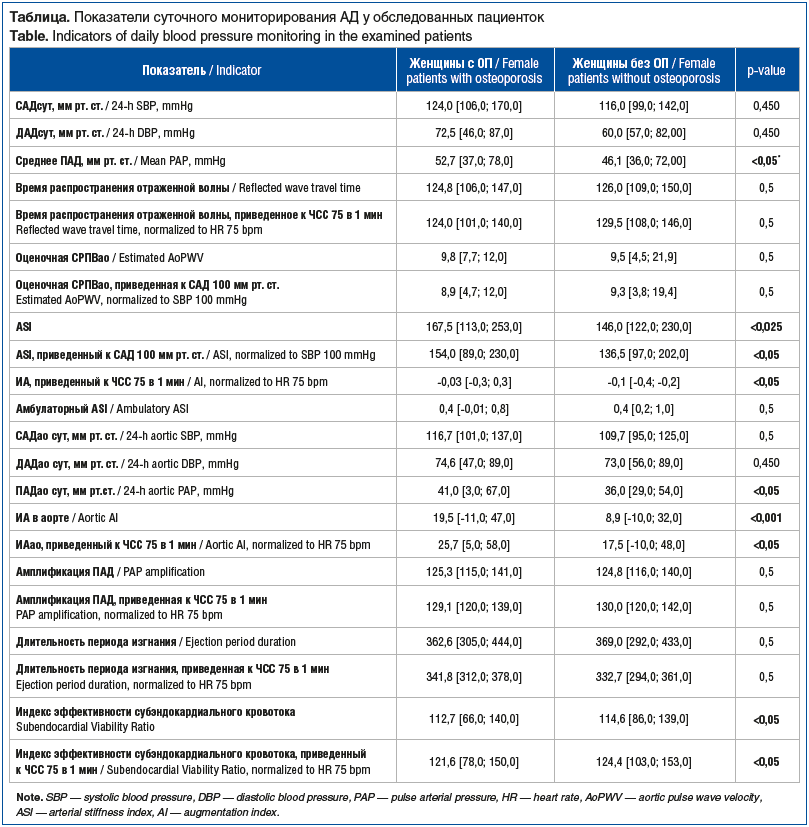
Основополагающей детерминантой артериальной жесткости является уровень АД [28]. В связи с этим в программе Vazotens24 предусмотрен расчет СРПВao с учетом САД 100 мм рт. ст. Согласно данным, представленным в таблице, у женщин с ОП выявлено повышение некоторых гемодинамических и сосудистых показателей по сравнению с женщинами без ОП. САД и ДАД у женщин с ОП характеризовались тенденцией к более высоким значениям по сравнению с женщинами без ОП, однако среднее ПАД было уже статистически значимо выше у женщин с ОП. Выявлены статистически значимые различия показателей ASI, суточного ПАД, индекса аугментации в аорте. Отдельно стоит выделить индекс эффективности субэндокардиального кровотока, в том числе приведенный к ЧСС 75, который характеризовался статистически значимым снижением у женщин с ОП. Таким образом, у женщин с ОП отмечено повышение пульсового давления, выраженности аугментации и снижение эффективности субэндокардиального кровотока, что может свидетельствовать о негативных изменениях сосудистого тонуса и гемодинамики при снижении МПК.
Медиана значения CCI в группе пациенток с ОП составила 7,3 [6,0; 9,0], тогда как у женщин без ОП — 5,3 [4,0; 7,0]. При проведении корреляционного анализа в группе пациенток с ОП выявлена значимая положительная корреляция среднего ПАД с CCI (rs=0,917, p<0,01), времени распространения отраженной волны с CCI (rs=0,917, p<0,01), амбулаторным ASI с CCI (rs=0,975, p<0,01), индекса эффективности субэндокардиального кровотока, приведенного к ЧСС 75 в 1 мин, с МПК L1–L4 (rs=0,917, p<0,01).
Обсуждение
В ходе настоящей работы получены убедительные доказательства того, что у пациентов с ОП сердечно-сосудистый риск и выраженность полиморбидности существенно выше, чем у лиц без ОП. Ранее в нашем исследовании [6] установлено, что в группе пациенток с ОП медиана значения CCI составила 5,0 [3,5; 7,0], тогда как у женщин без ОП — 3,0 [3,0; 5,0], свидетельствуя о более выраженной полиморбидности пациенток с ОП. Средний показатель QRISK-3 у пациенток с ОП составил 20,4 (95% ДИ 12,4–36,55), что свидетельствует об умеренно высоком риске развития ССЗ в ближайшие 10 лет. Истинное значение риска для данной группы пациенток варьирует от 12,4 до 36,55%, что указывает на значительную распространенность факторов сердечно-сосудистого риска среди лиц с ОП. В сравнительной группе больных без ОП QRISK-3 равнялся 17,55 (95% ДИ 13,45–22,0), отражая существенный, но статистически значимо меньший риск сердечно-сосудистых событий, преимущественно близкий к нижней границе диапазона риска. Таким образом, наличие ОП ассоциируется с более высоким долгосрочным сердечно-сосудистым риском по шкале QRISK-3 по сравнению с пациентами, не имеющими ОП. В последние годы в международных исследованиях также показано повышение долгосрочного сердечно-сосудистого риска при ОП. В ходе кросс-секционного анализа по данным Bushehr Elderly Health Program (Иран, 2023) [29] было определено, что по шкале ACC/AHA и Framingham 30–37% женщин с ОП попадают в категорию высокого (≥20%) 10-летнего риска по развитию ССЗ, что близко к нашим данным. Сочетание ОП с коморбидными состояниями увеличивает не только риск развития переломов, но и неблагоприятный прогноз, а также повышает риск смерти, что подтверждает независимую роль ОП как фактора риска тяжелых исходов [30].
Необходимо отметить, что артериальная жесткость рассматривается как ключевой сосудистый феномен, тесно связанный с уровнем системного АД, что подтверждено многочисленными исследованиями. Программа Vazotens24 использует расчет СРПВao с приведением к стандартизированному уровню САД, что повышает точность оценки сосудистого тонуса при сравнении разных когорт [23]. В нашем исследовании выявлено, что у женщин с ОП значения гемодинамических и сосудистых параметров значительно отличаются от контрольной группы. Несмотря на схожие уровни САД и ДАД, отмечено достоверное повышение среднего ПАД (52,7 мм рт. ст. против 46,1 мм рт. ст., p<0,05), что отражает усиление отраженных волн и ухудшение эластических свойств сосудистой стенки. ASI и ASI, приведенный к САД 100 мм рт. ст., также значительно выше у пациенток с ОП, свидетельствуя о выраженной артериальной ригидности. Дополнительно повышение суточного ПАД и ИА (см. таблицу) указывает на ранние гемодинамические нарушения, ассоциированные с костной патологией. Снижение индекса эффективности субэндокардиального кровотока (112,7 против 114,6; 121,6 против 124,4, p<0,05) свидетельствует о негативных изменениях коронарной и периферической перфузии у женщин с ОП, что согласуется с данными литературы о прямой связи ригидности сосудов с сосудистыми и костными осложнениями. Особую значимость приобретает выявление тесных корреляционных связей между сосудистыми показателями и выраженностью коморбидности. Так, среднее ПАД, время распространения отраженной волны и амбулаторный ASI проявили очень сильную положительную связь с CCI (rs=0,917–0,975, p<0,01). Это указывает на то, что усиление сосудистой ригидности и гемодинамических нарушений прямо пропорционально росту полиморбидности пациента и тяжести хронических заболеваний, что согласуется с современными представлениями о единстве патогенеза ОП и сердечно-сосудистой патологии.
Заключение
Таким образом, полученные данные достоверно подтверждают, что патофизиологические изменения сосудистого тонуса, ригидности и перфузии миокарда, выявляемые у женщин с постменопаузальным ОП, могут рассматриваться как независимые предикторы более высокого сердечно-сосудистого риска и должны учитываться при стратификации и ведении этой полиморбидной когорты пациенток. Значимость мультидисциплинарного подхода к пациенткам с ОП определяется необходимостью раннего выявления сосудистых изменений, своевременной модификации факторов риска и корректировки индивидуальной стратегии профилактики сердечно-сосудистых осложнений у женщин с низкой МПК.
Сведения об авторах:
Жугрова Елена Сергеевна — к.м.н., доцент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-8622-5205
Мазуров Вадим Иванович — академик РАН, профессор, д.м.н., заслуженный деятель науки Российской Федерации, директор НИИ ревматологии и заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-0797-2051
Беляева Ирина Борисовна — д.м.н., профессор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9126-3639
Шиманьски Даниэль Анджеевич — к.м.н., ассистент кафедры терапии госпитальной с курсом аллергологии и иммунологии имени ак. Черноруцкого с клиникой ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000‑0002‑6903‑2217
Гумерова Виктория Евгеньевна — к.м.н., ассистент кафедры госпитальной терапии и кардиологии им. М.С. Кушаковского ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0003-2805-3748
Контактная информация: Жугрова Елена Сергеевна, e-mail: jugrova@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 01.07.2025.
Поступила после рецензирования 23.07.2025.
Принята в печать 18.08.2025.
About the authors:
Elena S. Zhugrova — C. Sc. (Med.), associate professor of the E.E. Eikhvald Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-8622-5205
Vadim I. Mazurov — Academician of the Russian Academy of Sciences, Professor, Dr. Sc. (Med.), Honored Scientist of the Russian Federation, Chief Scientific Consultant, Director of the Research Institute of Rheumatology, Head of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care with a course in Hematology and Transfusiology named after E.E. Eichwald, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-0797-2051
Irina B. Belyaeva — Dr. Sc. (Med.), Professor of the E.E. Eikhvald Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9126-3639
Daniel A. Shimansky — C. Sc. (Med.), assistant of the Department of Hospital Therapy with a Course of Allergology and Immunology named after Academician Chernorutsky with Clinical Department, Pavlov First Saint-Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-6903-2217
Victoria E. Gumerova — C. Sc. (Med.), assistant of the Department of Hospital Therapy and Cardiology named after M.S. Kushakovsky, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-2805-3748
Contact information: Elena S. Zhugrova, e-mail: jugrova@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 01.07.2025.
Revised 23.07.2025.
Accepted 18.08.2025.
Информация с rmj.ru
