Введение
Имплантация эмбриона — ключевой этап репродуктивного процесса, эффективность которого определяется двумя критически важными факторами: морфофункциональной состоятельностью эндометрия и качеством самого эмбриона. Рецептивность эндометрия подразумевает его способность обеспечить адгезию, инвазию и последующую нидацию бластоцисты [1]. Наибольший потенциал для успешной имплантации наблюдается в период так называемого «имплантационного окна», который в стандартном 28-дневном цикле соответствует 20–24-му дню или 5–10-му дню после овуляции. Именно в этот временной интервал создаются оптимальные молекулярно-биологические и гистологические условия для инвазии трофобласта [2].
Трансвагинальное УЗИ остается «золотым стандартом» мониторинга состояния эндометрия, при этом ключевым прогностическим маркером его рецептивности считается толщина М-эхо. Хотя единые нормативные значения до сих пор дискутабельны, большинство репродуктологов определяют гипоплазию эндометрия при показателях толщины эндометрия ≤7 мм в периовуляторной фазе [3].
Клинические наблюдения подтверждают, что уменьшение толщины эндометрия ниже 7 мм достоверно снижает частоту наступления клинической беременности, ухудшает результаты программ вспомогательных репродуктивных технологий (ВРТ) и повышает риск ранних репродуктивных потерь [4, 5]. Согласно данным литературы, до 67% неудачных попыток экстракорпорального оплодотворения (ЭКО) связаны именно с нарушением рецептивности эндометрия, которая коррелирует не только с его толщиной, но и с особенностями васкуляризации, экспрессией молекул адгезии и иммуногистохимическими характеристиками [6–8].
Распространенность недостаточности эндометрия имеет выраженную возрастную зависимость: максимальная частота (до 30%) регистрируется у пациенток старше 40 лет, что объясняется инволютивными изменениями и снижением гормональной чувствительности [8–11]. В общей структуре причин женского бесплодия данная патология занимает около 5%, однако ее вклад в неудачи ВРТ значительно больше [12].
Учитывая негативное влияние тонкого эндометрия на репродуктивные исходы, поиск эффективных методов его коррекции остается актуальной задачей репродуктивной медицины. Современные терапевтические стратегии включают:
стимуляцию пролиферации (гормональная терапия, факторы роста);
оптимизацию перфузии (физиотерапия, низкомолекулярные гепарины, ультразвуковая кавитация);
повышение рецептивности (персонализированный перенос эмбрионов) [2, 11, 13, 14].
В современной гинекологии активно внедряются инновационные физиотерапевтические методы, среди которых особого внимания заслуживает ультразвуковая кавитация. Данная технология, основанная на фундаментальных физических принципах, открытых еще в XIX в., в последнее десятилетие нашла широкое применение в лечении широкого спектра гинекологических патологий [15].
Феномен кавитации, впервые описанный Р. Фрудом в 1894 г., представляет собой процесс образования и коллапса микропузырьков газа в жидкой среде под воздействием ультразвуковых волн. В клинической практике этот эффект реализуется с помощью специализированного оборудования, которое обеспечивает: генерацию ультразвуковых волн оптимальной частоты, контролируемое образование кавитационных пузырьков, точную доставку лекарственных веществ. Кавитационный эффект проявляется многоуровневым воздействием на биологические ткани, это: антимикробное действие, стимуляция ангиогенеза, активация пролиферативных процессов, ускорение репарации тканей, повышение эффективности противовирусной терапии, коррекция местного иммунного ответа [16–18].
Ряд исследований продемонстрировал принципиально новые возможности применения рекомбинантного гранулоцитарного колониестимулирующего фактора (рГ-КСФ) у пациенток с рефрактерными формами эндометриальной недостаточности. Эти данные стимулировали серию последующих исследований, раскрывающих многофакторное влияние данного цитокина на рецептивность эндометрия. рГ-КСФ оказывает свое воздействие посредством связывания со специфическим рецептором G-CSFR, стимулирует экспрессию G-CSFR — это усиливает восстановление эндотелия, улучшает восприимчивость эндометрия и способствует имплантации эмбрионов. рГ-КСФ способен индуцировать пролиферативный клеточный ядерный антиген (PCNA) и рецептор фактора роста эндотелия сосудов (VEGFR) 2 в клетках эндометрия. Это приводит к подавлению апоптотических механизмов, индукции VEGF-опосредованного ангиогенеза, улучшению состояния микроциркуляторного русла и повышению выживаемости клеток эндометрия [2, 19].
Рекомбинантный Г-КСФ может индуцировать экспрессию цитокинов, включая цитокератин 19, виментин, VEGF, ингибирующий фактор лейкемии, интерлейкин (IL) 1, β3-интегрин и фактор некроза опухоли α, одновременно снижая экспрессию IL-2. Это способствует пролиферации эндометрия, ангиогенезу, восстановлению ультраструктурной организации клеток и усилению клеточной пролиферации [20].
Y. Xie et al. [21] проводили исследование на пиноподах, которые являются одним из ключевых показателей восприимчивости эндометрия. В рамках исследования было обнаружено, что рГ-КСФ может увеличить количество эндометриальных пиноподов у мышей, у которых образование пиноподов было уменьшено на фоне гипоплазии эндометрия, а также может замедлить темпы дегенеративных процессов в клетках.
Недостаточность данных о лечении тонкого эндометрия — это не просто констатация факта, а глобальный вызов для научного сообщества. Эта ситуация создает беспрецедентные возможности для исследований в самых разных областях: от фундаментальной биологии (изучение молекулярных механизмов рецептивности) до клинической практики (разработка и валидация новых протоколов диагностики и терапии).
Цель исследования: проведение комплексной оценки клинической эффективности инновационного метода коррекции «тонкого» эндометрия, основанного на сочетанном применении ультразвуковой кавитации и рГ-КСФ человека.
Содержание статьи
Материал и методы
В исследование включено 36 пациенток, проходивших лечение по поводу бесплодия, которым был выставлен диагноз «тонкий» эндометрий, в клинике «Поколение» — центре гинекологии, репродукции и ЭКО. Все пациентки подписали информированное согласие. Исследование одобрено этическим комитетом ФГБОУ ВО ДГМУ Минздрава России (протокол № 7 от 15.02.2022).
Критерии включения: установленный диагноз «тонкий» эндометрий», возраст от 20 до 40 лет.
Критерии невключения: онкологические заболевания в анамнезе, декомпенсированные заболевания сердечно-сосудистой, нервной или других систем организма, острые воспалительные или гнойно-некротические процессы в органах малого таза, отказ от подписания информированного добровольного согласия.
Критерии исключения: развитие серьезных нежелательных явлений или непереносимость процедуры, несоблюдение пациенткой протокола лечения или обследования, возникновение непредвиденных обстоятельств или заболеваний, делающих дальнейшее участие в исследовании невозможным или небезопасным, личное желание пациентки прекратить участие в исследовании в любой его момент.
Все пациентки, включенные в исследование, страдали бесплодием в среднем в течение 5,2±3,1 года. Первичное бесплодие было диагностировано у 25 (69,4%) женщин, вторичное — у 11 (30,6%). Все они были рефрактерны к стандартной терапии, включающей многократные курсы эстрогенов, вазоактивных препаратов (пентоксифиллин, низкодозированный аспирин), а в части случаев — физиотерапию и инфузии аутологичной обогащенной тромбоцитами плазмы. Двенадцать пациенток имели в анамнезе неудачные попытки ЭКО, отмененные или завершившиеся негативным результатом из-за недостаточности эндометрия.
Толщину эндометрия оценивали посредством ультразвуковой диагностики в преовуляторный период.
Всем пациенткам проводили ультразвуковую кавитацию на аппарате серии АК100М (ACTITON) («Фотек») [22] с использованием рГ-КСФ человека (филграстим), с 5-го по 9-й день менструального цикла. Первый этап — 5 процедур бесконтактной ультразвуковой кавитации раствором хлоргексидина биглюконата 0,05% объемом 200 мл. Второй этап — два курса по 5 процедур бесконтактной ультразвуковой кавитации с 1 мл филграстима, разведенного в 200 мл раствора натрия хлорида 0,9%. Кавитация проводится с частотой 25 кГц, уровень ультразвуковых колебаний — 70 дБ, длительность процедуры — 4 мин. Общее количество курсов — 3. Количество процедур в курсе — 5. Общее количество процедур — 15.
Оценку толщины эндометрия выполняли после каждого курса лечения.
Статистический анализ проводили с использованием программного пакета SPSS Statistics v. ХХ. Данные представлены в виде среднего арифметического и стандартного отклонения (M±SD). Нормальность распределения количественных показателей проверяли с помощью критерия Шапиро — Уилка. Поскольку сравнение проводилось для повторных измерений в одной и той же группе пациенток (связанные выборки), а исходные данные толщины эндометрия имели нормальное распределение (p>0,05 по критерию Шапиро — Уилка), для оценки динамики изменений использовали парный t-критерий. Для сравнения долей использовали критерий χ2. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Средний возраст пациенток составил 28,0±4,6 года, период наблюдения — 2 года и 4 мес. Исходно показатель толщины эндометрия варьировал от 3,0 до 6,5 мм (см. таблицу).
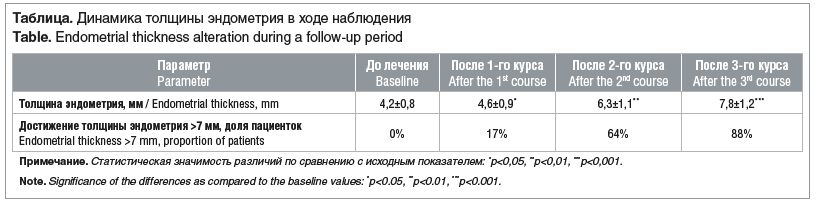
По данным УЗИ было зафиксировано изменение структуры эндометрия: исчезновение гипоэхогенных зон у 65% женщин и появление четкой трехслойной структуры (triple-line pattern) у 72%. После проведения лечения у 27 пациенток наблюдалось наступление беременности, из них у 10 — самопроизвольно, из них доношено 9, а у 17 — посредством ВРТ, доношено 15.
Было выявлено 2 (5,5%) случая побочных эффектов в виде легкого жжения во время процедуры, которое купировалось самостоятельно. Аллергические реакции не выявлены.
Обсуждение
Интеграция ультразвуковой кавитации в клиническую практику открывает новые возможности в лечении заболеваний женской репродуктивной системы. Перспективным направлением представляется комбинация данного метода с современными иммуномодулирующими и регенеративными технологиями.
Полученные результаты демонстрируют, что комбинированное воздействие ультразвуковой кавитации и рГ-КСФ не только увеличивает толщину эндометрия, но и восстанавливает его функциональную полноценность. Ключевым преимуществом метода является синергия физического и фармакологического компонентов: кавитация усиливает доставку препарата в глубокие слои эндометрия, а рГ-КСФ стимулирует пролиферацию и ангиогенез через активацию STAT3-зависимых путей. Механизмы лечебного действия основаны на усилении тканевой пенетрации за счет создания депо лекарственных средств в базальном слое и увеличения глубины проникновения активных веществ, биостимулирующего эффекта, включающего в себя активацию пролиферации стромальных клеток, стимуляцию ангиогенеза и улучшение реологических свойств эндометрия [23, 24].
Клиническая эффективность метода сводится к восстановлению морфофункциональных характеристик эндометрия:
нормализация гистологической структуры;
оптимизация рецепторного аппарата;
улучшение васкуляризации базального слоя.
Терапевтические преимущества данной методики:
увеличение толщины эндометрия до клинически значимых показателей;
восстановление «имплантационного окна».
Важно отметить, что традиционные методы (эстрогены, гистероскопия) часто не обеспечивают стойкого эффекта у пациенток с выраженной гипоплазией [25]. В отличие от них, предложенный протокол позволяет достичь клинически значимого утолщения эндометрия (>7 мм) у 88% женщин уже после 3 курсов и без инвазивного вмешательства.
Перспективным направлением является интеграция метода в алгоритмы подготовки к ЭКО, особенно для пациенток с повторными неудачами имплантации. Дальнейшие исследования должны быть направлены на идентификацию молекулярных маркеров (например, LIF, HOXA10), позволяющих прогнозировать ответ на терапию.
Заключение
Представленная технология демонстрирует выраженный синергический эффект, позволяющий существенно повысить эффективность лечения «тонкого» эндометрия. Метод соответствует современным требованиям персонализированной медицины, обеспечивая:
сокращение сроков терапии;
уменьшение медикаментозной нагрузки;
улучшение перинатальных исходов.
Перспективным направлением развития метода является его комбинация с биологическими видами терапии (использование факторов роста, стволовых клеток), что открывает новые возможности в регенеративной репродуктологии.
Сведения об авторах:
Абусуева Зухра Абусуевна — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета ФГБОУ ВО ДГМУ Минздрава России; 367012, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0000-0002-7729-1606
Сейдалиева Кира Лукмановна — ординатор МГУ имени М.В. Ломоносова; 119991, Россия, г. Москва, Ленинские горы, д. 1; ORCID iD 0000-0002-4303-7546
Алиева Нурияна Абдусамадовна — студентка 6-го курса ФГБОУ ВО ДГМУ Минздрава России; 367000, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0009-0008-2114-4640
Гасанова Лейла Аскеровна — студентка 6-го курса ФГБОУ ВО ДГМУ Минздрава России; 367000, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0009-0001-9695-5295
Алиева Саидат Назировна — студентка 6-го курса ФБОУ ВО ДГМУ Минздрава России; 367000, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD:0000-0001-6824-2274
Таймасханова Зарема Дибировна — студентка 6-го курса ФГБОУ ВО ДГМУ Минздрава России; 367000, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0009-0005-6074-1710
Давдиева Альвина Камиловна — студентка 6-го курса ФГБОУ ВО ДГМУ Минздрава России; 367000, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0009-0000-8400-3919
Абдулаева Эльмира Султамутовна — студентка 4-го курса ФГБОУ ВО ДГМУ Минздрава России; 367000, Россия, г. Махачкала, пл. Ленина, д. 1; ORCID iD 0009-0006-6291-7617
Контактная информация: Сейдалиева Кира Лукмановна, e-mail: kira_se02@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.09.2025.
Поступила после рецензирования 12.09.2025.
Принята в печать 16.09.2025.
About the authors:
Zukhra A. Abusueva — Dr. Sc. (Med.), Professor of the Department of Obstetrics and Gynecology, Faculty of General Medicine, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367000, Russian Federation; ORCID iD 0000-0002-7729-1606
Kira L. Seidalieva — Resident at Lomonosov Moscow State University; 1, Leninskie Gory, Moscow, 119991, Russian Federation; ORCID iD 0000-0002-4303-7546
Nuriyana A. Alieva — 6th year Student, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367000, Russian Federation; ORCID iD 0009-0008-2114-4640
Leila A. Gasanova — 6th year Student, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367000, Russian Federation; ORCID iD 0009-0001-9695-5295
Saidat N. Alieva — 6th year Student, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367012, Russian Federation; ORCID iD 0000-0001-6824-2274
Zarema D. Taimaskhanova — 6th year Student, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367012, Russian Federation; ORCID iD 0009-0005-6074-1710
Alvina K. Davdieva — 6th year Student, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367012, Russian Federation; ORCID iD 0009-0000-8400-3919
Elmira S. Abdulaeva — 6th year Student, Dagestan State Medical University; 1, Lenin sq., Makhachkala, 367012, Russian Federation; ORCID iD 0009-0006-6291-7617
Contact information: Kira L. Seidalieva, e-mail: kira_se02@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.09.2025.
Revised 12.09.2025.
Accepted 16.09.2025.
Информация с rmj.ru

