Введение
Нозокомиальная пневмония занимает одно из ведущих мест среди внутрибольничных инфекций, уступая по частоте лишь инфекциям мочевыводящих путей, и оказывает существенное влияние как на клинические исходы, так и на экономические затраты здравоохранения [1].
Проблема внутрибольничной пневмонии наиболее актуальна у пациентов, находящихся в отделениях интенсивной терапии, что обусловлено тяжестью их состояния и высоким риском инфицирования патогенами со множественной лекарственной устойчивостью (МЛУ) [2]. Вентилятор-ассоциированная пневмония (ВАП) приводит к значительному увеличению продолжительности искусственной вентиляции легких, удлиняет сроки пребывания в отделении реанимации и существенно повышает затраты на лечение. Согласно данным международных исследований, ВАП ассоциируется с увеличением времени госпитализации в среднем на 7–9 дней и ростом затрат на одного пациента до 40 000 долл., особенно при инфицировании мультирезистентными микроорганизмами [3]. Такая же корреляция наблюдается и для пациентов с черепно-мозговой травмой, у которых повышен риск ВАП [4]. Особое значение имеет тот факт, что летальность при тяжелой внутрибольничной пневмонии может превышать 50%. Это подчеркивает критическую важность своевременного и рационального назначения антибактериальной терапии (АБТ), а также поиска новых эффективных способов терапии [4, 5].
С целью продемонстрировать клиническую значимость и перспективность применения относительно нового антибактериального препарата представляем клиническое наблюдение успешного лечения ВАП, вызванной возбудителем со МЛУ, у пациента с боевой политравмой.
Содержание статьи
Клиническое наблюдение
Мужчина, 47 лет, был госпитализирован в отделение реанимации и интенсивной терапии 2 (ОРИТ 2) ГБУЗ «ГВВ № 3 ДЗМ» в апреле 2025 г. с сочетанным минно-взрывным ранением головы, шеи, груди и конечностей.
Объективный статус при поступлении: состояние тяжелое, медикаментозная седация, оценка по Шкале комы Глазго — 6 баллов, шкале SOFA — 8 баллов, шкале APACHE II — 16 баллов, шкале FOUR — 7 баллов. Температура тела 38,6 °C. Кожные покровы бледные, теплые, обычной влажности. Дыхание: искусственная вентиляция легких (ИВЛ) через эндотрахеальную трубку в режиме CPAP, частота дыхательных движений до 15 в 1 мин, аускультативно дыхание жесткое, ослаблено в заднебазальных отделах, больше слева, там же выслушиваются влажные хрипы. Гемодинамика стабильная. АД 113/68 мм рт. ст., частота сердечных сокращений 64 в 1 мин. Аускультативно: тоны сердца приглушены, ритмичные, шумы не выслушиваются. По кардиомонитору: ритм синусовый. Живот при пальпации мягкий, безболезненный, не увеличен в размере. Местно: в левой теменно-затылочной области послеоперационная рана под швами, без признаков нагноения. Кожный лоскут не выбухает над костным дефектом. Пульсация не определяется.
Анамнез заболевания. При исполнении обязанностей военной службы 25.03.2025 получил сочетанное минно-взрывное ранение головы, шеи, груди, конечностей. Первая врачебная помощь оказана на месте. В ОБУЗ «КОМКБ» 26.03.2025 была выполнена операция по удалению костных отломков, удалению очага ушиба левой теменно-затылочной области, пластика твердой мозговой оболочки. Санитарным транспортом 27.03.2025 эвакуирован в ФГБУ «ГВКГ им. Н.Н. Бурденко» Минобороны России. Переведен в ГБУЗ «ГВВ № 3 ДЗМ» 01.04.2025 для дальнейшего этапного лечения.
Сопутствующие заболевания: атеросклероз брахиоцефальных артерий, гемодинамически незначимый.
В 1-е сутки госпитализации в анализах крови выявлены анемия, лейкоцитоз, нейтрофилез, отмечено повышение уровня С-реактивного белка (СРБ), креатинина, мочевины и прокальцитонина (см. таблицу).
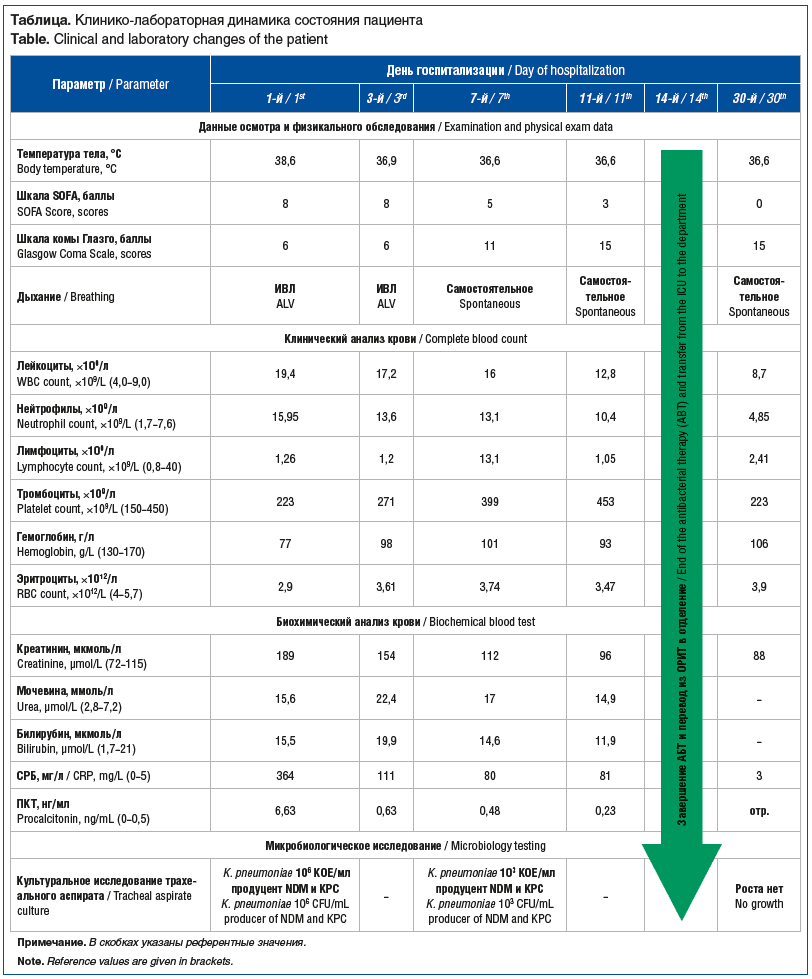
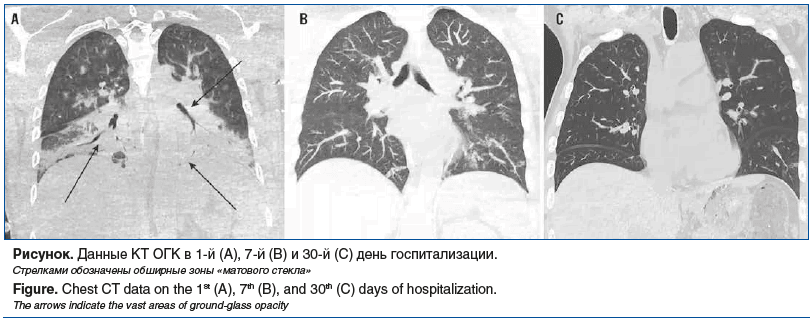
Принимая во внимание характер полученных ранений и повышение уровня маркеров системной воспалительной реакции (СВР), пациенту была выполнена компьютерная томография органов грудной клетки (КТ ОГК) и головного мозга, по результатам которой выявлены: посттрепанационный дефект левой теменной кости с выбуханием вещества мозга, а также двусторонняя полисегментарная пневмония с преобладанием в нижних долях (см. рисунок, А).
Пациент был стратифицирован по СКАТ в группу IIIb, и начата эмпирическая АБТ полимиксином В 100 мг в/в 2 р/сут и тигециклином 50 мг в/в 2 р/сут. В отделении, по решению врачебной комиссии, принято решение о дополнительном назначении противомикробного лекарственного препарата фтортиазинон, таблетированная форма, по схеме: 2400 мг в течение первых 3 дней, затем 1200 мг в сутки в течение следующих 8 дней. До назначения АБТ у пациента был взят трахеальный аспират для направления на микробиологическое исследование.
К 3-м суткам госпитализации на фоне АБТ у пациента нормализовалась температура тела, снизились уровни лейкоцитов (до 17,2×109/л), СРБ (до 111 мг/л) и прокальцитонина (ПКТ) (до 0,63 нг/мл) соответственно. По данным микробиологического исследования мокроты была выявлена Klebsiella pneumoniae 106 КОЕ/мл, продуцент карбапенемаз NDM и KPC, устойчивая к карбапенемам, цефалоспоринам III–IV поколения, фторхинолонам, аминогликозидам. С учетом положительной клинической и лабораторной динамики АБТ решено было продолжить в прежнем объеме.
На 7-е сутки пребывания в отделении интенсивной терапии на фоне продолжающейся АБТ сохранялась положительная динамика в виде снижения уровня СРБ до 80 мг/л и снижения уровня ПКТ до референтных значений (0,48 нг/мл). Также была отмечена умеренная положительная динамика лейкоцитоза в виде снижения его до 16×109/л.
При проведении повторной КТ ОГК была выявлена положительная динамика в виде разрешения обширных зон консолидации, с сохраняющимися остаточными явлениями (см. рисунок, В). К 8-м суткам госпитализации пациента удалось отключить от аппарата ИВЛ с восстановлением адекватного дыхания через трахеостомическую трубку (ТСТ). Примечательно, что при повторном микробиологическом исследовании трахеального аспирата было отмечено снижение количества K. pneumoniae до 103 КОЕ/мл, с аналогичным профилем чувствительности (см. таблицу).
На 11-й день терапии у пациента сохранялись стойкая нормотермия и адекватное самостоятельное дыхание через ТСТ. Уровень маркеров СВР в динамике не нарастал, также отмечалось дальнейшее снижение уровня лейкоцитов до 12,8×109/л.
В связи с улучшением общего состояния пациент был переведен в профильное отделение на 14-е сутки. Общая продолжительность АБТ также составила 14 дней, из которых в течение 11 дней был дополнительный прием фтортиазинона.
На 30-й день пациенту были выполнены дополнительная оценка маркеров СВР и повторная КТ ОГК. По результатам лабораторного обследования содержание лейкоцитов, СРБ и ПКТ соответствовало референтным значениям (см. таблицу), а по КТ отмечались лишь остаточные явления двусторонней полисегментарной бронхопневмонии (см. рисунок, С).
Пациент был выписан на 58-й день в удовлетворительном состоянии с рекомендациями по основному заболеванию.
Обсуждение
Пневмонии, обусловленные карбапенем-резистентными штаммами K. pneumoniae, представляют собой нарастающую угрозу глобальному здравоохранению. Согласно данным Глобальной системы эпиднадзора за антимикробной резистентностью и использованием противомикробных препаратов (GLASS), инициированной Всемирной организацией здравоохранения, в 2021 г. уровень устойчивости K. pneumoniae к меропенему достиг 12,3%, что свидетельствует о значительном распространении резистентных к карбапенемам изолятов1. Согласно крупному европейскому исследованию, распространенность инфекции, вызванной Enterobacteriaceae, продуцирующими карбапенемазы, составила 1,3 на 10 000 госпитализаций [6]. Во всем мире ежегодно не менее 1,27 млн человек умирают от инфекций, связанных с устойчивостью к противомикробным препаратам (АМР), при этом K. pneumoniae занимает второе место среди возбудителей с самой высокой смертностью, связанной с антимикробной резистентностью [7]. В Российской Федерации, согласно данным С.А. Рачиной и соавт. [8], на долю K. pneumoniae приходится до 1/3 всех случаев нозокомиальных пневмоний. При этом авторы отмечают, что большинство исследованных изолятов имели приобретенную устойчивость к большинству доступных на сегодняшний день антибактериальных препаратов. Заражение резистентными штаммами наиболее опасно для пациентов в критическом состоянии, поскольку это приводит к увеличению сроков госпитализации и высокому риску неблагоприятного исхода. Терапевтические возможности при пневмониях, вызванных карбапенем-резистентными штаммами K. pneumoniae, остаются ограниченными и включают использование аминогликозидов, полимиксинов (в частности, колистина), тигециклина, фосфомицина, цефтазидима/авибактама, азтреонама, а также различных их комбинаций. Однако, как свидетельствуют данные клинических наблюдений, в последние годы все чаще регистрируются изоляты K. pneumoniae, демонстрирующие МЛУ, включая резистентность к указанным препаратам, что существенно осложняет выбор эффективной АБТ [9]. Особую опасность вызывает рост резистентности к цефтазидиму/авибактаму, которая в Российской Федерации для K. pneumoniae составляет примерно 27% [8].
Течение пневмонии в представленном клиническом наблюдении осложнялось основным заболеванием — множественными повреждениями, полученными в результате минно-взрывных ранений.
Минно-взрывные ранения часто сопровождаются обширными повреждениями тканей, загрязнением раневой поверхности, некрозом и снижением местного кровотока. Это создает благоприятные условия для вторичной бактериальной инфекции, включая инфицирование резистентными микроорганизмами. Эффективность антибиотикотерапии при минно-взрывных ранениях с резистентными микроорганизмами значительно ниже, чем при чувствительных штаммах. Требуется индивидуальный подход. В связи с этим при поступлении и оценке состояния пациента нами было принято решение о включении в стандартную схему антибиотикотерапии нового антибактериального лекарственного препарата фтортиазинон. Антибактериальный препарат фтортиазинон зарегистрирован для лечения осложненных инфекций мочевыводящих путей, вызванных штаммами микроорганизмов Pseudomonas aeruginosa, Escherichia coli, K. pneumoniaе [10], показана эффективность в отношении множественно лекарственно-устойчивых K. pneumoniae, в том числе и резистентных к карбапенемам и цефалоспоринам. Также было продемонстрировано, что фтортиазинон подавляет формирование биопленок и эффективно предотвращает развитие модельной пневмонии, вызванной мультирезистентным клиническим изолятом K. pneumoniae [11].
Решение о включении фтортиазинона в схему АБТ в данном клиническом случае было принято на основании информации о проведении клинических исследований эффективности нового лекарственного препарата фтортиазинон при лечении пациентов, подключенных к аппарату ИВЛ2.
По результатам микробиологического исследования аспирата у пациента была выявлена K. pneumoniae, резистентная не только к карбапенемам, но и к цефалоспоринам III–IV поколения, а также к фторхинолонам и аминогликозидам.
С учетом наметившейся положительной динамики на 3-и сутки проведения эмпирической АБТ в сочетании с лекарственным препаратом фтортиазинон, несмотря на результаты микробиологического исследования, было принято решение не проводить коррекцию АБТ и продолжить лечение по назначенной схеме.
На фоне применения полимиксина В 100 мг в/в 2 р/сут и тигециклина 50 мг в/в 2 р/сут, а также фтортиазинона 1200 мг п/о 2 р/сут первые 3 дня, затем по 600 мг 2 р/сут п/о в течение 8 дней отмечена значимая положительная динамика на 7-е сутки лечения по лабораторным показателям, а также по параметрам системы оценки органной недостаточности пациента и по данным КТ.
Выбранная схема терапии показала эффективность в отношении множественно резистентной K. pneumoniae, а отключение от аппарата ИВЛ пациента произошло к 8-м суткам после начала терапии, что является значимо коротким сроком по нашему клиническому опыту с учетом всех исходных данных о состоянии пациента.
Заключение
Таким образом, нами был сделан вывод о возможности использования лекарственного препарата фтортиазинон при выявлении штаммов K. pneumoniae, для которых описана множественная резистентность. Мы получили убедительные данные о клинической эффективности данного препарата не только на уровне оценки лабораторно-инструментальных показателей, но и при оценке объективного статуса пациента по принятым в отделении интенсивной терапии шкалам. Использованный подход позволил добиться быстрого клинического улучшения, отключения от ИВЛ и избавления от антибиотикорезистентной К. pneumoniae в легких.
В описанном случае отражается возможность использования нового лекарственного препарата в ситуации, когда АБТ малоэффективна. Полученные результаты дают надежду на расширение показаний клинического применения, скорейшую регистрацию и возможность применения препарата для лечения ИВЛ-ассоциированных пневмоний, вызванных резистентными бактериями.
Сведения об авторах:
Мелконян Георгий Геннадьевич — д.м.н., профессор кафедры сочетанных и комбинированных повреждений ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; главный врач ГБУЗ «ГВВ № 3 ДЗМ»; 129336, Россия, г. Москва, ул. Стартовая, д. 4; ORCID iD 000-0001-7234-4185
Лыткина Каринэ Арнольдовна — к.м.н., заместитель главного врача по терапии ГБУЗ «ГВВ № 3 ДЗМ»; 129336, Россия, г. Москва, ул. Стартовая, д. 4; ORCID iD 0000-0001-9647-7492
Астаповский Александр Алексеевич — к.м.н., доцент кафедры клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; врач клинический фармаколог ГБУЗ «ГВВ № 3 ДЗМ»; 129336, Россия, г. Москва, ул. Стартовая, д. 4; ORCID iD 0000-0002-7430-3341
Ларин Егор Сергеевич — заместитель главного врача по анестезиологии и реаниматологии ГБУЗ «ГВВ № 3 ДЗМ»; 129336, Россия, г. Москва, ул. Стартовая, д. 4; ORCID iD 0000-0002-7450-6317
Двуреченский Алексей Борисович — заведующий отделением ОРИТ № 2 ГБУЗ «ГВВ № 3 ДЗМ»; 129336, Россия, г. Москва, ул. Стартовая, д. 4.
Трещенко Иван Андреевич — заведующий отделением ОРИТ № 1 ГБУЗ «ГВВ № 3 ДЗМ»; 129336, Россия, г. Москва, ул. Стартовая, д. 4.
Шарипов Александр Сергеевич — ординатор кафедры клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский Университет); 129336, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0009-6749-0722
Контактная информация: Астаповский Александр Алексеевич, e-mail: al.astapovskii@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 22.07.2025.
Поступила после рецензирования 14.08.2025.
Принята в печать 31.08.2025.
About the authors:
Georgy G. Melkonyan — Dr. Sc. (Med.), Professor of the Department of Concomitant and Combined Injuries, Russian Medical Academy of Continuous Professional Education; 2/1 build. 1, Barrikadnaya str., Moscow, 125993, Russian Federation; Chief Medical Officer of Hospital for War Veterans No. 3; 4, Startovaya str., Moscow, 129336, Russian Federation; ORCID iD 000-0001-7234-4185
Karine A. Lytkina — C. Sc. (Med.), Deputy Chief Medical Officer for Therapy, Hospital for War Veterans No. 3; 4, Startovaya str., Moscow, 129336, Russian Federation; ORCID iD 0000-0001-9647-7492
Alexander A. Astapovsky — C. Sc. (Med.), Associate Professor of the Department of Clinical Pharmacology and Propaedeutics of Internal Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; clinical pharmacologist, Hospital for War Veterans No. 3; 4, Startovaya str., Moscow, 129336, Russian Federation; ORCID iD 0000-0002-7430-3341
Egor S. Larin — Deputy Chief Medical Officer for Anesthesiology and Intensive Care, Hospital for War Veterans No. 3; 4, Startovaya str., Moscow, 129336, Russian Federation; ORCID iD 0000-0002-7450-6317
Alexey B. Dvurechensky — Head of the ICU Department No. 2, Hospital for War Veterans No. 3; 4, Startovaya str., Moscow, 129336, Russian Federeation.
Ivan A. Treshchenko — Head of the ICU Department No. 1, Hospital for War Veterans No. 3; 4, Startovaya str., Moscow, 129336, Russian Federation.
Alexander S. Sharipov — Resident Physician of the Department of Clinical Pharmacology and Propaedeutics of Internal Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0009-0009-6749-0722
Contact information: Alexander A. Astapovsky, e-mail: al.astapovskii@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 22.07.2025.
Revised 14.08.2025.
Accepted 31.08.2025.
1World Health Organization (WHO). Global Antimicrobial Resistance and Use Surveillance System (GLASS) Report 2021. Geneva: WHO; 2022. https://www.who.int/publications/i/item/9789240062702
2ClinicalTrials.gov. Study of fluorothiazinone in patients with pneumonia. Study No. NCT06135350. Available from: https://clinicaltrials.gov/study/NCT06135350?intr=fluorothiazinone&rank=2
Информация с rmj.ru





