Введение
Туберкулез — инфекционное заболевание, вызываемое инфекционным агентом Mycobacterium tuberculosis. Однако в некоторых случаях выявить возбудитель не представляется возможным. По данным С.А. Стерликова и соавт. [1], микробиологическое подтверждение туберкулеза регистрируется лишь в 56,1% случаев. В 43,9% случаев диагноз туберкулеза основывается на клинико-эпидемиологических данных и «характерной» лучевой картине [2]. При этом отсутствие патогномоничных признаков не позволяет уверенно дифференцировать туберкулез с другими заболеваниями легких, в том числе инфекционными. Особенно актуальным это становится при поражении легких малой распространенности.
Цель исследования: изучение клинико-эпидемиологических и лабораторных характеристик у пациентов с ограниченным поражением легочной ткани, наблюдавшихся в противотуберкулезных учреждениях.
Содержание статьи
Материал и методы
Проведено ретроспективное когортное исследование с анализом историй болезни пациентов старше 18 лет без ВИЧ-инфекции, наблюдавшихся в противотуберкулезных учреждениях РФ в 2020–2021 гг. По данным рентгенологического исследования у всех пациентов при первичном обращении к фтизиатру выявлено ограниченное поражение легочной ткани (1–2 сегмента с одной или двух сторон). Изучены истории болезни 190 больных, которые наблюдались в противотуберкулезном диспансере и получали химиотерапию (рифампицин, изониазид, пиразинамид, этамбутол). Через 2 мес. проведено контрольное обследование микробиологическими и лучевыми методами для оценки динамики специфического процесса. В основную группу (ОГ) включены пациенты (n=95) с туберкулезом легких, верифицированным по результатам микробиологических исследований (культуральные исследования с посевом на плотные/жидкие среды). В группу сравнения (ГС) вошли пациенты (n=95) с верифицированным диагнозом нетуберкулезной этиологии. Среди них регистрировались больные с онкологическими заболеваниями легких (n=51), саркоидозом (n=18), микобактериозом (n=8). У 18 человек регистрировались прочие заболевания (гамартома, пороки развития легочной ткани и т. д.), каждое — в 1 случае. У пациентов диагноз верифицирован гистоморфологическими (злокачественные новообразования легких, саркоидоз и др.) или микробиологическими (M. tuberculosis, M. nontuberculosis spp.) методами при исследовании респираторного материала, полученного при фибробронхоскопии (ФБС) с бронхоальвеолярным лаважем (БАЛ) и/или хирургической биопсии.
Проанализированы: жалобы, структурированные по принадлежности к синдрому интоксикации (снижение массы тела, утомляемость при выполнении повседневной нагрузки, повышение температуры и т. д.) и респираторному синдрому (кашель, его длительность, наличие одышки и т. д.); демографические и антропометрические параметры — пол, возраст, масса тела, рост с расчетом индекса массы тела. Учитывались: социальный статус; информация о пребывании в местах лишения свободы; наличие вредных привычек (курение, употребление алкоголя, психоактивных веществ) в настоящее время или давностью 12 мес.; трудоустройство у лиц трудоспособного возраста; метод выявления и принадлежность к группам риска (медицинской, социальной, фтизиатрической); наличие сопутствующей патологии в момент обращения или давностью 12 мес.; длительность настоящего заболевания до момента выявления и давность проведения флюорографического обследования; информация о проведении и результатах микробиологических и молекулярно-генетических обследований; проведение и результаты ФБС; оперативные вмешательства в прошлом; результаты клинических лабораторных исследований при первичном обращении и в динамике через 2–4 нед.
Статистическая обработка данных выполнена лицензионным программным обеспечением Statistica 6.0. В исследовании использовались два типа данных: дискретные (да/нет) и интервальные (количественные показатели). Дискретные данные анализировались с помощью таблиц сопряженности. Для оценки шансов обнаружить изучаемый фактор в обеих группах использован показатель отношения шансов (ОШ) с расчетом 95% доверительного интервала (ДИ). Интервальные показатели представлены средним значением (M) и стандартным отклонением для характеристики выборки (σ). Для их сравнения использовали t-критерий для независимых выборок с поправкой Ливиня, при этом рассчитывалась разность сравниваемых групповых средних с определением 95% ДИ. Если значимость t-критерия <0,05, а доверительные интервалы разности средних не содержали внутри себя 0, то гипотеза о равенстве отвергалась, и с достоверностью в 95% можно было утверждать, что исследуемые группы различались по величине оцениваемого явления [3].
Результаты и обсуждение
В ходе исследования отмечено, что пациенты ГС были старше, чем в ОГ (58,7±13,4 года против 48,2±14,8 года, t=5,621, 95% ДИ от -12,081 до -5,826, р=0,000). Этот факт согласуется с данными отчета о заболеваемости туберкулезом населения в РФ за 2022 г., где указано, что инфекция поражает преимущественно людей в трудоспособном возрасте [4]. В ОГ и ГС женщин было 50,5 и 39,0% соответственно, а мужчин — 49,5 и 61,0% соответственно (χ2=2,576, р=0,109, ОШ 0,625, 95% ДИ от 0,351 до 1,111). При этом соотношение между мужчинами и женщинами в ОГ составило 1:1, а в ГС — 1:0,6. То есть в ОГ туберкулез регистрировался одинаково часто у мужчин и женщин, что соответствует данным литературы [5]. В ГС преобладали мужчины (58 против 37 женщин, t=9,284, p=0,003). По данным литературы, мужчины болеют раком легких в 3–4 раза чаще, чем женщины [6, 7].
Туберкулез может развиваться как по экзогенному (после контакта с источником инфекции), так и по эндогенному (за счет активации дремлющих микобактерий) сценарию. Таким образом, при контакте с больным туберкулезом и положительных кожных тестах риск выявления у пациента этой инфекции повышается[1], но любые симптомы, подозрительные на заболевание, требуют проведения комплекса исследований для его верификации[2]. В настоящем исследовании контакты с источником инфекции установлены в обеих группах с одинаковой частотой (по 9,5 и 11,6% случаев в ОГ и ГС соответственно (ОШ 0,799, 95% ДИ от 0,315 до 2,027, p>0,05)), что свидетельствовало о возможности развития заболевания нетуберкулезной этиологии у пациентов из очага туберкулезной инфекции. Эндогенный сценарий развития событий возможен у лиц, инфицированных M. tuberculosis, что характеризуется наличием иммунного ответа на антигены ESAT-6, CFP-10 и проявляется положительными иммунологическими тестами (проба с аллергеном туберкулезным рекомбинантным). Кожный тест с аллергеном туберкулезным рекомбинантным к этим антигенам проведен у 53 пациентов ОГ и 68 пациентов ГС, из них положительные результаты отмечены у 29 в ОГ и у 47 в ГС (ОШ 0,540, 95% ДИ от 0,256 до 1,139). Размеры папулы у пациентов обеих групп были сопоставимы (14,2±6,1 мм в ОГ и 15,2±7,9 мм в ГС, p>0,05). Отрицательный результат кожного теста зарегистрирован в ОГ у 24 из 53 пациентов и в ГС у 21 из 68 (ОШ 1,852, 95% ДИ от 0,878 до 3,907). То есть у инфицированных M. tuberculosis возможно развитие заболеваний нетуберкулезной этиологии, несмотря на высокий риск туберкулеза. По данным литературы, положительные иммунологические тесты были поводом для обращения к фтизиатру для углубленного обследования [4] и могли свидетельствовать о латентной туберкулезной инфекции, но не свидетельствовали об активном процессе [8, 9].
Наряду с вышеперечисленными критериями, повышающими риск выявления туберкулеза, существует социальная группа риска [10]. К этой группе принадлежат лица из мест лишения свободы, жители и сотрудники закрытых (в том числе социальных) учреждений [11]. В ходе исследования принадлежность к социальной группе риска по заболеванию туберкулезом установлена у 7 (7,4%) пациентов ГС и 18 (18,9%) пациентов ОГ (χ2=5,573, р=0,019). То есть среди пациентов ОГ лица из группы риска встречались в 2,9 раза реже (ОШ 0,340, 95% ДИ от 0,135 до 0,858). В ОГ пациенты из медицинской группы риска по туберкулезу[3]
[11] составили 25,3%, а в ГС — 15,8% (ОШ 1,803, 95% ДИ от 0,878 до 3,704, p>0,05), что свидетельствовало о возможности выявить туберкулез и нетуберкулезные заболевания у пациентов с иммунокомпрометированными заболеваниями.
Согласно приказу[4] [12] лучевые методы исследования проводятся с целью своевременного выявления туберкулеза до момента, когда пациент станет бактериовыделителем, предотвращая распространение инфекции в обществе. То есть профилактические мероприятия направлены на выявление пациентов с инапперцептным течением и ограниченным (в пределах 1–2 сегментов одной или двух сторон) поражением легких[5]
[12, 13]. В ходе исследования выявление таких пациентов происходило при профилактическом осмотре — в ОГ в 74,7%, в ГС в 64,2% случаев, а при обращении с жалобами — в 25,3 и 35,8% соответственно (χ2=2,482, р=0,116). По данным литературы, выявление туберкулеза при наличии жалоб происходит в 58,5% случаев [14]. Таким образом, в ходе исследования выявление заболеваний при профилактическом обследовании позволяет своевременно их диагностировать, но создает трудности в верификации процесса.
Среди жалоб, подозрительных на туберкулез, выделяют кашель, кровохарканье, боль в грудной клетке, повышение температуры тела и снижение массы тела [2, 10, 12]. В ходе исследования при первичном обращении пациенты предъявляли жалобы респираторного и интоксикационного характера (табл. 1).

По данным таблицы 1, кашель, кровохарканье и одышка чаще встречались в ГС. Однако статистически значимые различия между группами зафиксированы только по преобладанию кашля и одышки. Риск встретить пациента с одышкой в ОГ был в 20 раз ниже, чем в ГС (ОШ 0,052, 95% ДИ от 0,007 до 0,400). Симптомы, характеризующие синдром интоксикации, отмечались с одинаковой частотой в обеих группах.
При оценке такого фактора риска, как курение, в ОГ выявлено 4 случая, в ГС — 12 (ОШ 0,304, 95% ДИ от 0,094 до 0,980). Курение при раке легкого давно является общепризнанным фактором риска, однако, как показывают исследования, табакокурение увеличивает риск развития специфического процесса более чем в 15 раз [15, 16].
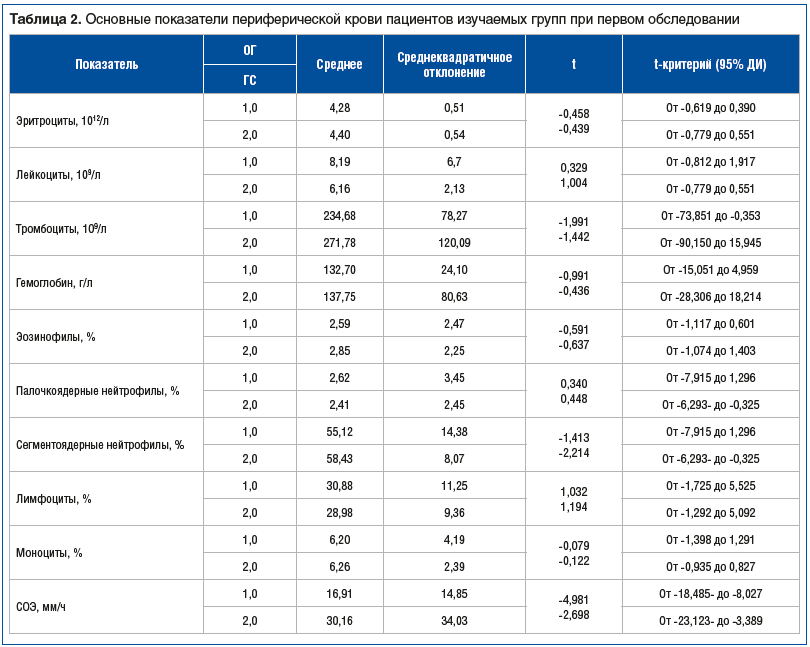
Косвенным показателем, отражающим наличие специфического процесса, являются параметры периферической крови (табл. 2). Выявлено отсутствие статистически значимых различий между группами по всем изучаемым параметрам крови, за исключением скорости оседания эритроцитов (СОЭ). При проведении проверки гипотезы о неравенстве средних при помощи непараметрических критериев выявлено статистически значимое увеличение СОЭ у пациентов ГС (р=0,000). В исследовании Y.H. Zhang et al. [17] у больных раком легкого и хроническими заболеваниями легких убедительно доказано увеличение СОЭ и уровня С-реактивного белка, что подтверждает результаты настоящего исследования.
Этиологическая диагностика при проведении микроскопического и культурального методов выявления M. tuberculosis не позволила верифицировать возбудителей в мокроте у пациентов обеих групп. При культуральном исследовании другого респираторного материала (БАЛ, биоптат, операционная ткань), полученного от пациентов ОГ, диагноз был верифицирован, тогда как в ГС посевы были отрицательными. При молекулярно-генетическом исследовании мокроты ДНК M. tuberculosis обнаружена у 13 (13,7%) человек в ОГ и 6 (6,3%) в ГС (χ2=2,865, р=0,091), т. е. статистически значимые различия отсутствовали.
Заключение
В ходе исследования установлено преобладание пациентов трудоспособного возраста без гендерных отличий среди больных туберкулезом и увеличение среднего возраста у пациентов ГС, где преобладали мужчины. Патогномоничные для туберкулеза жалобы, контакт с больным туберкулезом и даже обнаружение ДНК M. tuberculosis встречались одинаково часто у пациентов обеих групп. Следует отметить, что ДНК M. tuberculosis может быть обнаружена при отсутствии живого активно метаболизирующего возбудителя и не свидетельствует о бактериовыделении, что может встречаться, например, при раке легкого. В данной ситуации часто ошибочно устанавливается диагноз туберкулеза легких. Однако отрицательная рентгенологическая динамика на фоне приема противотуберкулезной терапии, отрицательные результаты микроскопии, отсутствие роста M. tuberculosis на жидких и плотных питательных средах ставят под сомнение диагноз и подталкивают врача вернуться к диагностическим мероприятиям. Этот факт должен подтверждаться или опровергаться путем исследования другого респираторного материала и другими методами. В то же время одышка и увеличение СОЭ существенно чаще встречались у пациентов ГС. Учитывая, что признаки, наиболее подозрительные для туберкулеза, отмечались с разной частотой в группах, необходима диагностическая модель, основанная на математических методах и позволяющая исключить человеческий фактор при интерпретации полученной о пациенте информации.
[1] Обновленное сводное руководство по программному ведению случаев латентной туберкулезной инфекции. Всемирная организация здравоохранения. Женева; 2018.
[2] Приказ Министерства здравоохранения РФ от 2103.2017 № 124н «Об утверждении порядка и сроков проведения профилактических медицинских осмотров граждан в целях выявления туберкулеза». (Электронный ресурс.) URL: https://base.garant.ru/71688450/ (дата обращения: 15.01.2025).
[3] Приказ Министерства здравоохранения РФ от 21.03.2003 № 109 (ред. от 05.06.2017) «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». (Электронный ресурс.) URL: https://base.garant.ru/4179360/ (дата обращения: 15.01.2025).
[4] Приказ Министерства здравоохранения РФ от 15.11.2012 № 932н «Об утверждении Порядка оказания медицинской помощи больным туберкулезом». (Электронный ресурс.) URL: https://docs.cntd.ru/document/902392047 (дата обращения: 15.01.2025).
[5] Клинические рекомендации «Туберкулез у взрослых», 2022 г. (Электронный ресурс.) URL: https://login.consultant.ru/link/?req=doc&base=LAW&n=476489&dst=1000000001&demo=1 (дата обращения: 15.01.2025).
Информация с rmj.ru




