Введение
Первичная открытоугольная глаукома (ПОУГ) — хроническое медленно прогрессирующее заболевание, требующее постоянного ежедневного лечения1 [1]. Длительное лечение хронических заболеваний имеет целый ряд особенностей: терапия должна быть эффективной и безопасной, не должна вызывать привыкания при длительном применении.
Согласно законам фармакодинамики при неоднократном использовании лекарственного средства развивается толерантность — снижение реакции организма на получаемый (вводимый) препарат [2]. Эффективность лекарственного средства зависит от его возможности связываться с рецептором, концентрации в области рецептора и пострецепторных химических взаимодействий. Со временем фармакодинамика препарата может меняться под влиянием целого ряда факторов: нарушение питания (особенно дефицит белка), наличие различных хронических системных заболеваний (например, сахарный диабет при суб- и декомпенсированном течении), полипрагмазия и нарастающие инволютивные процессы и др. Эти состояния могут менять качество взаимодействия лекарственного средства с рецепторами, влиять на концентрацию связывающих белков и снижать чувствительность рецепторов. Возрастные изменения снижают фармакодинамический ответ за счет изменения пострецепторных путей передачи. Межлекарственные взаимодействия при полипрагмазии реализуются путем конкуренции за связывание с рецептором [3].
Гипотензивные препараты, используемые при лечении пациентов с глаукомой, предположительно имеют разную способность вызывать привыкание. Например, β-адреноблокаторы (БАБ) длительное время были препаратами первого выбора, а частота их назначений в России до сих пор составляет 50–60% [4–6]. Использование БАБ в монотерапии при лечении пациентов с ПОУГ приводит к желаемому гипотензивному эффекту примерно в половине случаев. По данным ряда исследований [7, 8], препараты этой группы сохраняют свою эффективность в течение 1,2–2,8 года даже при назначении их в составе комбинированной терапии. Такой непродолжительный эффект, возможно, связан с широкой распространенностью препаратов этой группы в практике как офтальмологов, так и врачей-терапевтов и врачей общей практики.
Современные антиглаукомные препараты сохраняют свою гипотензивную эффективность на протяжении ограниченного времени, особенно при монотерапевтическом подходе. Так, А.В. Куроедов и соавт. [9] приводят данные о том, что спустя 2 года в 75% случаев пациент нуждается в двух и более противоглаукомных препаратах.
Смена терапии при инстилляциях адреномиметиков (АМ) и местных ингибиторов карбоангидразы (ИКА) регистрировалась на 51,9% чаще, чем при лечении препаратами других лекарственных классов [10].
Сама стадия глаукомного процесса (текущее состояние пациента) может оказывать существенное влияние на длительность использования гипотензивного режима. Более тяжелые стадии заболевания стабилизировать на долгий срок удается редко [11].
При длительной терапии от лечащего врача требуется особая внимательность к признакам развивающихся со временем нарушений толерантности. К ним следует отнести, во-первых, минимальные изменения уровня офтальмотонуса (его суточные флюктации, пики — максимальные и минимальные значения, продолжительность «плато»), что в современной клинической практике может быть обнаружено при продолжительном мониторинге с использованием неинвазивных технологий (например, транспальпебральная тонометрия прибором «Тонотест ПРО» производства компании «Еламед», Россия).
Кроме этого, необходимо помнить, что оценка морфофункциональных изменений также обязательна, как и контроль уровня ВГД. Важно отслеживать признаки прогрессирования глаукомной оптиконейропатии (ГОН) для принятия решения о смене тактики лечения.
Доказано, что при открытоугольной глаукоме отсутствуют яркие клинические проявления и болевые ощущения, что значительно снижает мотивацию к лечению. По данным Всемирной организации здравоохранения, заинтересованность в лечении при долгосрочной терапии сохраняют не более 50% пациентов [12]. S. Frech et al. [13] определили, что в каждый следующий год болезни уровень приверженности снижается на 20–30%. Позже учеными группы «Научный авангард» [14] было опубликовано аналитическое многоцентровое исследование по результатам анкетирования 616 пациентов с различной продолжительностью заболевания. Исследование показало, что группу риска несоблюдения рекомендаций составляют пациенты с более длительным сроком заболевания. Судя по ответам самих пациентов, соблюдение высокой приверженности назначенному лечению в течение более 200 дней свойственно лишь 1,2% лиц [14]. О влиянии местного раздражающего действия гипотензивных препаратов на длительность и эффективность лечения указывают В.В. Нероев и соавт. [15].
Толерантность к лечению такого хронического прогредиентного заболевания, как глаукома, становится дополнительным фактором риска прогрессирования болезни.
Цель исследования: изучение клинических проявлений нарушения толерантности к лечению у пациентов с ПОУГ при разной длительности заболевания, сроках и режимах лечения.
Содержание статьи
Материал и методы
Комбинированное (поперечное) многоцентровое ретроспективное когортное научно-клиническое исследование было проведено в период с 1 февраля по 1 июля 2022 г. В базу данных были включены результаты наблюдения за 115 пациентами (60 (52,2%) мужчин) с верифицированным диагнозом ПОУГ.
В 1-ю группу включили 49 пациентов, болеющих глаукомой не более 1 года с момента установления диагноза, — в среднем 0,72 [0,32; 0,92] года. Во 2-ю группу вошли 66 пациентов со стажем заболевания от момента верификации диагноза от 1 года до 4 лет — в среднем 2,7 [1,9; 3,8] года. Участие пациентов в исследовании было подтверждено их письменным согласием. Во всех случаях диагноз был установлен и подтвержден специальными методами исследования. На момент включения в исследование проводилась повторная документальная верификация стадии заболевания согласно действующей классификации глаукомы. Всем пациентам выполнялась тонометрия (по Маклакову, грузом 10 г). Показатель тонометрического уровня ВГД (Pt) оценивали при постановке диагноза глаукомы, на промежуточных этапах, в том числе при смене режима лечения, и в конце исследования. Изучали морфометрические и функциональные показатели: максимальную корригируемую остроту зрения (МКОЗ), толщину слоя нервных волокон сетчатки, периметрические индексы — среднюю светочувствительность сетчатки (mean deviation, MD) и ее стандартное отклонение (pattern standart deviation, PSD), толщину роговицы в центральной оптической зоне (ЦТР). Статическую автоматизированную периметрию (САП) выполняли на компьютерных периметрах Humphrey 740i и 750i (Carl Zeiss Meditec Inc., США, программа SITA Threshold 30-2) и Octopus 900 (Haag-Streit, Switzerland, программа 32, G1), оптическую когерентную томографию — на оптических томографах Cirrus HD-OCT (Carl Zeiss Meditec Inc., США).
Анализировали медицинскую документацию, режимы терапии. Измерения уровня офтальмотонуса на момент включения в исследование проводились в интервале от 09:00 до 12:00. Степень компенсации уровня ВГД оценивали согласно официальным рекомендациям Российского глаукомного общества (РГО, 2019) об оптимальных характеристиках верхних границ офтальмотонуса у пациентов с глаукомой на фоне лечения [1]. При финальном исследовании проводили опрос пациентов по анкете TSS-IOP. Анализ информации о субъективной удовлетворенности пациентов лечением осуществляли после обработки результатов исследований, что не противоречит международным этическим руководящим принципам исследований в области здоровья с участием людей (https://clinicaltrials.gov/).
Критерии включения: европеоидная раса, пациенты с развитой и далеко зашедшей стадиями ПОУГ с длительностью заболевания не более 4 лет на момент финального осмотра; возраст от 40 до 89 лет; клиническая рефракция ±6,0 дптр и астигматизм степенью до ±3,0 дптр. На момент финального обследования пациенты могли получать любую медикаментозную гипотензивную терапию.
Критерии исключения: глаукома низкого давления, пигментная глаукома и синдром пигментной дисперсии, любые антиглаукомные операции в анамнезе, выраженные помутнения оптических сред, затрудняющие использование морфометрических или периметрических методов исследования или приводящие к неправильной трактовке их результатов; возрастная макулодистрофия, постокклюзионная и диабетическая ретинопатия; травмы и заболевания органа зрения в анамнезе, затрудняющие проведение тонометрии; интракапсулярная экстракция катаракты, экстракапсулярная экстракция катаракты или факоэмульсификация с осложнениями (например, с частичной потерей стекловидного тела); отслойки сетчатки; системные заболевания, требующие гормональной терапии.
Данные обследования собраны в единую базу в адаптированном электронном виде на персонализированном облачном сервисе Google Docs с использованием лицензированного сервиса Microsoft Windows (США). Обработка полученных данных проводилась с использованием программы Statistica (версия 10,0, StatSoft Inc., США). Все исследуемые параметры представлены в формате Мe [Q1; Q3], где Мe — медиана, а Q1 и Q3 — 1-й и 3-й квартили. Для попарного сравнения двух независимых выборок использовали U-критерий Манна — Уитни, для внутригрупповых сравнений — T-критерий Уилкоксона. Статистическую значимость различий двух или нескольких относительных показателей (частот, долей) оценивали с использованием критерия согласия Пирсона. Критический уровень значимости при проверке статистических гипотез принимался <0,05.
Результаты и обсуждение
Средний возраст пациентов на момент диагностирования глаукомы (все стадии, без деления на гендерные подгруппы) составил 67,6 [60,1; 72,2] года для 1-й группы и 66,5 [60,2; 72,0] года — для 2-й, к окончанию исследования — 68,4 [61,1; 72,9] и 69,4 [63,4; 75,1] года соответственно. Разница в возрасте в начале и конце исследования была статистически значимой (p<0,05) для каждой из групп, что закономерно и связано с формированием групп по длительности заболевания. В свою очередь, статистически значимой разницы в возрасте между группами не выявлено как на момент диагностирования заболевания (р=0,93), так и на момент финального обследования (р=0,12).
В задачи исследования входило изучить эффективность самых распространенных схем лечения пациентов с ПОУГ. С этой целью оценивали динамику тонометрических и функциональных показателей. В таблице 1 представлены данные периметрических индексов, МКОЗ и уровня ВГД на момент диагностирования болезни и при финальном обследовании.
Уровень ВГД на момент диагностики ПОУГ составлял 27 [25; 30] мм рт. ст. для пациентов 1-й группы и 28 [26; 30] мм рт. ст. — 2-й группы. На фоне проводимого лечения офтальмотонус достоверно снижался и к финальному обследованию составлял 19 [18; 21] мм рт. cт. у лиц 1-й группы и 19 [16; 20] мм рт. ст. у пациентов 2-й группы, что свидетельствует о хорошем гипотензивном эффекте используемой местной медикаментозной терапии.
Вместе с тем, несмотря на, казалось бы, достаточное понижение уровня ВГД на фоне проводимого лечения, показатели периметрических индексов в обеих группах пациентов прогрессивно снижались. Показатель MD в 1-й группе уменьшился с -7,21 [-9,34; -4,97] до -7,37 [-12,06; -5,18] dB, а во 2-й — с -7,95 [-11,32; -6,26] до -9,94 [-15,64; -7,97] dB. Отрицательная динамика для обеих групп была статистически значимой, что говорит о недостаточном снижении уровня ВГД для стабилизации ГОН, несвоевременной смене гипотензивной терапии и указывает на характерный прогредиентный характер течения заболевания.
Несмотря на изменения периметрических показателей, МКОЗ ухудшалась только при длительности заболевания более 1 года, что подтверждает значимость периметрии для оценки стабилизации глаукомного процесса и необходимость выполнения этого исследования при ведении пациентов с глаукомой (см. табл. 1).
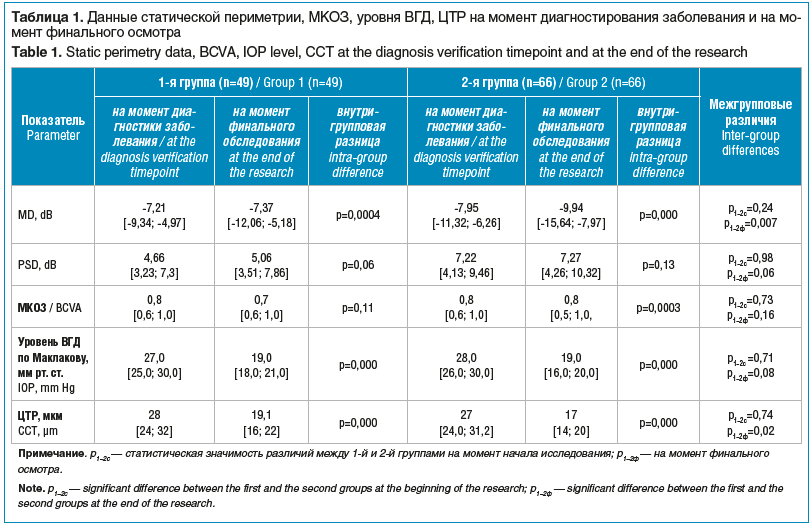
Толщина роговицы в центральной оптической зоне составила 542 [520; 560] мкм для 1-й группы и 541 [523; 559] мкм — для 2-й. Статистически значимой разницы между группами не наблюдалось. Полученные результаты соответствуют средним значениям этого параметра в популяции [16].
Наше исследование показало, что за время наблюдения пациенты исследуемых групп успевали поменять от одного до пяти режимов терапии. Начало лечения во всех случаях было связано с высоким уровнем ВГД, составившим 27 [25; 30,0] и 28 [26; 30] мм рт. ст. соответственно. Смена гипотензивной терапии в дальнейшем происходила, по-видимому, из-за несоответствия офтальмотонуса его требуемым индивидуальным значениям. Переход на 2-й и 3-й режимы осуществлялся при уровне ВГД 20 [18; 22] мм рт. ст. в 1-й группе и при 20 [18; 22] мм рт. ст. — во 2-й. Возможно, врачи принимали решение о смене режима, опираясь на морфометрические данные и признаки ухудшения структурных изменений. Согласно данным ранее проведенного исследования [17] уровень ВГД 20 мм рт. ст. для большинства врачей является критерием «спокойствия» (табл. 2).
![Таблица 2. Уровень ВГД (мм рт. ст.) по Маклакову на мо- мент смены режима местной гипотензивной терапии, Мe [Q1; Q3] Table 2. IOP at the medical regimen (local hypotensive therapy) change timepoint, mm Hg, Me [Q1; Q3] Таблица 2. Уровень ВГД (мм рт. ст.) по Маклакову на мо- мент смены режима местной гипотензивной терапии, Мe [Q1; Q3] Table 2. IOP at the medical regimen (local hypotensive therapy) change timepoint, mm Hg, Me [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/01/1737260630_809_Klinicheskie-proyavleniya-narusheniya-tolerantnosti-k-lecheniyu-u-patsientov-s-pervichnoj.png)
Усиление гипотензивной терапии понадобилось уже в течение первого года заболевания 79,6% пациентов, а 26,5% пациентов из 1-й группы и 31,8% пациентов из 2-й группы нуждались в трех сменах режима.
В группе со стажем заболевания менее 1 года был только 1 пациент со стойким повышением уровня ВГД (29 мм рт. ст.), сохранявшимся, несмотря на 4 смены схем лечения. В группе со стажем заболевания от 1 года до 4 лет в 2 случаях сохранялся высокий уровень ВГД. Режим лечения этим пациентам меняли 5 раз. Такая тактика может быть связана с невозможностью по каким-то причинам выполнить хирургическое вмешательство. Возможно, приверженность лечению была низкой, и давление, независимо от режима терапии, не компенсировалось. Необходимость многократно менять схемы лечения также может указывать на развивающуюся толерантность. Стоит отметить, что стаж глаукомы прямо пропорционально соотносился с количеством сменяемых режимов терапии. Вместе с тем при добавлении к ранее применявшемуся режиму лечения нового компонента достоверного снижения уровня ВГД и ожидаемого суммирования лечебного эффекта не происходило.
Анализ частоты смены режимов терапии и длительности интервалов между ними показал, что в обеих исследуемых группах сроки изменений тактики совпадали (табл. 3).
![Таблица 3. Длительность интервалов (годы) между сменами режимов лечения, Мe [Q1; Q3] Table 3. Duration of the regimen, years, Mе [Q1; Q3] Таблица 3. Длительность интервалов (годы) между сменами режимов лечения, Мe [Q1; Q3] Table 3. Duration of the regimen, years, Mе [Q1; Q3]](https://medblog.su/wp-content/uploads/2025/01/1737260630_160_Klinicheskie-proyavleniya-narusheniya-tolerantnosti-k-lecheniyu-u-patsientov-s-pervichnoj.png)
Таким образом, продолжительность периода лечения, которое врач считал эффективным, не зависела от стажа заболевания. Сроки смены схемы лечения скорее совпадали с регламентом проведения морфометрических исследований при динамическом наблюдении за больными ПОУГ. Клинические рекомендации диктуют выполнение САП и оптической когерентной томографии с интервалом в 3–6 мес.1, однако на практике частота анализа морфофункциональных показателей проводится в 2 раза реже (см. табл. 3).
Из таблицы 3 видно, что в группе со стажем заболевания менее 1 года у абсолютного большинства пациентов возникла необходимость заменить или усилить гипотензивную терапию уже через полгода от начала лечения. Рисунок иллюстрирует режимы терапии на момент начала лечения и на момент финального осмотра для 1-й и 2-й групп соответственно.
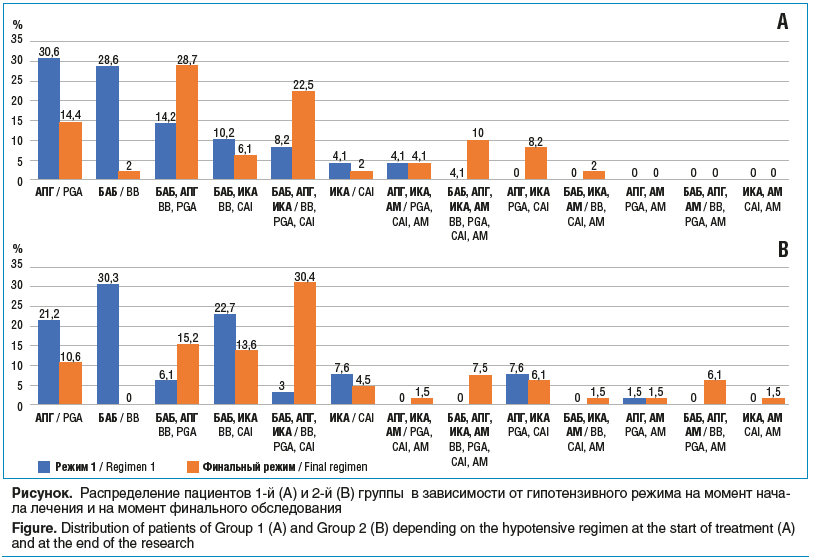
Врачи принимали решение о старте терапии с БАБ примерно в 30% случаев в обеих группах, такая монотерапия показала себя как самая неэффективная из всех используемых схем лечения. В 1-й группе со стажем заболевания до 1 года лишь 2% пациентов продолжали лечение с применением БАБ в виде монотерапии к концу наблюдения, а во 2-й группе — ни одного. Из результатов исследования, приведенных на рисунке, можно сделать вывод, что БАБ обладают самой высокой способностью вызывать нарушение толерантности. Монотерапия АПГ назначалась на старте лечения также в 30% случаев в 1-й группе и в 21,2% — во 2-й. К концу исследования половина от начавших лечение АПГ продолжали его в обеих группах (14,4% в 1-й группе и 10,6% — во 2-й). Таким образом, АПГ, по-видимому, вызывают нарушение толерантности в значительно меньшей степени. Старт терапии с фиксированных комбинаций осуществлялся в 14% случаев в 1-й группе и только в 6,1% — во 2-й. На момент финального обследования комбинированную терапию АПГ и БАБ использовали 28,7% пациентов 1-й группы и 15,2% — 2-й. Наибольшую продолжительность эффективного гипотензивного воздействия показала максимальная медикаментозная терапия (ММТ): БАБ/АПГ/ИКА, АПГ/ИКА/АМ, БАБ/АПГ/ИКА/АМ. Это подтверждает необходимость начинать лечение развитой и далеко зашедшей глаукомы с использования фиксированных комбинаций и ММТ, так как потребность в них возрастает у пациентов в 1-й и 2-й группе в 2 и 3 раза соответственно. К концу наблюдения каждый третий пациент нуждался в терапии тремя препаратами, каждый десятый получал 4 препарата (см. рисунок).
Таким образом, наше исследование показало, что нарушение толерантности к используемому лечению при ПОУГ развивается у большого количества пациентов и зависит от выбора препарата и стратегии лечения. Судя по частоте смены режимов и непродолжительности периодов новых назначений, врачи зачастую не удовлетворены эффективностью существующей медикаментозной терапии.
Получают ли пациенты удовлетворение от своего лечения и дает ли оно ощущение безопасности за свое здоровье и зрение? Об этом мы могли судить по результатам применения специального опросника TSS-IOP [18]. Анкета оценивает не только удовлетворенность пациентов самой медикаментозной терапией, но и качество жизни при необходимости соблюдать тот или иной режим лечения. Также в опроснике учитывалось отношение пациентов к возможным побочным проявлениям препаратов (табл. 4).
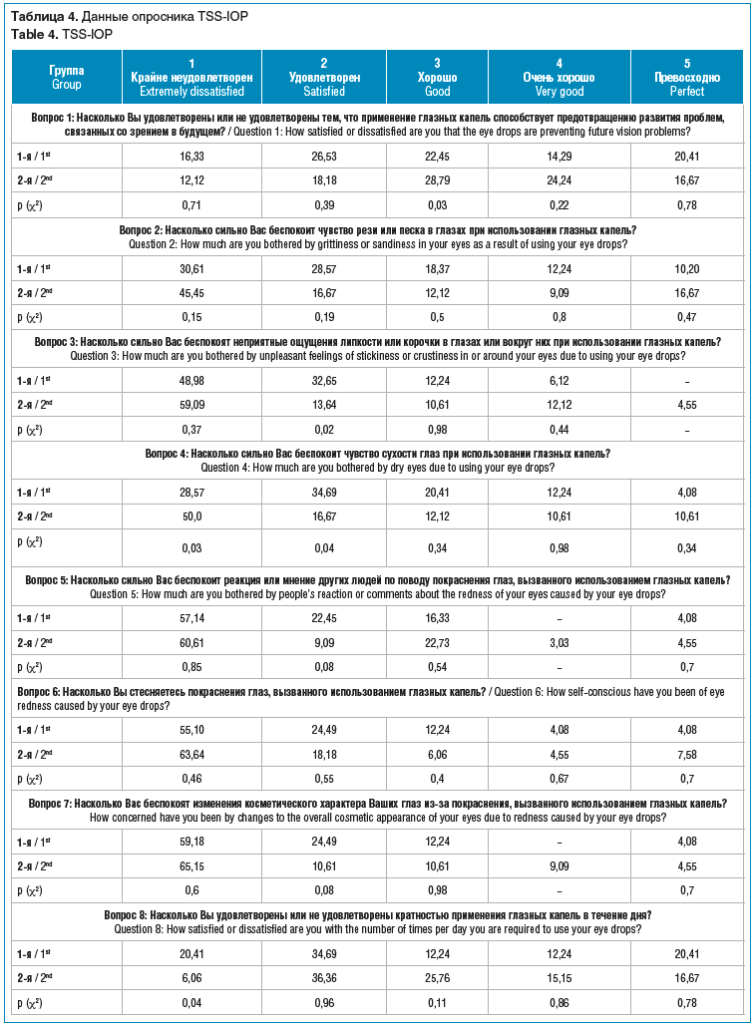
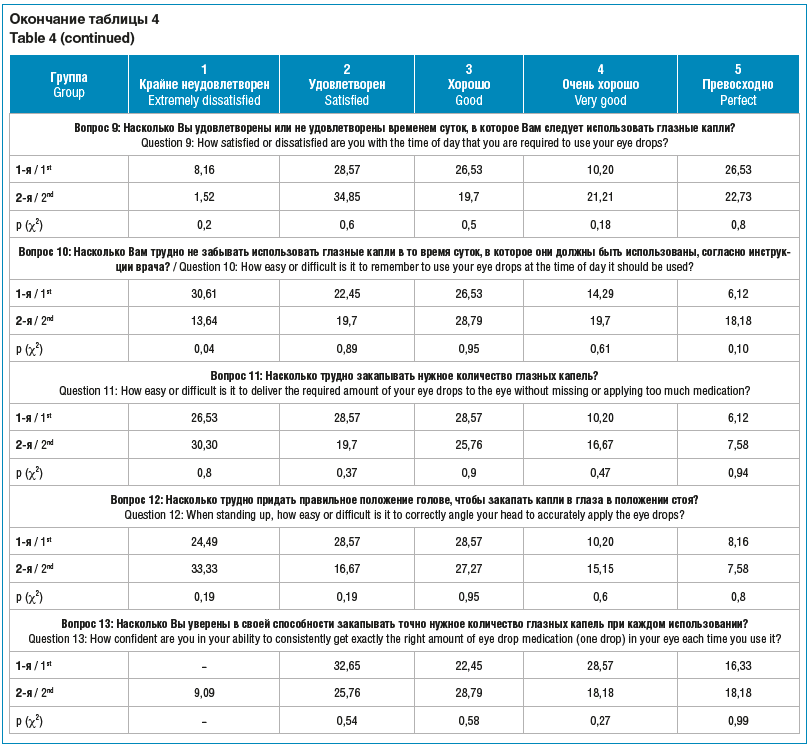
Анкетирование показало, что большая часть пациентов из обеих групп с оптимизмом смотрит в будущее. Так, 57% опрашиваемых из 1-й группы и 70% из 2-й группы считают, что применение глазных капель способствует предотвращению развития проблем, связанных со зрением. Этот результат оказался для нас неожиданным. Возможно, такой настрой пациентов связан с фокусом внимания лишь на показателях офтальмотонуса и хорошим гипотензивным эффектом терапии. Косвенно такие показатели могут говорить о грамотной коммуникации врача и пациента, умении убедить в необходимости и целесообразности лечения. Скорее всего, на результат повлияло то, что добровольное анкетирование выполнялось положительно настроенными пациентами с высоким уровнем доверия доктору.
Способность пациента сохранять приверженность лечению зависит во многом от побочных эффектов местной медикаментозной терапии. По результатам нашего исследования, крайне не удовлетворены чувством песка и рези при закапывании капель 30,6% пациентов из 1-й группы и 45,4% из 2-й группы. Ощущение липкости и корочек после инстилляций сильно беспокоит 48,9% пациентов в 1-й группе и 59,1% — во 2-й. Ощущение сухости глаз нарастает по мере увеличения стажа ПОУГ. При длительности заболевания менее 1 года выраженное беспокойство из-за сухости отмечают около трети (28,6%) пациентов, а в группе со стажем болезни от 1 года до 4 лет этот показатель вырастает до 50%. Полученные данные подтверждают ранее доказанную связь между возникающими ксеротическими и токсико-аллергическими изменениями глазной поверхности и длительностью местной гипотензивной терапии [19]. Гиперемия конъюнктивы, вызванная местным раздражающим и провоспалительным действием гипотензивных препаратов, вызывает крайнюю неудовлетворенность лечением более чем в 60% случаев. Пациентов беспокоит, что другие люди думают о покраснении их глаз, при этом только 4% опрошенных из обеих групп отметили, что равнодушны к мнению окружающих. Кратностью применения глазных капель в течение дня вполне удовлетворены 44% респондентов в 1-й группе и 57% — во 2-й, что, возможно, связано с применением фиксированных комбинаций антиглаукомных препаратов. Соблюдать рекомендации врача о времени суток инстилляций считают для себя сложным больше трети пациентов в обеих группах (36,7 и 36,4%). В группе с продолжительностью заболевания до 1 года 53% респондентов признают, что регулярно забывают выполнять назначения в оговоренное время. По мере увеличения стажа заболевания количество несоблюдающих эти назначения пациентов становится меньше (33,3%). Видимо, первый год болезни надо рассматривать как период адаптации к необходимости лечения и формирования новых привычек. О значительных трудностях с закапыванием нужного количества капель сообщают 26,5 и 30,3% опрошенных в 1-й и 2-й группе соответственно. Однако, несмотря на проблемы с инстилляциями, большинство опрашиваемых уверены, что все делают правильно (67,3% в 1-й группе и 65,1% во 2-й).
Ограничения исследования связаны с тем, что в ходе анализа изучены морфометрические показатели на момент начала лечения и на момент финального осмотра, в то время как данные на момент смены режима лечения не учитывались. При неудовлетворенности пациента режимом местной медикаментозной терапии не учитывалась кратность инстилляций.
Заключение
Исследование показало, что нарушение толерантности к лечению при ПОУГ развивается у большого количества пациентов и в довольно ранние сроки. Монотерапия, назначенная при выявлении заболевания, становится неэффективной у 79,6% пациентов в течение первого года заболевания. По-видимому, классический последовательный подход к гипотензивному лечению глаукомы — не самая удачная стратегия в реальной клинической практике при развернутой и далеко зашедшей стадиях. Результаты исследования подтверждают необходимость начинать лечение с максимально эффективного препарата или их комбинации (фактически речь идет о персонализации лечения).
Толерантность к БАБ формируется, по нашим данным, уже через 6 мес. от начала лечения. В группе со стажем заболевания до 1 года лишь 2% пациентов продолжали лечение БАБ к концу наблюдения, а в группе со стажем глаукомы до 4 лет — ни одного. Важно отметить, что привыкание к БАБ сохраняется и при использовании их в комбинациях с другими препаратами. При добавлении к ранее существовавшему режиму лечения нового компонента достоверного снижения уровня ВГД и ожидаемого суммирования лечебного эффекта не происходит. Полученные результаты подтверждают необходимость соблюдения рекомендаций заменять предыдущий неэффективный препарат, а не добавлять к нему новый.
Агонисты простагландинов вызывают толерантность в меньшей степени, но говорить о полном отсутствии привыкания к препаратам этой группы было бы неправильно. В нашем исследовании только половина от начавших лечение с применением АПГ продолжали его. При длительной терапии препаратами этой группы целесообразно переходить на лекарственные средства, действующие на другие рецепторы, например, простамиды или ИКА.
Стаж глаукомы коррелирует с количеством меняемых режимов терапии. Длительный поиск эффективного лечения приводит к потере времени и зрительных функций. В лечении пациентов с развитой и далеко зашедшей стадиями рекомендуется начинать лечение с ММТ. При неэффективности консервативного лечения в течение 3–6 мес. необходима смена тактики и переход к хирургическим методам лечения.
Длительная терапия такого хронического заболевания, как ПОУГ, требует от лечащего врача особой внимательности к признакам развивающейся со временем толерантности. Относительная компенсация офтальмотонуса порой усыпляет бдительность доктора. Необходимо помнить, что оценка морфофункциональных изменений так же обязательна, как контроль уровня ВГД и отслеживание признаков нарастающих явлений ГОН, для принятия решения о смене тактики лечения.
В ходе исследования установлено, что пациенты с длительным стажем глаукомы были более привержены терапии. Возможно, первый год болезни надо рассматривать как период адаптации к необходимости лечения и формирования новых привычек. Развитию толерантности со стороны пациента могут способствовать нарастающие со временем признаки синдрома «сухого глаза». Однако большая часть пациентов уверена, что применение глазных капель препятствует развитию проблем, связанных со зрением. Выдерживать испытание временем при лечении глаукомы приходится и лекарственному средству, и врачу, и пациенту.
Сведения об авторах:
Корелина Виктория Евгеньевна — к.м.н., доцент кафедры семейной медицины ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0003-2022-5912
Нагорнова Зоя Михайловна — к.м.н., доцент кафедры оториноларингологии и офтальмологии, ФГБОУ ВО Ивановский ГМУ Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; ORCID iD 0000-0002-3821-689X
Булах Илья Алексеевич — врач-офтальмолог, ООО Медицинский центр «Ивастрамед»; 153000, Россия, г. Иваново, ул. Рабфаковская, д. 30; ORCID iD 0000-0003-2348-4880
Куроедов Александр Владимирович — д.м.н., и.о. заведующего кафедрой офтальмологии лечебного факультета им. акад. А.П. Нестерова ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; начальник офтальмологического центра (с дневным стационаром) ФКУ «ЦВКГ им. П.В. Мандрыка»; 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А; ORCID iD 0000-0001-9606-0566
Барышникова Дарья Андреевна — врач-офтальмолог, ОКДЦ ПАО «Газпром»; 117420, Россия, г. Москва, ул. Наметкина, д. 16; ORCID iD 0000-0001-7983-7556
Галимова Айсылу Булатовна — к.м.н., заведующая офтальмологическим отделением № 2 Всероссийского центра глазной и пластической хирургии ФГБОУ ВО БГМУ Минздрава России; 450075, Россия, г. Уфа, ул. Рихарда Зорге, д. 67/1; ORCID iD 0000-0001-7311-0954
Гетманова Анастасия Михайловна — врач-офтальмолог, ГАУЗ «Брянская областная больница № 1»; 241035, Россия, г. Брянск, ул. Камозина, д. 11; ORCID iD 0000-0002-4900-6193.
Городничий Виталий Владимирович — врач-офтальмолог, ФКУ «ЦВКГ им. П.В. Мандрыка»; 107014, Россия, г. Москва, ул. Б. Оленья, д. 8А; ORCID iD 0000-0002-7276-5753
Зубашева Светлана Александровна — врач-офтальмолог, ФГБУ «9 Лечебно-диагностический центр» Минобороны России; 119146, Россия, г. Москва, Комсомольский пр-т, д. 13а; ORCID iD 0000-0002-6859-8040
Каримов Улугбек Расулович — к.м.н., врач-офтальмолог Сырдарьинской областной офтальмологической больницы; 181007, Республика Узбекистан, г. Гулистан, ул. Махтумкули, д. 62; ORCID iD 0000-0002-3361-0070
Космынина Светлана Васильевна — врач-офтальмолог, ООО «Павлов-Мед»; 183047, Россия, г. Мурманск, ул. Павлова, д. 6; ORCID iD 0000-0002-8994-4555
Парова Елизавета Башировна — врач-офтальмолог, аспирант ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-3436-0293
Селезнев Алексей Владимирович — к.м.н., доцент кафедры оториноларингологии и офтальмологии, ФГБОУ ВО ИвГМА Минздрава России; 153012, Россия, г. Иваново, Шереметевский пр-т, д. 8; ORCID iD 0000-0002-4583-6050
Семенова Ирина Ивановна — врач-офтальмолог, УЗ «МКБ СМП»; 212030, Республика Беларусь, г. Могилев, ул. Боткина, д. 2; ORCID iD 0000-0002-9801-5926
Чернякова Татьяна Васильевна — к.м.н., ассистент кафедры офтальмологии им. акад. А.П. Нестерова лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач-офтальмолог, ФГБУ «52 КДЦ» Минобороны России; 125167, Россия, г. Москва, ул. Планетная, д. 3, к. 3; ORCID iD 0000-0003-1361-6704
Шахалова Анна Павловна — к.м.н., заведующая отделением, ЦЛКЗ «Тонус Амарис», 603089; Россия, г. Нижний Новгород, ул. Ижорская, д. 50, корп. 2; ORCID iD 0000-0001-8529-4973
Контактная информация: Нагорнова Зоя Михайловна, e-mail: myxazai@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 28.08.2024.
Поступила после рецензирования 20.09.2024.
Принята в печать 15.10.2024.
About the authors:
Victoria E. Korelina — C. Sc. (Med.), Assistant Professor of the Department of Family Medicine, North West State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-2022-5912
Zoya M. Nagornova — C. Sc. (Med.), Assistant Professor of the Department of Otorhinolaryngology and Ophthalmology, Ivanovo State Medical University; 8, Sheremetevskiy ave., Ivanovo, 153012, Russian Federation; ORCID iD 0000-0002-3821-689X
Ilya A. Bulakh — Ophthalmologist, Ivastramed Medical Center LLC; 30, Rabfakovskaya str., Ivanovo, 153000, Russian Federation; ORCID iD 0000-0003-2348-4880
Aleksandr V. Kuroyedov — Dr. Sc. (Med.), Acting Head of the Academician A.P. Nesterov Department of Ophthalmology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; Head of the Ophthalmological Center (with Day Hospital), P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0001-9606- 0566
Daria A. Baryshnikova — Ophthalmologist, Sectoral Clinical Diagnostic Center of the Gazprom PJSC; 16, Nametkin str., Moscow, 117420, Russian Federation; ORCID iD 0000-0001-7983-7556
Aysylu B. Galimova — C. Sc. (Med.), Head of the Ophthalmological Department No. 2 of the Russian Center for Eye and Plastic Surgery, Bashkir State Medical University; 67/1, Rikhard Zorge str., Ufa, 450075, Russian Federation; ORCID iD 0000-0001-7311-0954
Anastasia M. Getmanova — Ophthalmologist, Bryansk Regional Hospital No. 1; 11, Kamozin str., Bryansk, 241035, Russian Federation; ORCID iD 0000-0002-4900-6193
Vitaly V. Gorodnichy — Ophthalmologist, P.V. Mandryka Military Clinical Hospital; 8A, Bolshaya Olenya str., Moscow, 107014, Russian Federation; ORCID iD 0000-0002-7276-5753
Svetlana A. Zubasheva — Ophthalmologist, Treatment and Diagnostic Center No. 9; 13a, Komsomolsky ave., Moscow, 119146, Russian Federation; ORCID iD 0000-0002-6859-8040
Ulugbek R. Karimov — C. Sc. (Med.), Ophthalmologist, Syr Darya Regional Ophthalmic Hospital; 62, Makhtumkuli str., Gulistan, 181007, Republic of Uzbekistan; ORCID iD 0000-0002-3361-0070
Svetlana V. Kosmynina — Ophthalmologist, Pavlov-Med LLC; 6, Pavlov str., Murmansk, 183047, Russian Federation; ORCID iD 0000-0002-8994-4555
Elizaveta B. Parova — Ophthalmologist, Postgraduate Student, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-3436-0293
Alexey V. Seleznev — C. Sc. (Med.), Assistant Professor of the Department of Otorhinolaryngology and Ophthalmology, Ivanovo State Medical Academy; 8, Sheremetevskiy ave., Ivanovo, 153012, Russian Federation; ORCID iD 0000-0002-4583-6050
Irina I. Semenova — Ophthalmologist, Mogilev City Hospital of the Emergency Medical Care; 2, Botkin str., Mogilev, 212030, Republic of Belarus; ORCID iD 0000-0002-9801-5926
Tatyana V. Chernyakova — C. Sc. (Med.), assistant of the Acad. A.P. Nesterov Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ophthalmologist, 52 Advisory and Diagnostic Center of the Ministry of Defense Russian Federation; 3, build. 3, Planetnaya str., Moscow, 125167, Russian Federation; ORCID iD 0000-0003-1361-6704
Anna P. Shakhalova — C. Sc. (Med.), Head of the Department, Tonus Amaris Medical Clinical Center; 50, building 2, Izhorskaya str., Nizhny Novgorod, 603089, Russian Federation; ORCID iD 0000-0001-8529-4973
Contact information: Zoya M. Nagornova, e-mail: myxazai@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 28.08.2024.
Revised 20.09.2024.
Accepted 15.10.2024.
1Клинические рекомендации. Глаукома первичная открытоугольная. 2020.
материал rmj.ru
