Введение
История изобретения лазера берет свое начало в 1900-х годах, когда благодаря исследованиям Альберта Эйнштейна и формулированию им понятия «вынужденное излучение» возникло понимание физических процессов, которые легли в основу создания оптического квантового генератора, или лазера. На трудах Эйнштейна основан предложенный В.А. Фабрикантом в 1951 г. метод усиления света. Спустя 9 лет американский физик Т. Мейман и советские физики Н.И. Басов и А.П. Прохоров в СССР независимо друг от друга генерировали излучение видимого диапазона на рубиновом кристалле, что открыло путь для создания твердотельных источников лазерной энергии. В последующем лазерное излучение генерировали и в других активных средах, например в смеси газов гелия и неона (газовые лазеры), а уже в 1963 г. появились первые полупроводниковые лазеры, за изобретение которых Ж.И. Алферов и Г. Кремер получили Нобелевскую премию. Более подробное описание основных понятий электромагнитных когерентных оптических излучений, история его возникновения и развития представлены в статье «История развития лазера и особенности его применения» И.В. Минаева с соавторами в Чебышевcком сборнике (2019) [1].
Со временем появлялись новые разработки. Например, Кумар Пател, изобретатель из США, в 1966 г. сконструировал CO2-лазер, способный генерировать излучение на длине волны 10,6 мкм, отличительной особенностью которого является чрезвычайно сильное поглощение в воде, благодаря чему излучение CO2-лазера полностью поглощается в биологических тканях на глубине от 30 до 50 мкм, что, в свою очередь, обусловливает его прекрасные режущие свойства [2]. Наряду со своими достоинствами CO2-лазеры имеют ряд конструктивных недостатков, ограничивающих их широкое клиническое применение. Эти недостатки, в первую очередь, связаны со средствами доставки лазерного излучения к операционному полю. Доставка лазерного излучения осуществляется при помощи шарнирно-приз-менных и зеркально-линзовых систем, которые имеют значительные габариты, сложны в эксплуатации и обслуживании.
В начале 1970-х годов появились твердотельные лазеры на алюмоиттриевом гранате, активированном ионами неодима, с излучением λ=1,064 мкм. Вслед за промышленными лазерными установками были созданы и хирургические YAG:Nd-лазеры. Излучение этого спектрального диапазона прекрасно передавалось по кварцевым оптоволоконным световодам, что открыло возможность проведения эндохирургических операций на полых внутренних органах [3–5]. Излучение λ=1,064 мкм не столь сильно, как излучение CO2-лазеров, поглощалось в биологических тканях, что позволяло осуществлять объемную коагуляцию и рассечение биотканей с хорошим гемостазом. Лечебные манипуляции можно было осуществлять контактным способом — непосредственно рабочей частью кварцевого волоконно-оптического инструмента. Однако существенным недостатком этих аппаратов является риск повреждения соседних здоровых тканей и органов из-за слабого поглощения излучения этого спектрального диапазона биотканями.
Бурное развитие микроэлектроники привело к тому, что с начала 1990-х годов на смену твердотельным лазерам пришли полупроводниковые лазеры. Вначале появились лазеры ближнего инфракрасного диапазона с излучением от 800 до 1100 нм, а затем лазеры среднего инфракрасного диапазона с излучением от 1100 до 2000 нм и лазеры сине-зеленой области спектра с излучением от 400 до 570 нм. Появление полупроводниковых лазеров, перекрывающих практически весь оптический спектральный диапазон длин волн, дало возможность совмещать в одном инструменте достоинства CO2-лазеров и YAG:Nd‑лазеров, исключив их недостатки. Лазеры стали широко применяться не только в оториноларингологии, но и в урологии, абдоминальной хирургии, гинекологии, пульмонологии, артроскопической хирургии и т. д. [6, 7].
Применение хирургических лазеров в лечении различных заболеваний ЛОР-органов в сравнении с «холодными» методиками имеет несомненные преимущества. К основным преимуществам относятся сокращение времени проведения операции за счет малотравматичного и удобного рассечении тканей, работа хирурга в относительно «сухом» операционном поле из-за высокой скорости гемостаза операционной раны, а сам лазерный разрез полностью асептичен, в связи с чем регенерация в послеоперационном периоде происходит в более ранние сроки. Эти преимущества обеспечивают высокоэнергетическим лазерным установкам эффективность в лечении заболеваний ЛОР-органов и гортани [8–11]. Особое место среди лазерных установок занимают наиболее прогрессивные диодные хирургические лазерные аппараты с минимально инвазивной хирургической альтерацией тканей, например ARC TruBlue с длиной волны 445 нм синего спектра оптического излучения [12–16].
Биологические ткани являются оптически неоднородными поглощающими средами, взаимодействие которых с оптическим излучением преимущественно определяется коэффициентами поглощения и рассеяния. Поглощение биоткани определяется наличием в составе биотканей хромофоров (поглотителей оптического излучения) и их концентрацией. Рассеяние же определяется размером и количеством структурных компонентов в составе биоткани (коллагеновые волокна, клеточные органеллы и т. д.). Именно различиями в концентрации хромофоров и структуре биотканей в органах человеческого организма определяется глубина проникновения оптического излучения в биообъекты [17, 18]. А от глубины проникновения оптического излучения, в свою очередь, зависит объем зоны коагуляции и гемостатический эффект. Содержащиеся в тканях вода, гемоглобин и меланин имеют ключевое влияние на поглощение света оптического диапазона биотканями [19, 20]. Среди коммерчески доступных лазерных источников наиболее высокий коэффициент поглощения в видимой и ближней инфракрасной областях спектра имеет лазерное излучение с длиной волны 450±10 нм в хромофорах — оксигемоглобине, гемоглобине [21].
На рисунке 1 продемонстрированы результаты расчета коэффициентов поглощения слизистого эпителия и слизистой оболочки в диапазоне от 400 до 10 800 нм, выполненного коллективом авторов на основании найденных в научной литературе данных об объемной концентрации хромофоров в этих тканях и их спектров поглощения [22–30].
В результате анализа приведенных на рисунке 1 зависимостей видно, что на длине волны 450 нм коэффициент поглощения слизистой оболочки составляет 13,1 см-1, что соответствует глубине проникновения излучения около 0,7 мм. При этом коэффициент поглощения слизистого эпителия гортани на этой же длине волны — 0,24 см-1 ввиду отсутствия крови в данном слое биоткани и большого содержания воды в клетках и межклеточном пространстве. Таким образом, можно сделать вывод, что при воздействии лазерным излучением с длиной волны 450 нм на ткани гортани слизистый эпителий не будет нагреваться и повреждаться, сохранятся целостность поверхности слизистого эпителия и все функциональные свойства, будет возможно выполнять наиболее щадящие разрезы и иссечения и сократить сроки заживления. Все тепло будет выделяться в капиллярном русле слизистой оболочки, что, в свою очередь, создаст максимально благоприятные условия для проведения селективной коагуляции тканей гортани.
![Рис. 1. Спектры поглощения слизистой оболочкой горта- ни и ее основных хромофоров [30] Fig. 1. Absorption spectra in the laryngeal mucosa of the main chromophores [30] Рис. 1. Спектры поглощения слизистой оболочкой горта- ни и ее основных хромофоров [30] Fig. 1. Absorption spectra in the laryngeal mucosa of the main chromophores [30]](https://medblog.su/wp-content/uploads/2025/01/Hirurgicheskij-lazer-450-nm-v-lechenii-zabolevanij-verhnih-dyhatelnyh-putej.png)
Как было отмечено выше, благодаря особенностям взаимодействия лазерного излучения с длиной волны 450±10 нм с кровенаполненными биотканями такие хирургические лазерные аппараты позволяют хирургу работать на «сухом поле», не только проводить коагуляцию слизистой оболочки и нижележащих тканей, но и осуществлять иссечения, вапоризацию и т. д. [12–16]. В ряде исследований показано, что воздействие лазерного излучения с длиной волны 450±10 нм вызывает локальный нагрев тонкого слоя кровенаполненной биоткани только в месте лазерного воздействия с достаточным гемостатическим эффектом, что минимизирует образование некротических изменений на периферии зоны лазерного воздействия и усиливает процессы регенерации тканей на всех сроках послеоперационного периода [17–24]. Это контрастирует с воздействием излучения CO2-лазера (λ=10,6 мкм), не обладающего селективностью, одинаково сильно поглощаемого слизистой оболочкой и эпителием и тотально нагревающего слой ткани толщиной около 15–20 мкм без достаточного гемостатического эффекта.
В свете вышесказанного разница в эффектах воздействия на биологические ткани аппаратов излучением CO2-лазера (λ=10,6 мкм) и диодного лазера излучением 450±10 нм определяет их применимость в лечении заболеваний гортани [19, 20]. Исходя из ряда физических характеристик, определяющих взаимодействие излучения с биологической тканью, методов доставки излучения, визуальных оценок эффективности резекции, аппараты различают по их функционалу, предназначению и выполняемым операциям. Необходимо отметить, что CO2-лазеры (λ=10,6 мкм) не обладают селективностью, нагревают еще и окружающие ткани, проникают на глубину до 15–20 мкм за счет одинаково интенсивного поглощения в воде, слизистой оболочке и базальной пластинке [24–29]. В этом плане диодный лазер при хирургическом лечении заболеваний гортани проявляет целый ряд вышеуказанных преимуществ (селективный нагрев ткани, проникновение на глубину до 0,7 мм).
Таким образом, актуальными являются повышение эффективности хирургического лечения гортани на основе применения лазерного аппарата с длиной волны 450±10 нм и мощностью до 10 Вт и последующая оценка полученных результатов.
Содержание статьи
Собственный опыт применения хирургического лазерного аппарата с длиной волны 450 нм отечественного производства
В 2021–2023 гг. на клинических базах ФГБУ «Санкт-Петербургский НИИ уха горла носа и речи» Минздрава России нами были пролечены 10 пациентов с различными заболеваниями глотки и гортани. Всем пациентам оперативные вмешательства выполнены с применением хирургического лазерного аппарата с длиной волны 450±10 нм (синий спектр) отечественного производства — полупроводниковый аппарат с волоконно-оптическими световодами максимальной средней мощностью 10 Вт для минимально инвазивной хирургии.
Ранее нами уже проводились исследования по изучению возможности использования полупроводникового лазерного аппарата с длиной волны 450±10 нм при хирургическом лечении заболеваний гортани. Оценки полученных нами результатов были опубликованы [12–16, 18]. Настоящая работа является продолжением исследования с приведением клинических наблюдений.
На клинических базах нескольких кафедр оториноларингологии при технической поддержке аспирантов Университета ИТМО и участии инженеров-исследователей ООО «НПП ВОЛО» проведен цикл исследовательских работ с целью оптимизации режимов лечебных лазерных воздействий с использованием лазеров сине-зеленой области спектра при проведении хирургических вмешательств на ЛОР-органах.
Критерии включения: возраст пациентов 18–70 лет; верифицированный диагноз (на основании истории развития заболевания, объективной картины, лабораторных, инструментальных исследований): хронический декомпенсированный тонзиллит, доброкачественные новообразования гортани, опухолеподобные заболевания гортани, хронический паралитический стеноз гортани; подписанное информированное согласие на участие в исследовании.
Критерии исключения: возраст до 18 лет, а также беременность; наличие противопоказаний со стороны других органов и систем, течение острого или обострение хронических заболеваний организма, сочетанная коморбидная патология, наличие незавершенного лечения онкологического заболевания.
На этапе госпитализации все пациенты подписывали информированное добровольное согласие на все виды лечения, проведение лабораторных и клинических исследований, а также согласие на публикацию медицинских данных из истории болезни.
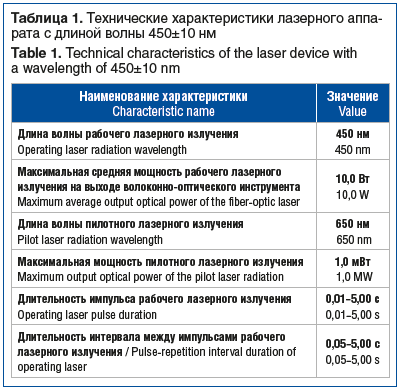
Аппарат является медицинским изделием, имеет необходимую юридическую и медицинскую документацию, сертифицирован. В таблице 1 представлены технические характеристики аппарата согласно инструкции производителя.
В работе с аппаратом использовался световодный инструмент с комплектом сменных насадок для манипуляций на гортани, диаметр световедущей жилы которого составил 400 мкм.
В световодном инструменте предусмотрен канал для подачи рабочего газа в операционное поле. Рабочий газ необходим для охлаждения окружающих тканей, прилегающих к операционному полю, и удаления продуктов горения биотканей.
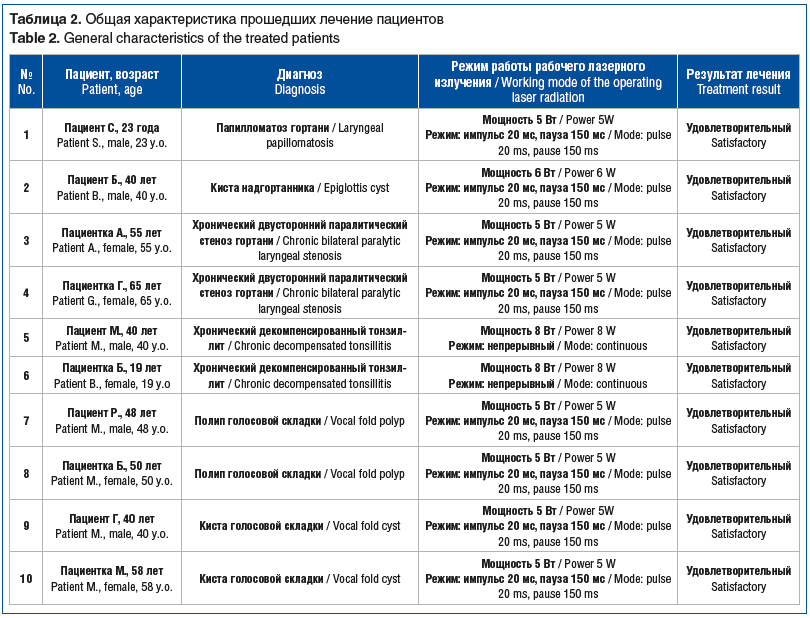
Критериями удовлетворительной оценки результатов лечения считали: простоту выполнения хирургических манипуляций (разрез, вапоризация, коагуляция и т. д.), отсутствие кровотечения, умеренно выраженную отечность препарированных тканей, раннее заживление ран. Критериями неудовлетворительной оценки служили избыточная коагуляция и ожог мягких тканей, кровотечение, послеоперационные отеки. Краткая информация о пациентах с верифицированным диагнозом, режимы, на которых выполнялись операции, и результаты лечения представлены в таблице 2.
Необходимо отметить, что каких-либо осложнений в связи с применением указанного аппарата не было, послеоперационный период протекал относительно благоприятно. Сам аппарат в ходе проведения хирургических манипуляций продемонстрировал высокие фотоангиолитические и резекционные свойства, что позволило, например, при работе с образованиями гортани избежать дополнительного гемостаза и значительно сократить время операции. В приведенных в таблице 2 клинических наблюдениях продемонстрированы минимальные реактивные изменения послеоперационных ран, наблюдался небольшой отек тканей, незначительный объем раневого отделяемого, в более ранние сроки купировались постоперационные воспалительные реакции, наблюдалась более ранняя регенерация операционных ран. Таким образом, аппарат продемонстрировал высокую безопасность и эффективность при работе на ЛОР-органах. В отношении оснащенности и дополнительных возможностей аппарат с длиной волны 450±10 нм отечественного производства более вариативен, чем представленные на рынке аналоги.
Приводим несколько клинических наблюдений пациентов с разными диагнозами, перенесших хирургические вмешательства.
Клиническое наблюдение 1
Пациент С., 25 лет, диагноз: рецидивирующий папилломатоз гортани. Из анамнеза: пациент перенес оперативные вмешательства по удалению папиллом гортани 6 раз. На момент поступления пациент отмечал выраженное снижение голосовой функции, регистрируемое на протяжении 6 мес. Анамнез заболевания: впервые хирургическое лечение было проведено 12 лет назад, в юношеском возрасте, повторные операции были выполнены, по данным медицинской документации, в 2016 г. и 2019 г. с межрецидивным периодом в 2 года и 8 мес. Объективно: вход в гортань свободный, отсутствуют визуализируемые изменения слизистой оболочки гортани, надгортанника, черпало-надгортанных складок и черпаловидных хрящей, в области верхнемедиального края правой голосовой складки определяется рост папиллом в виде мелко- и крупнобугристых розоватых разрастаний, изменений левой голосовой складки не выявлено. Колебания голосовых складок при фонации асимметричные. При осмотре в подголосовом отделе гортани патологии не выявлено. Лечение: удаление новообразований гортани с применением микрохирургической техники, эндоскопического контроля под эндотрахеальным наркозом (ЭТН). С применением микроларингоскопии проведен осмотр голосового отдела гортани: рубцово измененных голосовых складок, инфильтрации правой голосовой складки мелкобугристыми образованиями, формирующими единый папилломатозный инфильтрат. С помощью хирургического полупроводникового лазера (длина волны 450±10 нм с мощностью 5 Вт, режим импульс 20 мс с паузой 150 мс) и гортанных щипцов визуализируемые новообразования были отсепарированы от слизистой оболочки правой голосовой складки в пределах здоровых тканей. Край голосовой складки подвергался лазерной обработке. Кровотечения нет. Фрагменты удаленного материала отправлены для проведения гистологического исследования.
Пациент выписан на 5-е сутки в удовлетворительном состоянии. Активных жалоб не предъявлял — снижение голосовой функции соответствовало объему перенесенного хирургического вмешательства. Объективно: область резекции правой голосовой складки слабо гипер-емирована. Просвет для дыхания свободный. Подголосовой отдел без особенностей.
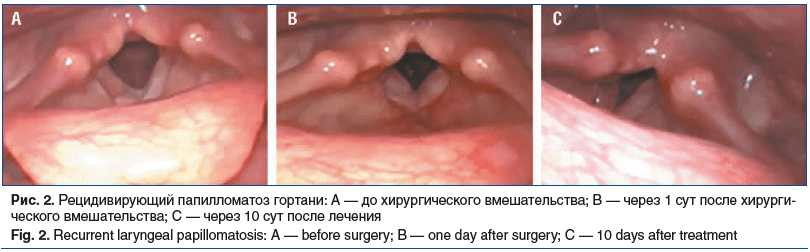
На рисунке 2 продемонстрированы результаты видео-эндоскопического исследования гортани до проведения операции, на 1-й и 10-й день послеоперационного периода соответственно. До операции (рис. 2А) разрастание папиллом визуализировалось по верхнемедианному краю правой голосовой складки. В 1-й день послеоперационного периода (рис. 2В) отмечался умеренно выраженный реактивный отек в зоне оперативного вмешательства без яркой сосудистой реакции. При осмотре пациента спустя 10 дней с момента проведения хирургического лечения (рис. 2С) прослеживались минимально выраженные реактивные явления правой голосовой складки. На 14-й день после оперативного вмешательства голосовая функция гортани была восстановлена в полном объеме.
Клиническое наблюдение 2
Пациент Б., 41 год, диагноз при поступлении: киста надгортанника. Ощущение «кома» в глотке периодически и ощущение инородного тела в глотке беспокоили пациента в течение года. Анамнез заболевания: оперативные вмешательства на ЛОР-органах отрицает. Объективно: в области левой валлекулы регистрируется кистоподобное новообразование до 3 см в диаметре. Сохранена симметрия черпаловидных хрящей, подвижность голосовых складок в полном объеме. Визуализация подголосового отдела невозможна. Лечение: путем использования эндоскопической техники под ЭТН и микрохирургических технических методик проведено удаление кисты язычной поверхности надгортанника. Проведена многокомпонентная анестезия с интубацией трахеи, установлена капа на верхнюю челюсть. С использованием операционного микроскопа и ларингоскопа изучены индивидуальные анатомические особенности вестибулярного отдела гортани с регистрацией со стороны надгортанника по средней линии округлого образования розоватого цвета с характерной гладкой поверхностью, диаметр которого составлял около 25 мм. Для хирургического отсечения новообразования от слизистой оболочки язычной поверхности надгортанника в пределах здоровых тканей был применен полупроводниковый лазер (длина волны 450±10 нм, мощность 5 Вт, режим импульс 20 мс, пауза 150 мс) и гортанные щипцы. Кровотечения во время операции и в послеоперационном периоде не было. Фрагменты иссеченного материала были отправлены на гистологию.
На 5-е сутки послеоперационного периода пациент был выписан в удовлетворительном состоянии.
Объективно: визуализируемая при выполнении непрямой ларингоскопии слизистая оболочка гортани была влажной и розовой. Свободно осматривались симметричные свободные язычные валлекулы. На язычной поверхности надгортанника слева минимально выраженный отек, с присоединением в послеоперационном периоде тонкого слоя фибринового налета с характерными очагами эпителизации. Область черпаловидных хрящей и голосовых складок — без особенностей.
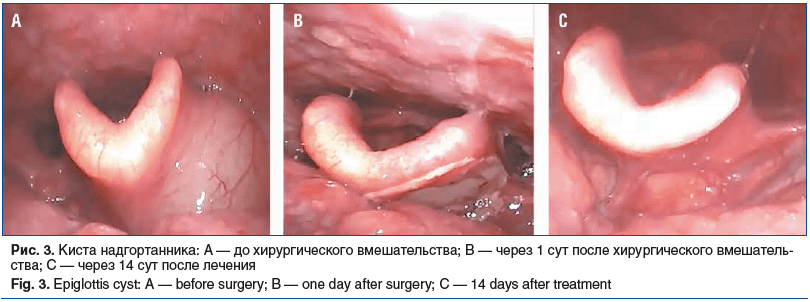
На рисунке 3 представлены результаты видеоэндоскопии гортани до операции, в 1-й и 14-й день послеоперационного периода. На рисунке 3А отчетливо прослеживается кистоподобное образование, локализованное на язычной поверхности надгортанника, полностью закрывающее зону левой валлекулы, переходящее на левую черпало-надгортанную складку. В 1-е сутки в области воздействия отмечается локальный тонкий фибриновый налет (рис. 3В), на 14-е сутки (рис. 3С) признаки воспаления в месте вмешательства отсутствуют.
Клиническое наблюдение 3
Пациентка А., 54 года, на момент госпитализации предъявляла жалобы на затруднение дыхания, часто возникающую одышку, провоцируемую длительным разговором и минимальной физической нагрузкой. Диагноз: паралитический стеноз гортани. Анамнез заболевания: впервые вышеуказанные жалобы стали беспокоить после тиреоид-эктомии по поводу аденокарциномы, двумя годами ранее пациентка перенесла частичную резекцию доли щитовидной железы по поводу диффузного узлового зоба. В раннем послеоперационном периоде появились затруднения дыхания и афония. На фоне получаемого консервативного лечения с целью устранения отека отмечена положительная динамика в виде незначительного улучшения дыхания. Последующие 6 мес. занятий с фонопедом позволили нормализовать голосовую функцию, однако пациентка отмечала декомпенсацию дыхания, формирование одышки на фоне слабых физических нагрузок. В последующие 12 лет отмечались периодические проблемы с дыханием в покое, при длительном разговоре, шумном дыхании во сне. Объективно: слизистая оболочка гортани розовая, чистая. Надгортанник без особенностей. Грушевидные синусы свободные. Черпаловидные хрящи визуально неподвижны. Голосовые складки белые, блестящие, неподвижны, находятся при дыхании в медианном положении. Глубокий вдох сопровождается формированием максимального межскладкового расстояния в задней трети около 3 мм. Подголосовой отдел не визуализируется.
Лечение: ларинготрахеопластика при стенозе гортани под ЭТН. Выполнена многокомпонентная анестезия с интубацией трахеи, высокочастотная вентиляция легких с установкой капы на верхнюю челюсть. С использованием операционного микроскопа и ларингоскопа проведена визуализация голосового отдела гортани. С помощью полупроводникового лазера (длина волны 450±10 нм, мощность 7,5 Вт, импульс 20–30 мс, пауза 150 мс) проведено рассечение правой голосовой складки в средней трети, с дальнейшей отсепаровкой лоскута и резекцией голосового отростка черпаловидного хряща справа. Сформированный лоскут фиксирован узловыми швами Monocryl 6:0 латерально к стенке голосового отдела. Проведен гемостаз. Просвет между голосовыми складками в задней трети составлял примерно 7 мм.
На рисунке 4 представлены результаты видеоэндоскопии гортани до операции, спустя 7 и 30 дней после хирургического вмешательства. До выполнения операции голосовая щель у пациентки просматривалась около 3 мм при парамедианном положении истинных голосовых складок (рис. 4А). После эндоларингеальной ларингопластики спустя 7 сут локально в месте хирургического вмешательства визуализировался плотный налет фибрина (рис. 4В), спустя 30 дней с момента проведения хирургического лечения в месте вмешательства регистрировались слабовыраженные реактивные явления, воспалительные явления отсутствовали (рис. 4С).
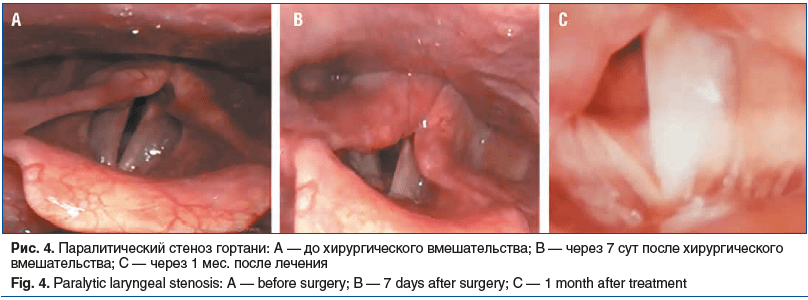
Состояние пациентки при выписке оценивалось как удовлетворительное. Жалобы активно не предъявляет.
Объективно: вход в гортань свободный, слизистая гортани влажная, розовая. Изменений со стороны надгортанника, черпало-надгортанных складок и зон черпаловидных хрящей не выявлено. Голосовые складки слева серого цвета, справа голосовая складка резецирована в задней трети, прослеживается незначительный отек слизистого лоскута, инъекции сосудов, швы состоятельны. Дыхание через верхние дыхательные пути свободное. При глубоком дыхании межскладковый просвет визуализируется до 8 мм. Подголосовой отдел без особенностей.
Обсуждение
Во всех приведенных клинических наблюдениях пациентам было проведено комплексное лечение с включением общей антибактериальной, противовоспалительной и симптоматической терапии. Местное консервативное лечение получали в виде ингаляций лекарственных средств и гортанных вливаний. В приведенных наблюдениях воспалительные изменения со стороны гортани купировались в течение 10–14 дней. При выполнении тонзиллэктомии (клинические наблюдения 5 и 6 в таблице 2), учитывая особенности кровоснабжения небных миндалин, помимо основного воздействия в виде применения лазера авторами была использована электрокоагуляция сосудов крупного и среднего калибра. Среди преимуществ точечной коагуляции можно выделить меньшее термическое повреждение окружающих тканей, чем при использовании на протяжении всего оперативного вмешательства электрокоагулятора (что в дальнейшем благоприятно сказывается на регенеративных способностях поврежденных тканей), и незначительную выраженность болевого синдрома.
Успешное завершение лечебного процесса подтверждается тем, что воспалительные явления разрешились к 10–14-м суткам от момента оперативного лечения, что в среднем быстрее на 2,1 сут по сравнению с использованием других хирургических лазеров, описанных в литературе [2, 4, 7, 8, 29].
Щадящий эффект полупроводникового лазера с длиной волны 450±10 нм обусловлен прежде всего особенностями взаимодействия с биологической тканью. Поверхностный эпителий гортани (голосовой складки) практически не подвергается термическому повреждению, так как обеднен кровеносными сосудами. Коагуляционный эффект возникает при взаимодействии длины волны 450±10 нм с целевым хромофором гемоглобином. Воздействие лазера на капиллярную сосудистую сеть голосовой складки вызывает стойкий гемостаз в ране, обеспечивает «чистое» операционное поле, благоприятные условия для выполнения оперативного приема и гладкого течения послеоперационного периода.
Высокий коэффициент поглощения длины волны 450±10 нм в гемоглобине, высокий коагуляционный эффект представляют интерес и имеют перспективу в применении «синего» лазера при хирургическом лечении сосудистых новообразований гортани (гемангиом) у взрослых и детей.
Планируется выполнение экспериментальных исследований на биологических моделях (лабораторных животных) для разработки еще более щадящих и мини-инвазивных режимов работы «синего» лазера в хирургическом лечении хронических заболеваний гортани. В качестве дальнейшей модернизации лазера рекомендована разработка и внедрение в состав лазерного аппарата устройства для подачи инертного газа (гелия) в операционное поле с целью повышения эффективности работы лазера и уменьшения тканевого воспаления.
Заключение
Результаты исследования показали, что применение высокоэнергетического лазерного излучения в оптическом диапазоне с длиной волны 450±10 нм при мощности до 10 Вт позволяет выполнять оперативное лечение с высокой точностью и безопасностью. Щадящий эффект полупроводникового лазера с длиной волны 450±10 нм обусловлен прежде всего особенностями взаимодействия с биологической тканью. Поверхностный эпителий гортани (голосовой складки) практически не подвергается термическому повреждению, так как обеднен кровеносными сосудами. Коагуляционный эффект возникает при взаимодействии длины волны 450±10 нм с целевым хромофором гемоглобином. Воздействие лазера на капиллярную сосудистую сеть голосовой складки создает стойкий гемостаз в ране, «чистое» операционное поле, благоприятные условия для выполнения оперативного приема и позволяет достичь гладкого течения послеоперационного периода. Высокий коэффициент поглощения длины волны 450±10 нм в гемоглобине, высокий коагуляционный эффект представляют интерес и являются перспективными для применения «синего» лазера в хирургическом лечении сосудистых новообразований гортани (гемангиом) у взрослых и детей.
Сведения об авторах:
Кривопалов Александр Александрович — д.м.н., руководитель научно-исследовательского отдела патологии верхних дыхательных путей ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; доцент кафедры оториноларингологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-6047-4924.
Шамкина Полина Александровна — к.м.н., науч. сотр. научно-исследовательского отделения патологии верхних дыхательных путей ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; ORCID iD 0000-0003-4595-365X.
Коркмазов Мусос Юсуфович — д.м.н., профессор, заведующий кафедры оториноларингологии ФГБОУ ВО ЮУГМУ Минздрава России; 454092, Россия, г. Челябинск, ул. Воровского, д. 64; ORCID iD 0000-0002-8642-0166.
Панченко Павел Игоревич — младший научный сотрудник научно-исследовательского отдела патологии верхних дыхательных путей ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; ORCID iD 0000-0002-3380-7228.
Глущенко Александра Ивановна — аспирант научно-исследовательского отдела патологии верхних дыхательных путей ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; ORCID iD 0000-0001-5209-7869.
Журба Владимир Михайлович — инженер-исследователь, генеральный директор ООО «НПП ВОЛО»; 199034, Россия, г. Санкт-Петербург, 17-я линия В.О., д. 4-6, литер А, офис Б-202-3; ORCID iD 0009-0006-9919-3106.
Чучин Виктор Юрьевич — инженер-исследователь ООО «НПП ВОЛО»; 199034, Россия, г. Санкт-Петербург, 17-я линия В.О., д. 4-6, литер А, офис Б-202-3; аспирант Университета ИТМО; 197101, Россия, г. Санкт-Петербург, Кронверкский пр., д. 49; ORCID iD 0009-0001-5062-1265.
Контактная информация: Кривопалов Александр Александрович, e-mail: krivopalov@list.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.06.2024.
Поступила после рецензирования 26.06.2024.
Принята в печать 19.07.2024.
About the authors:
Alexander A. Krivopalov — Dr. Sc. (Med.), Head of the Research Department of the Upper Respiratory Tract Pathology, St. Petersburg Research Institute of Ear, Throat, Nose and Speech; 9, Bronnitskaya str., St. Petersburg, 190013, Russian Federation; Associate Professor of the Department of Otorhinolaryngology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-6047-4924.
Polina A. Shamkina — C. Sc. (Med.), Assistant Professor of the Research Department of the Upper Respiratory Tract Pathology, St. Petersburg Research Institute of Ear, Throat, Nose and Speech; 9, Bronnitskaya str., St. Petersburg, 190013, Russian Federation; ORCID iD 0000-0003-4595-365X.
Musos Yu. Korkmazov — Dr. Sc. (Med.), Professor, Head of the Department of Otorhinolaryngology, South Ural State Medical University; 64, Vorovskogo str., Chelyabinsk, 454092, Russian Federation; ORCID iD 0000-0002-8642-0166.
Pavel I. Panchenko — Junior Researcher at the Research Department of Upper Respiratory Tract Pathology, St. Petersburg Research Institute of Ear, Throat, Nose and Speech; 9, Bronnitskaya str., St. Petersburg, 190013, Russian Federation; ORCID iD 0000-0002-3380-7228.
Alexandra I. Glushchenko — postgraduate student of the Research Department of the Upper Respiratory Tract Pathology, St. Petersburg Research Institute of Ear, Throat, Nose and Speech; 9, Bronnitskaya str., St. Petersburg, 190013, Russian Federation; ORCID iD 0000-0001-5209-7869.
Vladimir M. Zhurba — research engineer, General Director of Research and Production Enterprise for Fiber Optic and Laser Equipment LLC; 4-6, build. A, office B-202-3, V.O. 17th Lane, St. Petersburg, 199034, Russian Federation; ORCID iD 0009-0006-9919-3106.
Victor Yu. Chuchin — research engineer, Research and Production Enterprise for Fiber Optic and Laser Equipment LLC; 4-6, build. A, office B-202-3, V.O. 17th Lane, St. Petersburg, 199034, Russian Federation; postgraduate student at ITMO University; 49, Kronverksky Ave., St. Petersburg, 197101, Russian Federation; ORCID iD 0009-0001-5062-1265.
Contact information: Alexander A. Krivopalov, e-mail: krivopalov@list.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.06.2024.
Revised 26.06.2024.
Accepted 19.07.2024.
материал rmj.ru
