Введение
Пролапс тазовых органов (ПТО) – широко распространенное патологическое состояние, существенно ухудшающее качество жизни женщины и имеющее потенциальные серьезные последствия для ее здоровья. На протяжении трех последних десятилетий отмечалась глобальная тенденция к снижению частоты заболеваемости ПТО у женщин [1]. Несмотря на это, ПТО продолжает занимать ведущие позиции в структуре гинекологической заболеваемости. Распространенность ПТО среди разных социодемографических групп доходит до 65%, при этом до 30% женщин обращаются за медицинской помощью по поводу симптомов заболевания, 10–50% случаев представлены бессимптомным течением и спонтанным выявлением патологии при гинекологическом обследовании, 20–65% – симптоматические пациенты, диагноз которым был поставлен при рутинном обследовании. Учитывая увеличение средней продолжительности жизни в развитых странах и связанный с ним глобальный рост старения населения, ожидается, что в ближайшем будущем потребность в эффективных методах лечения ПТО будет только возрастать [2, 3]. С другой стороны, в развивающихся странах, а также в регионах с высоким уровнем многодетности (≥4 родов), независимо от экономического статуса, отмечается омоложение популяции пациенток с ПТО: средний возраст составляет 30–45 лет [4–6]. По мнению ряда исследователей, при сохранении существующих тенденций заболеваемость ПТО к 2050 г. может вырасти на 46%, то есть почти вдвое [7].
Клинические проявления ПТО обусловлены опущением и выпадением тазовых органов в результате ослабления связочно-мышечного аппарата, что приводит к нарушению мочеиспускания и недержанию мочи, ректальной и анальной дисфункции, может вызывать хронический болевой синдром, а также нарушение сексуальной функции. Симптомы могут иметь разную степень выраженности, но носят исключительно прогрессирующий характер, что оказывает существенное влияние на качество жизни, приводит к снижению повседневной активности и социальной дезадаптации пациенток [8–10].
В настоящее время все больше исследователей относят генитальный пролапс к патологии соединительной ткани, этиопатогенез которой может быть обусловлен генетическими факторами, процессами старения и нарушения регенерации тканей. Исследователи из Техасского университета изучали на животных моделях полиморфизм гена FBNL5, кодирующего интегринсвязывающий матрицеллюлярный белок фибуллин-5, который, в свою очередь, участвует в структурном развитии эластогенных тканей [11]. Продемонстрирована не только ассоциативная связь между полиморфизмом FBNL5 и развитием ПТО, но также возможность наследственной передачи патологии. В исследовании с участием человека была выявлена статистически значимая корреляция между полиморфизмом FBNL5 и наличием ПТО III-IV степени [12]. Еще одно направление научного поиска — изучение молекулярных механизмов старения фибробластов, изменения ремоделирования внеклеточного матрикса и появления сенесцентных клеток, а также влияния гормональных факторов на метаболизм коллагена и эластичность тканей [13, 14]. Вместе эти процессы образуют порочный круг, являясь и причиной, и следствием патологии соединительной ткани, что обусловливает прогрессирующий характер ПТО.
Факторы риска развития ПТО включают вагинальные роды ≥2 в анамнезе, акушерскую травму промежности и аборты, массу тела ребенка при рождении, возраст женщины, индекс массы тела, менопаузу, сахарный диабет, дефекты мышц тазового дна, дисплазию соединительной ткани, сопутствующую патологию органов малого таза, другие заболевания и состояния, сопровождающиеся хроническим повышением внутрибрюшного давления, а также образ жизни, связанный с подъемом тяжестей [15–17].
Принимая во внимание патогенез, факторы риска и клинические проявления заболевания, основным методом лечения симптоматического ПТО 2–3 стадии на сегодняшний день является хирургический. Методы хирургической реконструкции, фиксации и укрепления тазовых органов и тканей включают как пластику аутологичными тканями, так и применение различных имплантируемых эндопротезов. При этом частота рецидивов ПТО после пластики собственными тканями составляет 38%, после реконструкции с помощью сетчатых протезов — от 11 до 20% [18, 19].
С 1990-х годов в хирургическом лечении ПТО активно используются полипропиленовые сетчатые импланты, которые, с одной стороны, показали высокую эффективность (вплоть до 80–100%), с другой стороны ассоциируются с серьезными осложнениями, среди которых перфорации органов, кровотечения, эрозии, хронический болевой синдром, сморщивание или врастание импланта в окружающие органы и ткани, инфекционные осложнения, диспареуния, необходимость самокатетеризации мочевого пузыря, рецидив ПТО и повторные хирургические вмешательства [20]. По этому поводу Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) инициировало тщательный многолетний мониторинг безопасности применения полипропиленовых сетчатых имплантов. Это привело не только к изменению класса безопасности соответствующих медицинских изделий и усилению регуляторного надзора, но также к ограничению использования синтетических сеток у бессимптомных пациентов и в целом к более внимательному анализу соотношения польза/риск в отношении каждого пациента, для которого планируется применение этой технологии. В 2019 г. на основании имеющихся данных FDA приостановила продажу синтетических сетчатых эндопротезов на территории США, заключив, что преимущества метода не перевешивают риски [21]. Необходимо отметить, что FDA считает необходимым продолжать наблюдение женщин, которым уже установлены полипропиленовые сетчатые импланты1.
Большинство осложнений применения полимерных эндопротезов обусловлены процессами хронического воспаления и нарушения регенерации тканей, ассоциированными непосредственно с полимерным материалом, из которого изготовлены сетчатые импланты. По этой причине актуальным направлением остается поиск и разработка оптимального материала для изготовления сетчатых эндопротезов нового поколения. Такой материал должен обладать биосовместимостью и биорезистентностью к инфекциям, быть достаточно прочным, но эластичным, иметь минимальный вес, обеспечивать стабильность краев и контура и не препятствовать быстрому росту фибробластов.
Наиболее новой разработкой в этой области является титановый «шелк» – сетчатый эндопротез, выполненный из сверхтонкой титановой нити. Титан — широко используемый биоинертный материал, который при этом отвечает всем требованиям, предъявляемым к современным хирургическим эндопротезам для лечения ПТО. Доклинические исследования сравнения титановых и полипропиленовых сеток показали, что организация фибробластов и активный синтез зрелого коллагена значительно более выражены на титановых эндопротезах [22]. В исследовании результатов 644 хирургических операций по поводу ПТО, проведенном в Германии, было показано, что иммунный ответ, обусловленный активацией макрофагов и высокой экспрессией PD-L1, значительно более выражен в клетках, окружающих нетитанизированный полипропиленовый сетчатый материал, по сравнению с титанизированными сетками [23]. Эти данные коррелируют с ранее полученными у пациенток, перенесших ревизионные операции по поводу эрозии полимерного эндопротеза. При этом в тканях, прилежащих к эндопротезу, был выявлен значительный приток CD68+ и CD163+ макрофагов и выраженная экспрессия PD-L1. Эти находки дают основание предполагать, что эрозия нетитанизированных полимерных имплантов может быть связана именно с выраженным усилением локальной иммунной реакции. Таким образом, сетчатые эндопротезы, выполненные из титанового «шелка», представляют особый интерес в качестве более безопасной альтернативы обычным полипропиленовым материалам. Для изучения возможностей и ограничений применения эндопротезов из титанового «шелка» в хирургическом лечении ПТО и долгосрочных эффектов их использования было проведено исследование на 103 пациентках с диагнозом ПТО 2 и более степени тяжести.
Цель исследования: оценить долгосрочные результаты безопасности и эффективности применения сетчатых эндопротезов, выполненных из титанового «шелка», для хирургического лечения апикального и переднего ПТО у женщин.
Содержание статьи
Материал и методы
Проспективное интервенционное исследование (одобрено клиническим комитетом) проводилось на базе Центра тазовой хирургии Центральной клинической больницы Российской академии наук (ЦТХ ЦКБ РАН, далее «Центр»). В рамках исследования оценивали безопасность и эффективность применения титанового сетчатого эндопротеза для хирургического лечения пациенток с симптоматическим ПТО ≥2 стадии.
Критерии включения в исследование: подтвержденный диагноз симптоматического переднего и апикального ПТО ≥2 стадии по классификации Pelvic Organ Prolapse Quantification (POP-Q); письменное добровольное информированное согласие пациентки на участие в исследовании.
Критерии невключения в исследование: наличие абсолютных противопоказаний к проведению анестезиологического пособия и хирургического вмешательства; тяжелые аллергические реакции в анамнезе как фактор риска отторжения импланта; активная или латентная инфекция органов мочеполовой системы или иной локализации; беременность; злокачественное новообразование любой локализации.
Все пациентки прошли стандартное предоперационное обследование в соответствии с клиническими рекомендациями, стандартами оказания медицинской помощи Российской Федерации.
В рамках исследования пациентки получали хирургическое лечение в объеме билатеральной сакроспинальной и передней трансобтураторной гистерокольпопексии с имплантацией сетчатого эндопротеза, выполненного из титанового «шелка».
Титановый эндопротез представляет собой сетку прямоугольной формы (рис. 1А и B) размерами 11,6×6,0 см на 99,9% состоит из титановой мононити GRADE1, диаметром 60 мкм, поверхностной плотностью 23–35 г/м2, с ячейками не более 1–3 мм; эластичность материала — 38%, пористость — до 94%. Название «титановый “шелк”» обусловлено, прежде всего, мягкостью самого импланта, в котором использована титановая нить толщиной 50–120 мкм.
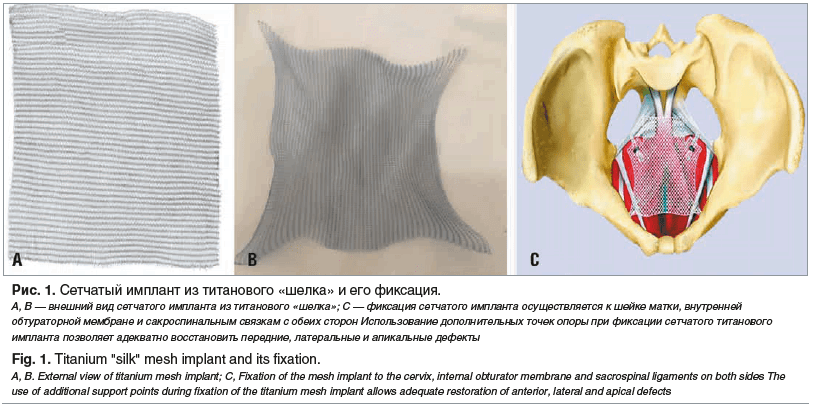
Имплантируемый материал легко режется без распускания структуры, моделируется и возвращается в исходное состояние, не меняя своих характеристик. Изгибы витков позволяют моделировать сетку, вытягивая ее до 30% от изначальной длины, а также возвращать в исходное состояние, растягивая в поперечном направлении (рис. 2). В области перекрещивания волокон изгибы не позволяют титановым нитям плотно прижиматься друг к другу, за счет чего при необходимости происходит скольжение их относительно друг друга. Таким образом, возможно моделирование сетки в любом направлении. Повторяя форму операционной зоны, она легко расправляется.

Изобретение (титановая сетка и способ ее имплантации) зарегистрировано Федеральной службой по интеллектуальной собственности Российской Федерации, патент RU 2688433 C1 от 22.05.2019 [24].
Способ хирургической коррекции опущения матки и передней стенки влагалища (цистоцеле) вагинальным доступом
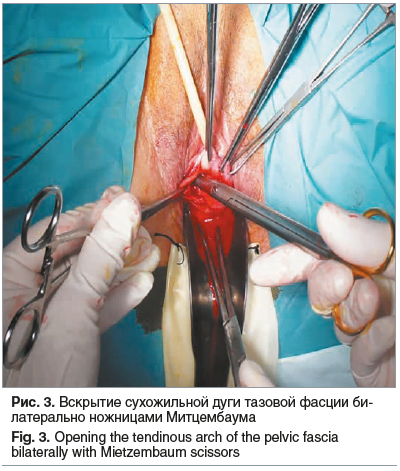
Скальпелем проводится поперечный разрез передней стенки влагалища и лонно-пузырной фасции на протяжении 4–5 см на 4 см выше наружного зева. Передняя стенка влагалища с подлежащей фасцией отсепаровываются острым и тупым путем до шейки мочевого пузыря и латерально с выделением внутренней обтураторной мышцы, седалищной ости и сакроспинальной связки билатерально. Мочевой пузырь тупо смещается кверху, вследствие чего освобождается часть шейки матки для последующей фиксации к ней нижнего края сетки. Сухожильная дуга тазовой фасции вскрывается билатерально ножницами Митцембаума (рис. 3).
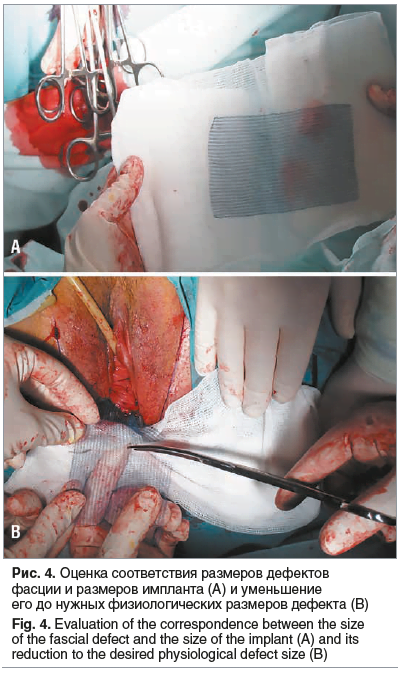
Далее проводится оценка соответствия анатомическим размерам дефектов фасции и размеров (11×6 см) импланта из титанового «шелка» (рис. 4А). В случае необходимости проводится его уменьшение до нужных физиологических размеров дефекта (рис. 4В).
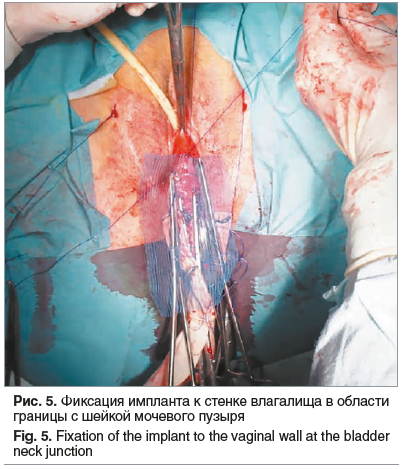
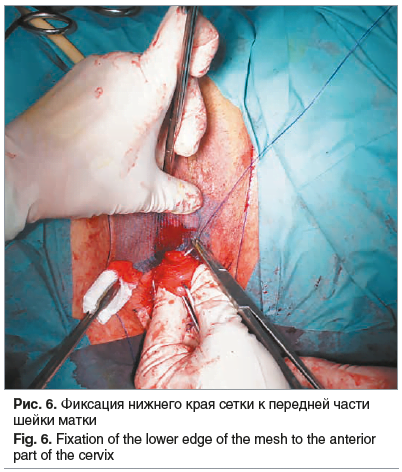
На следующем этапе операции передняя центральная часть импланта фиксируется к стенке влагалища в области границы с шейкой мочевого пузыря двумя швами на 11 и 13 часах синтетическим нерассасывающимся монофиламентным шовным материалом (Пролен 00) (рис. 5). Аналогичная манипуляция проводится с нижним краем сетки, который фиксируется к шейке матки двумя швами на 5 и 7 часах (Пролен 00) (рис. 6).
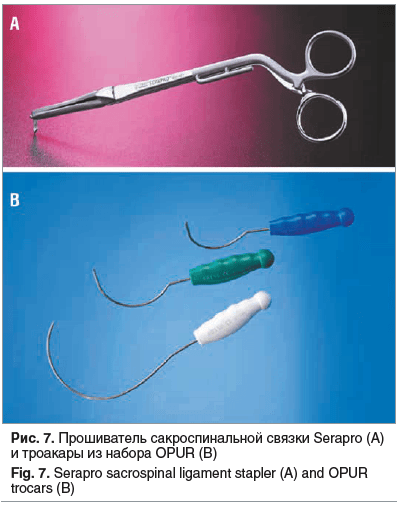
Следующий этап: с помощью специального инструмента (Serapro) (рис. 7А) для прошивания сакроспинальной связки нитью из монофиламентного синтетического рассасывающегося шовного материала (0) проводится билатерально прошивание сакроспинальной связки в области средней ее трети с последующей фиксацией к нижнему вытянутому до 3–4 см углу импланта и постепенным натяжением до физиологического положения передней стенки влагалища.
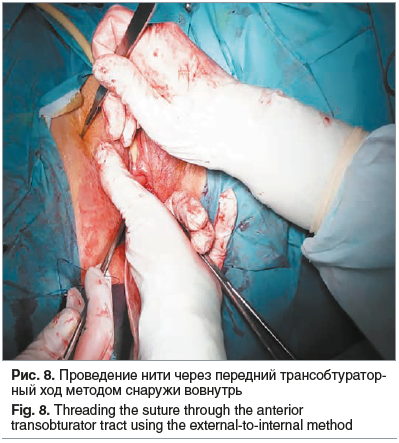
Передние углы импланта после их вытягивания до 3–4 см прошиваются нитью из монофиламентного синтетического рассасывающегося шовного материала (0) с последующим проведением нити специальным троакаром от системы OPUR (рис. 7В) через передний трансобтураторный ход методом снаружи вовнутрь (рис. 8). Проводится натяжение нити до проникновения угла сетки во внутреннюю обтураторную мышцу (свойства титанового «шелка») до физиологического расположения имплантата из титана. Нить над кожными разрезами срезается.
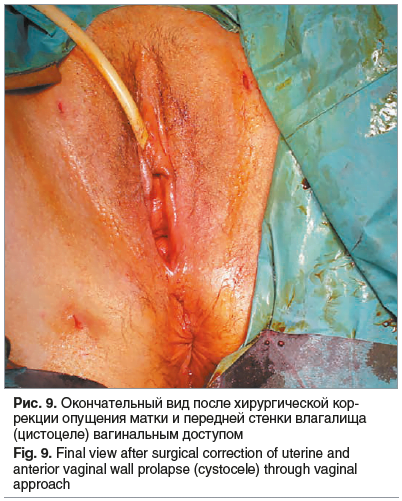
Целостность передней стенки влагалища восстанавливается двухрядным швом из рассасывающегося шовного материала (00). Влагалище обрабатывается раствором антисептика и туго тампонируется марлевым тампоном, пропитанным антибактериальным раствором или мазевой основой и оставляется во влагалище в течение 1 сут. Мочевой катетер и тампон удаляются через сутки. Окончательный вид после операции представлен на рис. 9.
В периоперационном периоде все пациентки получали стандартную профилактику инфекционных осложнений, болевого синдрома и другую сопроводительную терапию в соответствии с действующими клиническими рекомендациями, стандартами медицинской помощи и рутинной практикой Центра. Проводился мониторинг ранних и отсроченных послеоперационных осложнений и других нежелательных явлений.
Все пациентки прооперированы в период с июля 2017 г. по сентябрь 2018 г., период последующего наблюдения составил 6 мес., 12 мес., 36 мес. и 5 лет.
Анализ анатомической эффективности проводился по результатам влагалищного осмотра и данным УЗИ через 6 и 12 мес. после операции.
Для оценки качества жизни пациенток до и после проведенного лечения использовали следующие опросники:
-
оценка дисфункции тазовых органов — опросник Pelvic Floor Distress Inventory из 20 вопросов (PFDI-20);
-
опросник Pelvic Floor Impact Questionnaire из 7 вопросов (PFIQ-7);
-
оценка сексуальной дисфункции — опросник Pelvic Organ Prolaps/Urinary Incontinence Sexual Function Questionnaire из 12 вопросов (PISQ-12).
Опросники заполнялись до операции для оценки текущего состояния, затем сразу после операции и в ходе визитов наблюдения (телефонного интервью). Опросник PFDI-20 отражает степень воздействия функциональных нарушений тазового дна на самочувствие пациентки, чем больше набранный балл, тем сильнее негативное воздействие дисфункций тазового дна на качество жизни пациентки. Опросник PFIQ-7 оценивает влияние функциональных нарушений тазового дна на повседневную активность и психоэмоциональное состояние пациентки, чем выше набранный балл, тем сильнее негативное влияние.
В периоде последующего наблюдения оценивалась частота отсроченных осложнений проведенного лечения, рецидивов ПТО, потребность в ревизионных хирургических вмешательствах, выраженность симптомов ПТО и изменения качества жизни.
Статистическая обработка результатов исследования выполнена с помощью программы Statistica v. 17.0.
Результаты исследования
В исследование было включено 103 пациентки с передним и апикальным ПТО 2 и более стадии. Медиана возраста составила 50,3±7,8 года. У всех пациенток были хотя бы одни вагинальные роды в анамнезе, 55 пациенток перенесли двое родов и в 14 случаях имело место трое и более родов. У 30 (29%) пациенток в анамнезе присутствовали разрывы промежности 2–3 степени. Всем пациенткам хирургическое вмешательство по поводу ПТО выполнялось впервые.
В ходе оперативного вмешательства частота интраоперационных осложнений была незначительна (1 случай кровопотери 1 л, 2 случая ранения мочевого пузыря), все нежелательные явления не были связаны с типом применяемого импланта. Среди ранних послеоперационных осложнений отмечен 1 случай диспареунии. Не были отмечены случаи эрозии, стрессового недержания мочи de novo, укорочения влагалища, постоперационной инфекции. Таким образом, операция по внедрению импланта протекала безопасно и не сопровождалась интраоперационными и послеоперационными осложнениями.
В долгосрочном периоде наблюдения не обнаруживались свищи, тканевые грануляции, пенетрация синтетического материала в уретру и мочевой пузырь и другие возможные осложнения. При осмотре пациенток сетка не была ощутима при пальпации, стенки влагалища в области сетки были подвижны, безболезненны, проба Вальсальвы отрицательная. При УЗИ органов малого таза сетка четко визуализировалась, была подвижна, расправлена, не деформировала стенку мочевого пузыря (рис. 10).
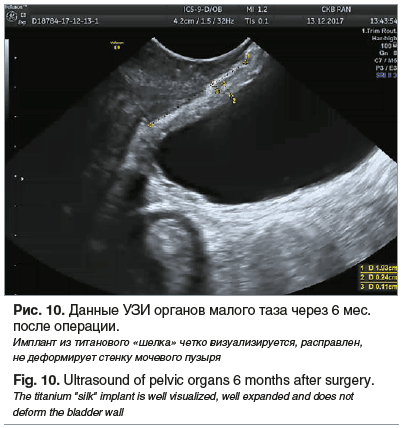
Через 5 лет был осуществлен очередной визит наблюдения, при этом контакт с пациентками, которые не продолжали наблюдение в Центре, осуществлялся посредством телефонного звонка. Из 96 пациенток, которые посетили центр или участвовали в телефонном интервью, у 3 (3%) пациенток присутствовал рецидив цистоцеле. Других нежелательных явлений не отмечалось.
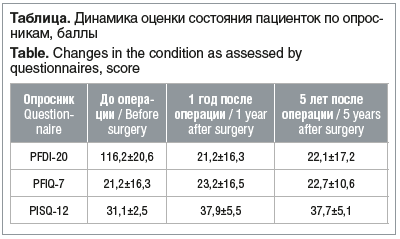
Динамика ответов на вопросы использованных опросников отражена в таблице. При анализе сексуальной жизни мы воспользовались опросником PISQ-12. В результате исследования было выявлено значительное улучшение. Средний показатель до операции составил 31,1±2,5 балла, улучшение отмечено до 37,9±5,5 балла. Субъективную эффективность в отношении мочевой и ректальной дисфункции мы оценивали по результатам опросника PFDI-20. Среди мочевых симптомов мы учитывали синдром недержания мочи (СНМ) de novo, рецидив СНМ, симптомы обструктивного мочеиспускания, ургентность и т. д. До хирургической коррекции, согласно результатам опроса, показатель мочевой дисфункции был равен 21,2±16,3 балла. После операции отмечено значительное улучшение. Субъективно наибольшую положительную динамику претерпели показатели жалоб на ощущение инородного тела в области промежности, необходимость вправлять выпавшие половые органы (грыжевой мешок) для осуществления акта мочеиспускания. До операции этот показатель равнялся 151±18,6 балла, после операции через 6, 12 мес. и 5 лет данный показатель улучшился значительно. Проведенное исследование показало значительное улучшение качества жизни пациенток не только по показателям общепринятых стандартных опросников, но и объективных данных после применения новой органосохраняющей технологии лечения ПТО (переднего и апикального): вагинальной билатеральной сакроспинальной и трансобтураторной гистеропексии с применением сетчатых имплантов из титанового «шелка». До хирургического воздействия, согласно результатам опроса, показатель мочевой дисфункции соответствовал 116,2±20,6 балла. После операции отмечено значительное улучшение.
Согласно результатам обоих опросников, качество жизни пациенток после операции существенно улучшилось, при этом его стабильный уровень сохранялся в течение всего периода наблюдения. Таким образом, долгосрочный эффект хирургического лечения с использованием титанового «шелка» в данной группе можно считать достигнутым.
Обсуждение
Данное исследование было направлено в первую очередь на изучение эффективности и безопасности применения сетчатого эндопротеза из титанового «шелка» в хирургическом лечении пациенток с ПТО 2 и более стадии в долгосрочной перспективе. Многочисленные исследования подтверждают хороший уровень безопасности, эффективности и удовлетворенности пациенток результатами лечения, однако большинство из них предусматривали относительно небольшой период наблюдения. Наиболее длительный период в исследовании на 289 пациентках, проведенном в Германии, составил 3 года [25], при этом в основном проводимые исследования спонсировались производителями эндопротезов. В настоящем исследовании удалось продемонстрировать сохранение эффективности на протяжении 5-летнего периода.
Результаты настоящего исследования согласуются с опубликованными ранее данными, согласно которым в случае применения титанизированных сеток по сравнению с полипропиленовыми практически не встречаются такие осложнения, как эрозии и воспаления, постоперационная реабилитация проходит быстро и безболезненно [26, 27]. Также данные исследования подтверждают существенное улучшение качества жизни пациенток, что не в последнюю очередь объясняется меньшим количеством осложнений и рецидивов.
К ограничениям данного исследования относится состав группы изучаемых пациенток, в которую не вошли пациентки без вагинальных родов в анамнезе, пациентки младше 35 лет, пациентки с онкологическими заболеваниями. Данные категории не являются репрезентативными для популяции пациенток с ПТО, однако среди них это заболевание также встречается. Также в исследовании не учитывалась ранее получаемая пациентками терапия по поводу ПТО (кроме предыдущего хирургического лечения, такие пациентки не включались в исследование). В дальнейшем представляют интерес исследования на стратифицированных группах с изучением большего количества критериев, которые могут оказать влияние на успешность лечения и восстановление качества жизни.
Заключение
Применение сетчатых эндопротезов, выполненных из титанового «шелка», для хирургического лечения апикального и переднего ПТО у 103 женщин привело к устойчивым положительным результатам на протяжении 5-летнего периода наблюдения после операции. Лечение характеризуется благоприятным профилем безопасности и высоким уровнем удовлетворенности пациенток, а также низкой частотой рецидивов.
Сведения об авторах:
Камоева Светлана Викторовна — д.м.н., доцент, профессор кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117513, Россия, г. Москва, ул. Островитянова, д. 1; заместитель главного врача по акушерству и гинекологии АО «К+31» Запад; 121552, Россия, г. Москва, ул. Оршанская, д. 16, стр. 2; ORCID iD 0000-0002-7238-9911.
Маковская Диана Сергеевна — врач акушер-гинеколог, АО «К+31» Запад; 121552, Россия, г. Москва, ул. Оршанская, д. 16, стр. 2; ORCID iD 0000-0003-0159-8641.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Контактная информация: Камоева Светлана Викторовна, e-mail: sv02016@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 15.07.2024.
Поступила после рецензирования 07.08.2024.
Принята в печать 30.08.2024.
About the authors:
Svetlana V. Kamoeva — Dr. Sc. (Med.), Associate Professor, of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Deputy Head Doctor for Obstetrics & Gynecology, JSC «K+31”; 16, build. 2, Orshanskaya str., Moscow, 121552, Russian Federation; ORCID iD 0000-0002-7238-9911.
Diana S. Makovskaya — obstetrician & gynecologist, JSC «K+31”; 16, build. 2, Orshanskaya str., Moscow, 121552, Russian Federation; ORCID iD 0000-0003-0159-8641.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-7830-2290.
Contact information: Svetlana V. Kamoeva, e-mail: sv02016@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 15.07.2024.
Revised 07.08.2024.
Accepted 30.08.2024.
1U.S. Food and Drug Administration. Urogynecologic Surgical Mesh Implants. (Electronic resource.) URL: https://www.fda.gov/medical-devices/implants-and-prosthetics/urogynecologic-surgical-mesh-implants (access date: 22.09.2024).
Информация с rmj.ru


