Введение
На протяжении последних десятилетий наблюдается рост нейродегенеративных заболеваний и патологических состояний с когнитивным дефицитом. Особое значение стали придавать изучению патологии мозга, обусловленной генетически. В числе таких оказалась гепатолентикулярная дегенерация (ГЛД), или болезнь Вильсона — Коновалова, основу патогенеза которой составляет дефект метаболизма меди, обусловленный мутациями в гене ATP7B. Снижение экскреции меди из организма приводит к накоплению металла в органах и в мозге с развитием различных клинических проявлений, включая печеночную недостаточность, неврологические и психические расстройства [1]. Ядро неврологических проявлений ГЛД составляют моторные дефекты экстрапирамидного происхождения и нарушения психики. Реже встречаются признаки поражения корковых структур, выступающие основой экстрапирамидно-корковой формы заболевания. Они проявляются эпилептическими приступами и тяжелым слабоумием, провоцируя дискуссии о первичности происхождения данной формы патологии. Ранние проявления когнитивной дисфункции при ГЛД способны приводить к значительным ограничениям усвоения и переработки информации, снижая качество жизни пациентов1. Выяснение механизмов развития когнитивной дисфункции при данной патологии представляет особый интерес не только для диагностики ГЛД, но и для разработки современных систем реабилитации больных с когнитивным дефицитом [2].
Для решения данной проблемы необходим выбор технологий, позволяющих объективно оценивать работу мозговых структур, участвующих в реализации когнитивных функций. В клинике их оценка строится на системе тестирования, разработанной А.Р. Лурией в середине прошлого века. Эта система, несмотря на простоту использования, направлена на определение результирующей составляющей когнитивного процесса, а не на выяснение механизма реализации высших нервных функций. Кроме того, она требует значительных временных затрат на проведение эксперимента и чувствительна к текущему состоянию пациента (тревожности и депрессии).
Поскольку реализация высших нервных функций обеспечивается быстропротекающими мозговыми процессами, ее изучение требует разработки таких методических подходов, которые способны их фиксировать. Учитывая, что наиболее адекватно активность мозговых сетей отражают результаты нейрофизиологических методов, особенно тех, которые реализованы на основе современных электроэнцефалографических (ЭЭГ) систем, именно их совершенствование стало основой современных исследований.
В 1990 г. D. Lehmann установил возможность регистрации активности отдельных нейронных групп посредством анализа ЭЭГ-сигнала. Наблюдая за отдельными вариантами поверхностного потенциала головы, он пришел к выводу, что они отражают генерацию стабильных нейронных пулов, синхронно продуцирующих электрическую активность мозга, их можно представить последовательностью фиксированных во времени паттернов продолжительностью около 40–120 мс [3]. Эти конфигурации получили название ЭЭГ-микросостояний. Длительность отдельного микросостояния отражает сохранность и стабильность функционирования его нейронной сборки, а частота регистрации — активность (активацию) нейронных генераторов во время реализации исследуемой мозговой функции [4]. Однако регистрация отдельных ЭЭГ-микросостояний еще не позволяла определять, какие мозговые структуры (сети) являются источниками регистрируемой активности и насколько данный процесс специфичен для мыслительного процесса. Эту проблему в 1994–1997 гг. решили R.D. Pascual-Marqui et al. [5], предложив систему решения обратной задачи ЭЭГ. В основу ее построения положен принцип совмещения дипольной локализации с послойной моделью головы. Эта технология получила наименование электромагнитной томографии низкого разрешения (LORETA).
Анализируя последовательность ЭЭГ-микросостояний, исследователь получал возможность не только судить о характеристиках работы крупных мозговых сетей, но и сравнивать их между собой. В ходе проведения исследований оказалось, что у разных людей исследуемые ЭЭГ-сигналы абсолютно не связаны между собой. Поэтому необходим сравнительный анализ событий. Однако при сравнении записей ЭЭГ было обнаружено, что из-за отсутствия единой начальной точки события фазы ЭЭГ-сигнала смещаются и препятствуют достижению высокой точности. Это не позволяло применять традиционные методы корреляции и когерентности сигнала. Для решения данной проблемы D. Lehmann предложил посредством процедуры кластеризации разделять непрерывный поток ЭЭГ-данных на отдельные составляющие и создавать массив из отдельных участков записи, имеющих схожие электрофизиологические характеристики (микросостояния), сохраняя стабильность основных показателей. I. Neuner et al. [6] в ходе проведения симультанных исследований ЭЭГ-коррелированной функциональной магнитно-резонансной томографии (фМРТ) пришли к выводу, что технология LORETA выявляет отдельные дефолтные сети, имеющие специфическую «электрофизиологическую подпись», созданную комбинацией различных мозговых ритмов, отражающих те или иные предполагаемые функции. Именно изучение автономно функционирующих частей единой мозговой сети, напрямую связанных с индивидуальными характеристиками мышления, может сформировать диагностический метод оценки активности отдельных мозговых структур. Технологии такого кластерного анализа позволяют выявить до 39 отдельных ЭЭГ-микросостояний, но максимальной репрезентативности удается добиться только у 2–8 первых классов, отвечающих за реализацию базовых и наиболее устойчивых мозговых функций, нарушение которых в клинике отражается тяжелыми изменениями психической сферы [7].
В 1999 г., добавив к статистическому параметрическому картированию с высоким временным разрешением методику определения количественной нейроанатомии, разработанную Центром визуализации Монреальского неврологического института (MNI) на основе шаблонов, создатель технологии LORETA представил нейрофизиологическую разработку, уровень которой сравним с такими классическими методами функциональной визуализации, как позитронно-эмиссионная томография и фМРТ.
Так, с помощью комбинации технологий выделения отдельных ЭЭГ-микросостояний с методом решения обратной задачи ЭЭГ был разработан подход к нейрофизиологическому изучению отдельных нейронных структур головного мозга. Обладая достаточной пространственной точностью при меньшей временной задержке для исполнения, он стал инструментом исследования активности нейронных структур, не уступающим по информативности методам нейрорадиовизуализации, которые уже широко применялись в клинике.
Работа головного мозга реализуется через активность либо отдельных нейронных сетей, либо автономно функционирующих частей единой мозговой сети, способных проявлять свою активность не только в режиме активной деятельности, но и в периоды относительного покоя как элементы, напрямую связанные с индивидуально-личностными характеристиками человеческого мышления [8].
В 2018 г. J.M. Kernbach et al. [9] высказали предположение о делении единой дефолтной сети на сети «внутренней» и «внешней» систем, которые предназначены для раздельной обработки входящей и исходящей информации.
Основная нейронная сеть пассивной работы мозга включает заднюю медиальную кору, медиальную префронтальную кору и височно-теменное соединение, объединяя области оценки информации с областями ее анализа. Эта конструкция рассматривается как некая «внутренняя система» с высокой активностью в состоянии покоя, но снижающая ее во время выполнения экспериментальных задач [10]. Поскольку состояние пассивного расслабленного бодрствования с закрытыми глазами воспроизводится у разных людей с большей репрезентативностью, чем отдельные виды нагрузочных проб, то наиболее убедительным следует признать анализ активности сетей пассивной работы головного мозга [10].
Изменение их характеристик в значительной степени зависит от структурных изменений анатомических образований, формирующих нейронные сети. Поэтому при отсутствии органического субстрата анализ частоты представленности каждого из выделяемых ЭЭГ-микросостояний может не отличаться от условно нормальных величин. Это наблюдается у больных с генетическими формами эпилепсии, когда из-за высокой возбудимости нейронов коры головного мозга исследователь не может посредством технологий нейровизуализации обнаружить органические изменения. В таких условиях заболевание изменяет функциональную последовательность возбуждения корковых структур [11, 12].
Однако все перечисленные предположения нуждались в объективном подтверждении с проведением большого объема исследовательских работ.
Цель исследования: изучить механизмы развития когнитивной дисфункции у пациентов с генетически подтвержденным диагнозом ГЛД с помощью нейрофизиологических методов на основе современных ЭЭГ-систем.
Содержание статьи
Материал и методы
Объектом исследования стали 24 пациента-европеоида (13 женщин и 11 мужчин) с диагностированной неврологической стадией ГЛД, подтвержденной генетически, — основная группа. Средний возраст обследованных составил 29,76±4,21 года. Все пациенты сохраняли активность в повседневной жизни (АПЖ), у всех носительство гена АТР7В было в гомозиготном состоянии, в том числе у 10 пациентов установлена мутация His1069Gln, у 7 — мутация 2304insC, у 4 — мутация Glu1064Lys, у 2 — мутация 3402delC и еще у 1 пациента — мутация Gly710Ser. Группу сравнения составили 24 здоровых испытуемых того же возраста и пола.
В основу клинического исследования положены диагностические критерии Лейпцигской шкалы 2001 г. с учетом установления степени тяжести клинических проявлений.
Молекулярно-генетическое исследование было направлено на выделение в гене АТР7В каузальных мутаций секвенированием гена ATP7B по Сенгеру.
Нейропсихологическое исследование проводилось с использованием шкал MoCA, HADS для определения степени когнитивного дефицита, уровня тревоги и депрессии.
Нейрофизиологическое обследование включало ЭЭГ-исследование, проводимое на 52-канальном био-усилителе отечественного производства (г. Зеленоград) с базовой частотой аналогово-цифрового преобразователя 500 Гц, что позволяло уверенно получать данные в диапазоне от 1 до 250 Гц без потерь информативности. Полученную информацию обрабатывали на ПЭВМ в пакете программ sLORETA v20210701, Швейцария (University of Zurich; Switzerland), а также путем реализации технологических прототипов с помощью интерпретируемых пакетов программ EEGLAB и BRAINSTORM, реализованных под управлением системы MATLAB (Mathworks ver. 98, США).
Для определения тяжести неврологических проявлений ГЛД учитывались дефекты АПЖ и сумма баллов семи признаков (дизартрия, тремор, атаксия, ригидность/брадикинезия, хорея/дистония, когнитивный дефицит с учетом показателей шкал MoCA, HADS, эпилептические приступы), которые оценивались по 3-балльной шкале: 0 баллов — отсутствие признаков, 1 балл — 1–2 признака, 2 балла — 3–4 признака, 3 балла — 5–7 признаков.
При выделении степеней тяжести клинических проявлений учитывались следующие показатели балльной оценки: легкая — 1 балл и отсутствие дефектов АПЖ; средняя степень — 2–3 балла, но дефекты АПЖ отсутствуют; тяжелая — 2–3 балла с дефектами АПЖ.
Статистическую обработку данных проводили с использованием программного пакета SPSS Statistics ver. 23.0 (IBM, США). Нормальность распределения проверяли с помощью теста Колмогорова — Смирнова, статистическую значимость различий устанавливали с помощью критерия χ2.
Результаты исследования
Ядро клинических проявлений у всех обследованных составляли моторные дефекты экстрапирамидного происхождения и расстройства психики в сочетании с признаками поражения внутренних органов. Среди дефектов моторики преобладали сложные гиперкинезы (49%), когда дистонические феномены объединялись с миоклониями и хореиформными подергиваниями, неритмичным дрожанием, баллизмом и тоническим напряжением. Однако в каждом конкретном случае наблюдался индивидуальный ритм мышечных подергиваний, их комплексация и неповторимый характер признаков патологии других органов. В зависимости от ведущего синдрома были выделены следующие формы ГЛД: дрожательная (у 10 пациентов), аритмо-гиперкинетическая (у 9), дрожательно-ригидная (у 2) и экстрапирамидно-корковая (у 3).
Наиболее демонстративно клинический диагноз ГЛД подтверждали: результаты УЗИ органов брюшной полости, МРТ головного мозга, микроофтальмоскопии. Так, по данным УЗИ, частота визуализации изменений органов брюшной полости и почек достигает 75% (до 80% у больных с легкой и 100% у пациентов со средней степенью тяжести ГЛД).
При МРТ головного мозга визуализировались специфические для ГЛД изменения в 39% случаев с максимумом по частоте выявления у больных со средней степенью тяжести патологии и мутацией His1069Gln. Структурных дефектов в коре головного мозга зарегистрировано не было.
Кольцо Кайзера — Флейшера при офтальмологическом обследовании было обнаружено в 32% случаев почти в равных долях у пациентов с разной степенью тяжести ГЛД. Желтуха в анамнезе была установлена в 14% случаев.
У 14 пациентов (средний возраст 29,9 года) была установлена легкая степень тяжести клинических проявлений ГЛД, у 10 больных (средний возраст 24,7 года) — средняя.
В структуре нейропсихологического дефекта (табл. 1) ведущее место занимали нарушения планирования любых видов деятельности и концентрации внимания, которые сопровождались мнестическим дефектом, нарушением устного счета, провоцируя ошибки при выполнении заданий, формируя поведенческие нарушения и невротические реакции. Нарушения плана действий достоверно чаще наблюдались у больных со средней степенью тяжести ГЛД.
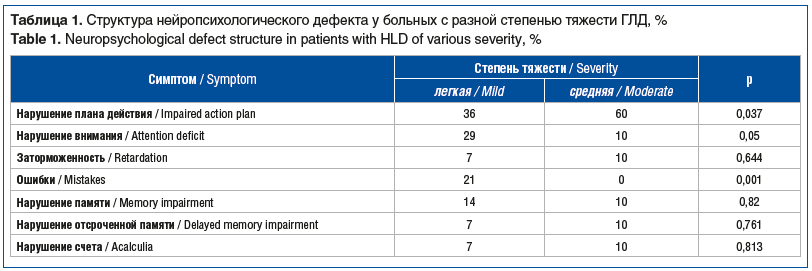
В таблице 2 представлены данные клинического тестирования тревоги и когнитивных функций с помощью шкал MoCA и HADS.
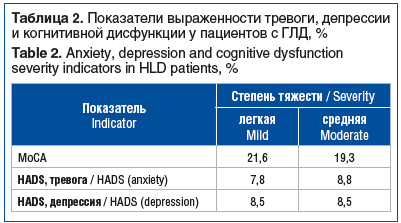
У пациентов отчетливо наблюдалась зависимость выраженности тревоги и когнитивных дисфункций от степени тяжести ГЛД.
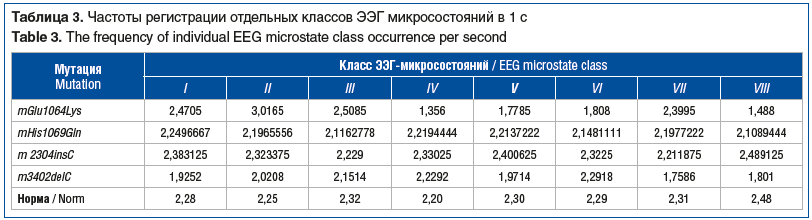
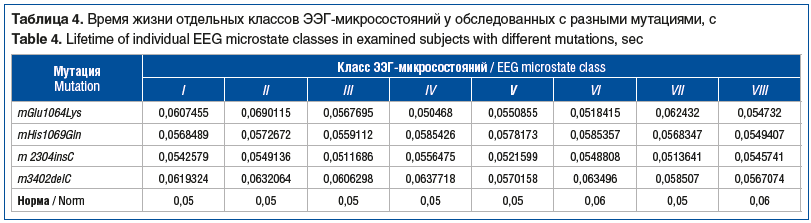
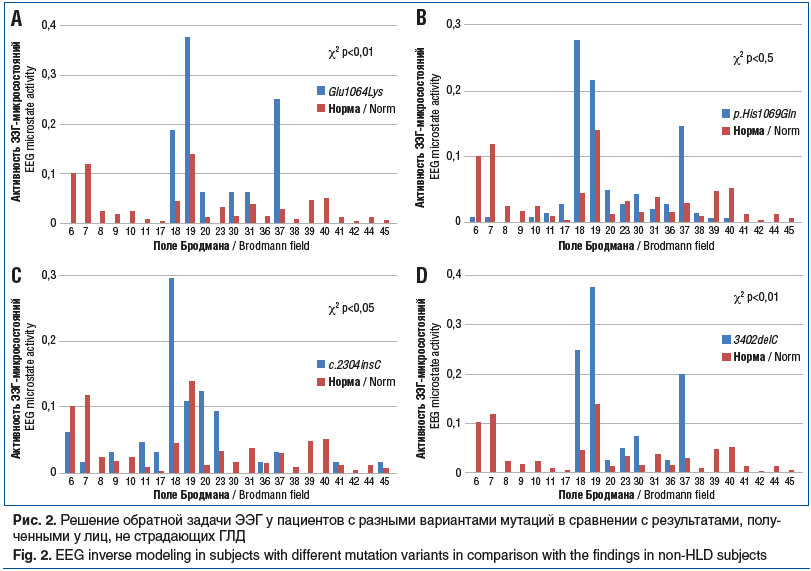
В таблицах 3, 4 и на рисунке 1 представлена характеристика активности отдельных мозговых структур по показателям кластерного анализа ЭЭГ-микросостояний у больных с разными типами мутаций в гене АТР7В.
Обсуждение
Нейропсихологическое исследование с использованием тестирования по шкалам МоСА и HADS показало, что у больных ГЛД основу когнитивного дефицита составляет нарушение построения программы и планирования деятельности на фоне дефицита концентрации внимания и изменения скорости его распределения. Именно они влекут за собой ошибки при выполнении тестовых заданий. Независимо от типа мутации в гене АТР7В и степени тяжести клинических проявлений у всех больных уровень тревоги и депрессии оказывается высоким, не превышая субклинические показатели, а выраженность когнитивного дефицита колеблется в его средних значениях.
Выраженность когнитивного дефекта и тревоги зависела не от типа мутации в гене АТР7В, а от степени тяжести клинических проявлений ГЛД, достигая максимума у больных со средней степенью тяжести патологии, что согласуется с данными F.T. Kirk et al. [13].
Анализ показателей 8 классов ЭЭГ-микросостояний ГЛД также не обнаружил зависимости характера распределения биоэлектрической активности от степени тяжести клинических проявлений патологии и от типа мутации в гене АТР7В.
Функциональные изменения не только не зависели от типа мутации в гене АТР7В, но отчетливо демонстрировали воздействие на те области коры головного мозга, которые ответственны за визуальный анализ и определение лица. Это согласуется с результатами исследования L. Henderson et al. [14].
Высокий уровень субклинической тревоги и средний — показателей когнитивного дефицита при отсутствии визуализации на МРТ структурных дефектов в коре головного мозга свидетельствуют о том, что у всех обследованных когнитивный дефект обусловлен изменением деятельности базальных ганглиев с вторичным воздействием патологической импульсации на корковые структуры. Это находит отражение в приобретении сходства характеристик когнитивного дефицита у пациентов с разными типами мутаций в гене АТР7В, что согласуется с результатами исследования S. Shribman et al. [15] и подтверждает мнение N. Gutierrez-Avila et al. [16] о развитии при ГЛД «синдрома нарушений лобно-стриарных взаимоотношений» в виде своеобразного нейрокогнитивного дефекта, который, возникая на фоне снижения вербальной и зрительной памяти, характеризуется замедленностью мышления и сопровождается сложностью произношения.
Поражение базальных ганглиев приводит к развитию не только двигательных дисфункций по типу локальных и генерализованных дистоний, но и неритмичного дрожания, других быстрых и медленных гиперкинезов, которые, привлекая внимание окружающих, вынуждают больного находиться в постоянной готовности к сопротивлению активности своего тела [17, 18].
Согласно мнению T. Litwin et al. [19] именно высокий уровень тревоги, выступая на первый план, способен провоцировать психозы.
Заключение
Проведенное исследование демонстрирует широкие возможности использования современных нейрофизиологических методов, реализованных на основе ЭЭГ-систем. Это позволяет проанализировать вовлеченность мозговых структур при выполнении сложных мыслительных задач, роль отдельных областей в возникновении различных когнитивных нарушений, степени их выраженности и характера повреждения корковых зон, ответственных за мыслительные процессы, что представляет особый интерес как в диагностике заболеваний, сопровождающихся нарушением высших корковых функций на раннем этапе, так и в разработке современных систем реабилитации больных с когнитивными нарушениями. Использование метода оценки ЭЭГ-микросостояний для изучения когнитивных процессов дает возможность изучать работу мозговых структур на различных клинических моделях и рассматривать ГЛД как одну из естественных клинических моделей для изучения механизмов развития когнитивных нарушений в целом.
1Министерство здравоохранения Российской Федерации. Клинические рекомендации «Диагностика и лечение болезни Вильсона — Коновалова (гепатолентикулярная дегенерация)», 2021.
Сведения об авторах:
Овчинникова Елена Васильевна — аспирант ФГБУ НМИЦ ПН им. В.М. Бехтерева Минздрава России; 192019, Россия, г. Санкт-Петербург, ул. Бехтерева, д. 3; ассистент департамента клинической медицины ФГАОУ ВО ДВФУ; 690922, Россия, г. Владивосток, о. Русский, п. Аякс, д. 10; врач-невролог ГБУЗ «ПККБ № 1»; 690091, Россия, г. Владивосток, ул. Алеутская, д. 57; ORCID iD 0000-0002-4106-1163
Шнайдер Наталья Алексеевна — д.м.н., главный научный сотрудник, заместитель руководителя Института персонализированной психиатрии и неврологии ФГБУ НМИЦ ПН им. В.М. Бехтерева Минздрава России; 192019, Россия, г. Санкт-Петербург, ул. Бехтерева, д. 3; профессор ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0002-2840-837X
Овчинникова Анна Александровна — д.м.н., профессор департамента клинической медицины ФГАОУ ВО ДВФУ; 690922, Россия, г. Владивосток, о. Русский, п. Аякс, д. 10; ORCID iD 0000-0002-6336-8166
Насырова Регина Фаритовна — д.м.н., профессор, главный научный сотрудник, руководитель Института персонализированной психиатрии и неврологии ФГБУ НМИЦ ПН им. В.М. Бехтерева Минздрава России; 192019, Россия, г. Санкт-Петербург, ул. Бехтерева, д. 3; ORCID iD 0000-0003-1874-9434
Гуляев Сергей Александрович — д.м.н., начальник отдела симуляционных технологий инженерно-физического института биомедицины, доцент кафедры фундаментальной медицины; ФГАОУ ВО НИЯУ МИФИ; 115409, Россия, г. Москва, Каширское ш., д. 31; ORCID iD 0000-001-9122-7144
Контактная информация: Овчинникова Елена Васильевна, e-mail: ovchinnikovaelv@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 04.08.2024.
Поступила после рецензирования 27.08.2024.
Принята в печать 19.09.2024.
About the authors:
Elena V. Ovchinnikova — postgraduate student, V.M. Bekhterev National Research Medical Center for Psychiatry and Neurology; 3, Bekhterev str., St. Petersburg, 192019, Russian Federation; Assistant of the Department of Clinical Medicine, Far Eastern Federal University; 10, Ajax Village, Russky Island, Vladivostok, 690922, Russian Federation; neurologist, Primorye Territory Clinical Hospital No. 1; 57, Aleutskaya str., Vladivostok, 690091, Russian Federation; ORCID iD 0000-0002-4106-1163
Natalia A. Schneider — Dr. Sc. (Med.), Chief Scientific Officer, Deputy Head of the Institute of Personalized Psychiatry and Neurology, V.M. Bekhterev National Research Medical Center for Psychiatry and Neurology; 3, Bekhterev str., St. Petersburg, 192019, Russian Federation; Professor, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-2840-837X
Anna A. Ovchinnikova — Dr. Sc. (Med.), Professor of the Department of Clinical Medicine, Far Eastern Federal University; 10, Ajax Village, Russky Island, Vladivostok, 690922, Russian Federation; ORCID iD 0000-0002-6336-8166
Regina F. Nasyrova — Dr. Sc. (Med.), Professor, Chief Scientific Officer, Head of the Institute of Personalized Psychiatry and Neurology, V.M. Bekhterev National Research Medical Center for Psychiatry and Neurology; 3, Bekhterev str., St. Petersburg, 192019, Russian Federation; ORCID iD 0000-0003-1874-9434
Sergey A. Gulyaev — Dr. Sc. (Med.), Head of the Department of Simulation Technologies, Engineering Physics Institute of Biomedicine, Assistant Professor of the Department of Fundamental Medicine; National Research Nuclear University MEPhI; 31, Kashirskoe road, Moscow, 115409, Russian Federation; ORCID iD 0000-001-9122-7144
Contact information: Elena V. Ovchinnikova, e-mail: ovchinnikovaelv@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 04.08.2024.
Revised 27.08.2024.
Accepted 19.09.2024.
Информация с rmj.ru






