Введение
Вспомогательные репродуктивные технологии (ВРТ) стали неотъемлемой частью современной медицины и играют ключевую роль в лечении бесплодия [1]. В многочисленных научных исследованиях подтвержден высокий риск акушерских осложнений при беременности, наступившей после экстракорпорального оплодотворения [2–4].
Результаты, представленные в метаанализах [3, 4], свидетельствуют о значимом повышении риска развития гестационного сахарного диабета (ГСД) при беременности, наступившей после использования ВРТ. При этом ряд авторов полагают, что индуцированная беременность, протекающая на фоне ГСД, значительно чаще осложняется развитием материнских и перинатальных осложнений по сравнению со спонтанно наступившей беременностью [5–7].
Гестационный сахарный диабет — полигенное многофакторное заболевание, триггером реализации которого являются эпигенетические влияния при наличии определенных ассоциаций полиморфизмов генов [2, 8, 9]. Реализация перинатальных осложнений на фоне ГСД детерминирована генетической сетью функционально неблагоприятных полиморфизмов аллелей определенных групп генов [10, 11].
Гены углеводного обмена участвуют в регуляции метаболизма углеводов, являясь ключевым звеном в патогенезе развития нарушений углеводного обмена. Анализ носительства полиморфных вариантов генов — регуляторов липидного и углеводного обмена, эндотелиальной функции и ангиогенеза определяет персонифицированный подход к выявлению пациенток с высоким риском развития перинатальных осложнений, ассоциированных с ГСД, при наступлении беременности после применения программ ВРТ.
Цель исследования: оценить влияние носительства полиморфизмов генов липидного и углеводного обмена, тонуса сосудов и ангиогенеза на развитие осложнений ГСД у пациенток с беременностью, наступившей в результате применения программ ВРТ.
Материал и методы
Проведено сплошное когортное исследование. Основная группа (n=123), которую составили пациентки с беременностью, наступившей в результате применения ВРТ, с ГСД, была разделена на 2 подгруппы: 1А — беременные с перинатальными осложнениями (n=76); 1Б — беременные без перинатальных осложнений (n=47). В группу сравнения (n=105) вошли пациентки с беременностью, наступившей в результате ВРТ, без ГСД. Среди перинатальных осложнений, анализируемых в исследовании, были преэклампсия (ПЭ), плацентарная недостаточность (ПН), реализуемая в виде задержки роста плода, малого размера плода для гестационного срока, макросомии, а также осложнений послеродового периода. Диагноз ГСД устанавливали согласно критериям Российского национального консенсуса по ГСД [7].
Исследование одобрено локальным этическим комитетом ФГБУ «НИИ ОММ» Минздрава России. У всех женщин до начала исследования было получено добровольное информированное согласие на включение в исследование, обработку и использование биологического материала и персональных данных.
Молекулярно-генетическое исследование полиморфных вариантов генов — регуляторов обмена липидов (ApoB Pro2739leu G>A; rs676210), углеводного обмена (PPARG P12A, C>G; rs180122; IVS3 C>T; rs7903146), регуляторов ангиогенеза (VEGF-A: -634 G>C; rs2010963) и тонуса сосудов (eNOS Glu298Asp G894T G>T; rs1799983) проводили методом аллель-специфичной ПЦР в режиме реального времени. Оценку результатов выполняли с использованием программного обеспечения ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистический анализ выполнен с использованием программы SPSS Statistics, версия 22.0 (IBM Microsoft, США). Для проверки отклонения распределения вероятностей от нормального распределения использовали критерий проверки на симметричность и критерий Шапиро — Уилка. Данные, не подчиняющиеся закону нормального распределения, представлены как Ме [25%; 75%], где Ме — медиана, 25% и 75% — 25-й и 75-й процентили. Для качественных показателей, в том числе частот генотипов и аллелей, статистическую значимость различий определяли с использованием критерия хи-квадрат (χ2). Оценивали отношение шансов (OШ) с 95% доверительным интервалом (ДИ). Различия считали статистически значимыми при p<0,05. Тест на соответствие распределения генотипов закону Харди — Вайнберга проводили с использованием программы Hardy — Weinberg equilibrium.
Содержание статьи
Результаты исследования
Пациентки после применения программ ВРТ с беременностью, осложнившейся ГСД, были старше, чем пациентки без ГСД (37 [34; 40] лет против 34 [30; 36,5] лет; р<0,05). У пациенток основной группы индекс массы тела, определенный в I триместре, был значимо выше, чем в группе сравнения: 30,3 [26,0; 32,3] кг/м2 против 26,1 [24,3; 30,0] кг/м2 соответственно (p<0,05).
Пациентки после ВРТ с ГСД значимо чаще страдали заболеваниями сердечно-сосудистой системы (OШ 3,84, 95% ДИ 1,23–11,96, р=0,003), гипотиреозом (OШ 5,53, 95% ДИ 1,42–21,29, р=0,008) и хроническими болезнями мочевыделительной системы (OШ 4,96, 95% ДИ 1,47–16,92, р=0,007). Беременность после ВРТ и на фоне ГСД статистически значимо чаще, чем без ГСД, осложнялась развитием умеренной (ОШ 1,083, 95% ДИ 1,11–77,52, р=0,04) и тяжелой (ОШ 1,038, 95% ДИ 1,08–69,52, р=0,04) ПЭ, формированием макросомии плода (ОШ 6,05, 95% ДИ 1,24–29,541, р=0,023) и развитием послеродового кровотечения (ОШ 9,27, 95% ДИ 1,11–75,21, р=0,016).
Характер распределения аллелей и генотипов по полиморфным вариантам изученных генов — регуляторов обмена липидов, углеводного обмена, ангиогенеза и тонуса сосудов соответствовал закону равновесия Харди — Вайнберга.
Установлено, что гомозиготный вариант гена PPARG P12A СС регистрировалcя статистически значимо чаще у пациенток с беременностью после ВРТ, осложнившейся ГСД (ОШ 2,463, 95% ДИ 1,43–4,25, p=0,002). Минорный гомозиготный вариант генотипа PPARG P12 GG, напротив, значимо снижал риски в отношении ГСД у пациенток после ВРТ (ОШ 0,331, 95% ДИ 0,15–0,72, p=0,004) (табл. 1).
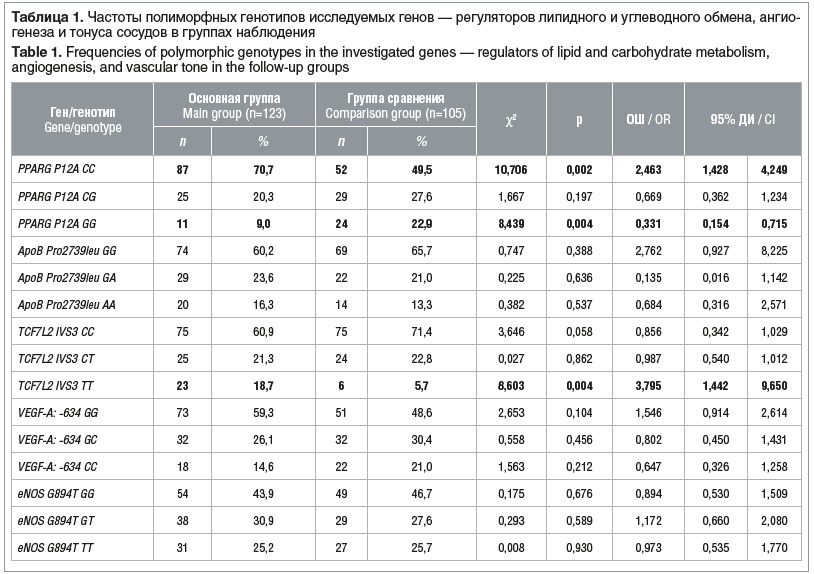
Установлена ассоциация полиморфного варианта гомозиготного генотипа TCF7L2 IVS3 TT с наличием ГСД у пациенток после ВРТ (ОШ 3,795, 95% ДИ 1,44–9,65, p=0,004) (см. табл. 1).
Распределение частот аллелей по полиморфным локусам исследуемых генов показало, что носительство полиморфного аллеля С в локусе P12A гена PPARG статистически значимо ассоциировано с риском развития ГСД у пациенток после ВРТ (ОШ 2,451, 95% ДИ 1,604–3,746, p=0,001). Напротив, аллель G в локусе P12A гена PPARG обладает защитным эффектом в отношении ГСД у пациенток с беременностью, наступившей в результате ВРТ (ОШ 0,408, 95% ДИ 0,267–0,623, p=0,001). Установлено, что носительство полиморфного аллеля Т в гене TCF7L2 IVS3 ассоциировано с риском развития ГСД у пациенток с беременностью, наступившей после ВРТ (ОШ 2,069, 95% ДИ 1,461–3,521, p=0,002) (табл. 2).
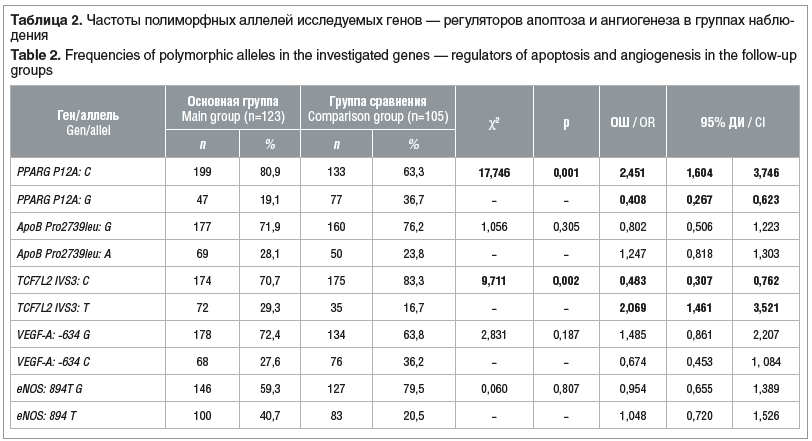
С целью определения генетической предрасположенности к формированию перинатальных осложнений на фоне ГСД у пациенток после ВРТ проведен анализ частот полиморфных аллелей и генотипов генов PPARG (P12A C>G), TCF7L2 (IVS3 C>T), ApoB (Pro2739leu G>A), VEGF-A: -634 G>C, eNOS (Glu298Asp G894T G>T) у женщин подгруппы 1А (пациентки с перинатальными осложнениями ГСД) и подгруппы 1Б (пациентки без перинатальных осложнений ГСД).
Среди пациенток подгруппы 1А статистически значимо чаще встречались минорные гомозиготы VEGF-A: -634 CC по полиморфному маркеру VEGF-A: -634 G>C (χ2=4,145, ОШ 3,607, 95% ДИ 1,084–13,218, р=0,042) и минорные гомозиготы eNOS (G894T) TT по полиморфному маркеру eNOS (G894T G>T) (χ2=4,289, ОШ 2,480, 95% ДИ 1,689–6,351, р=0,039) (табл. 3).
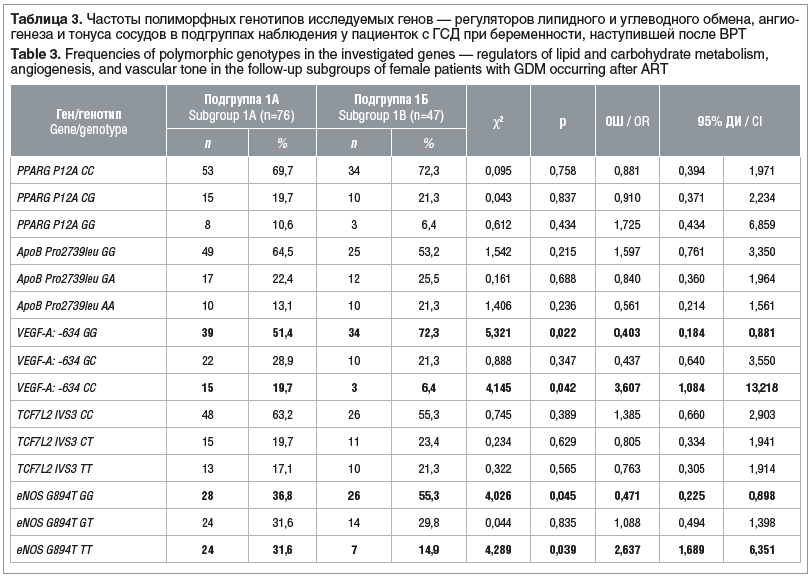
В подгруппе женщин без перинатальных осложнений ГСД после ВРТ, напротив, значимо чаще отмечались генотипы доминантных гомозигот VEGF-A: -634 GG по полиморфному маркеру VEGF-A: -634 G>C (χ2=5,321, р=0,022) и доминантных гомозигот eNOS (G894T) GG по полиморфному маркеру eNOS (G894T G>T) (χ2=4,026, р=0,045) (см. табл. 3).
Анализ распределения аллелей исследуемых генов показал более высокую частоту выявления вариантного аллеля С полиморфного локуса VEGF-A: -634 G>C у женщин подгруппы 1А (χ2=8,058, ОШ 2,535, 95% ДИ 1,34–4,778, р=0,004) (табл. 4).
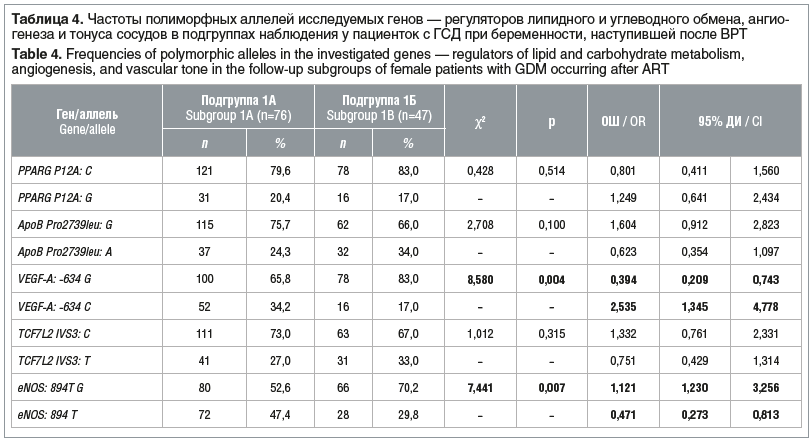
Такая же тенденция выявлена и для полиморфизма G894T G>Т гена eNOS: частота вариантного аллеля Т гена eNOS G894T была статистически значимо выше у женщин подгруппы 1А по сравнению с женщинами подгруппы 1Б (χ2=7,411, ОШ 1,121, 95% ДИ 1,230–3,256, р=0,007) (см. табл. 4).
Обсуждение
Установлено, что чувствительность тканей к инсулину регулируется работой ядерного рецептора PPARγ, являющегося фактором транскрипции. Развитие инсулинорезистентности, дислипидемии, гипертензии и ожирения сопровождается нарушением обмена жирных кислот, что обусловлено мутацией в гене PPARG Pro12Ala, C>G; rs180122, вызывая изменение рецептора PPARγ2 [12]. Установлено, что мажорные гомозиготы по Pro12Pro отличаются более выраженной инсулинорезистентностью, ожирением, дислипидемией и гипертензией и имеют более высокий риск развития сахарного диабета 2 типа (СД2) по сравнению с носителями минорного аллеля Ala12Ala (OШ 1,14, 95% ДИ 1,08–1,2) [13].
Напротив, многие исследования «случай — контроль» показали, что вариант Pro12Ala (Ala12) связан с защитой от риска СД2 у восточноазиатских (японских) [14], ближневосточных [15] и европейских предков, таких как финны [16], чехи [17] и шотландцы [18]. Другие исследования показали, что вариант PPARG Pro12Ala может рассматриваться как маркер риска, определяющий предрасположенность к СД2 у русских [19].
Вышеописанные исследования указывают, что носительство полиморфного варианта гена PPARG Pro12Ala может иметь как протективный эффект, так и быть ассоциированным с повышением риска развития СД2 в некоторых популяциях. В то же время исследования, посвященные влиянию носительства данного полиморфизма на риск реализации ГСД, весьма ограничены и их результаты носят противоречивый характер.
В систематическом обзоре [20] проанализировано 76 исследований, в которых изучались однонуклеотидные полиморфизмы (SNP) при ГСД. Отобрано в соответствии с критериями обзора 34 SNP, включенных в 49 исследований. Два исследования подтвердили роль полиморфизма Pro12Ala гена PPARG G>C rs1801282 в риске реализации ГСД [21, 22].
В нашем исследовании продемонстрировано, что носительство доминантного гомозиготного варианта гена PPARG Pro12Pro значимо чаще было ассоциировано с реализацией ГСД у пациенток с беременностью, наступившей после ВРТ (ОШ 2,463, 95% ДИ 1,43–4,25, p=0,002), тогда как носительство генотипа минорной гомозиготы PPARG Ala12Ala, напротив, обладало протективным эффектом в отношении рисков реализации ГСД у пациенток после ВРТ и значимо чаще отмечалось у пациенток группы сравнения, беременность которых протекала без ГСД (ОШ 0,331, 95% ДИ 0,15–0,72, p=0,004).
В нашем исследовании были установлены ассоциации носительства гомозиготного варианта полиморфного генотипа TCF7L2 IVS3 TT с риском развития ГСД у пациенток после ВРТ (ОШ 3,795, 95% ДИ 1,482–9,720, p=0,004). Вариантный аллель С в гомо- или гетерозиготном состоянии гена TCF7L2 (IVS3 C>T), напротив, обладает протективным эффектом, значимо снижая риск ГСД при беременности, наступившей после ВРТ (ОШ 0,264, 95% ДИ 0,103–0,675, p=0,004).
Аналогичные результаты продемонстрированы в систематическом обзоре S. Dias et al. [20]. В двух исследованиях установлены ассоциации аллеля Т гена TCF7L2 rs7903146 с риском развития ГСД, однако данные получены на общей популяции беременных [21, 23].
Двадцать исследований, проведенных в различных популяциях, выявили 4 SNP (rs7903146, rs4506565, rs7901695 и rs12255372) в гене TCF7L2. Четыре из восьми исследований, в которых изучался полиморфизм rs7903146, показали связь между аллелем T гена TCF7L2 и ГСД [21, 23]. Два исследования, посвященных изучению rs4506565, сообщают об ассоциации между аллелем T гена TCF7L2 и ГСД [23, 24]. В одном из пяти исследований, посвященных rs7901695, была обнаружена связь между ГСД и аллелем Т у американских европеоидов [25], в то время как одно исследование показало, что аллель C, а не аллель T, был связан с ГСД в большой шведской популяции [24]. Из пяти исследований, посвященных rs12255372, два показали связь между аллелем T и ГСД [24].
Имеются отдельные исследования, подтверждающие ассоциацию носительства полиморфного аллеля Т гена TCF7L2 с риском возникновения ГСД на общей популяции россиян [26].
Работы многих авторов показали, что генетические компоненты определяют значительный вклад в развитие предрасположенности к ПЭ и ПН [27, 28].
Исследования, проведенные с участим близнецов, демонстрируют значимость как генетических, так и эпигенетических средовых факторов в патогенезе ПЭ и ПН [29, 30].
В метаанализе H.P. Qi et al. [31], включившем 10 671 участника из 33 исследований, установлено что маркер Glu298Asp гена NOS3 является причиной развития ПЭ (OШ 1,43, 95% ДИ 1,13–1,82). С другой стороны, метаанализ [32], проведенный на основании результатов исследования 5774 пациенток, подтвердил, что генотип ТТ в локусе 786 гена NOS3 ассоциирован с повышенным риском развития ПЭ у европеоидов (OШ 1,0, 95% ДИ 1,14–1,73), тогда как маркер Glu298Asp не имеет статистической значимости в развитии данной патологии. Более поздние работы указывают на ассоциацию полиморфизма Glu298Asp гена NOS3 с риском развития ПЭ и гипертензионных расстройств при беременности [33].
В проведенном нами исследовании выявлена ассоциация носительства полиморфного варианта аллеля T гена eNOS в локусе 894 G>Т с риском развития перинатальных осложнений ГСД у пациенток после применения программ ВРТ (χ2=7,411, ОШ 1,121, 95% ДИ 1,230–3,658, р=0,007). Анализ распределения генотипов показал, что носительство доминантного генотипа GG гена eNOS в локусе 894 G>Т ассоциировано с низким риском развития перинатальных осложнений ГСД у пациенток после ВРТ (χ2=4,026, ОШ 0,378, 95% ДИ 0,225–1,081, р<0,05).
Снижение активности гена eNOS при наличии патологических аллелей является пусковым фактором развития эндотелиальной дисфункции, нарушений липидного и углеводного обмена и, как следствие, развития ПЭ и ПН у беременных с полиморфизмом ТТ Glu298Asp (G894T) (ОШ 4,52, 95% ДИ 1,18–17,32, р<0,05) (частотное распределение 73,7%) [33].
Показана ассоциация ПЭ и ПН с носительством полиморфного варианта гена VEGF-A: -634 G>C в популяциях европеоидов и монголоидов [31, 34]. В исследовании [35] установлено, что частота генотипов VEGF -634GC и CC была значительно выше при тяжелой ПЭ по сравнению с умеренной ПЭ, а также по сравнению с контрольной группой.
В обновленном метаанализе X. Wang et al. [36] показана ассоциация между полиморфизмом гена VEGF-A и предрасположенностью к ПЭ. Метаанализ включал 23 исследования, в которых приняли участие 2597 пациенток. Установлено, что полиморфизм -634G/C гена VEGF-A может быть связан с риском развития ПЭ в европейской популяции. Эти данные согласуются с полученными в нашем исследовании результатами о носительстве полиморфных аллелей в локусе -634G/C гена VEGF-A и в локусе G894T гена eNOS. Однако в нашем исследовании данная ассоциация впервые выявлена в популяции женщин с беременностью, наступившей в результате ВРТ, осложненной развитием ГСД. В литературе не было представлено подобных данных.
Кроме того, выявленные ассоциации касаются также риска развития ПН и других осложнений беременности, связанных с нарушением процессов инвазии трофобласта и раннего плацентогенеза.
Хорошо известно, что при нарушении плацентации и аномальной инвазии цитотрофобласта, недоразвитии спиральных артерий складываются предпосылки для развития ПЭ и ПН. Ключевую роль в этом состоянии может играть VEGF. Известно, что в культивируемых цитотрофобластах в ответ на гипоксию наблюдалось повышение уровня мРНК и белка VEGF [37]. Кроме того, при ПЭ сообщалось о снижении продукции VEGF циркулирующими Т- и NK-клетками [38].
Несколько исследований показали, что изменение содержания VEGF и уровня экспрессии его рецепторов может влиять на ангиогенез, что приводит к ПН и эндотелиальной дисфункции при ПЭ [39].
Генетические вариации являются хорошо известными факторами риска предрасположенности к ПЭ. Хотя несколько генов были кандидатами на роль маркеров генетической предрасположенности к этому осложнению, не определен генетический паттерн, объясняющий эту корреляцию. Учитывая важность VEGF в ангиогенезе и ремоделировании сосудов, исследование ассоциации между полиморфизмом генов VEGF, eNOS и ПЭ, ПН в популяции женщин, чья беременность наступила в результате ВРТ и осложнилась ранним развитием ГСД, представляется весьма актуальным. Необходимы дальнейшие крупномасштабные исследования, чтобы получить конкретные доказательства роли вариантов генов VEGF и eNOS в патофизиологии ПЭ и ПН у пациенток с ГСД.
Ограничением настоящего исследования является отсутствие анализа информации о рационе и режиме питания беременных, особенностях пищевого поведения, которые являются важными компонентами многофакторных заболеваний, к которым относится ГСД.
Заключение
Поиск генетических детерминант ГСД, ассоциированного с перинатальными осложнениями, важен для определения группы риска данной патологии на этапе подготовки к проведению программ ВРТ и на ранних сроках беременности. Выявление генетических предикторов ГСД, ассоциированного с перинатальными осложнениями, предоставляет возможность реализации профилактических мероприятий, анализа клинических симптомов прогрессирования заболевания и коррекции углеводного обмена для оптимизации перинатальных исходов.
Сведения об авторах:
Мелкозерова Оксана Александровна — д.м.н., доцент, заместитель директора по научной работе ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4090-0578.
Мурзин Александр Викторович — аспирант, младший научный сотрудник отделения антенатальной охраны плода ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0003-2035-7317.
Третьякова Татьяна Борисовна — к.м.н., старший научный сотрудник, заведующая лабораторией генетики ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-5715-7514.
Дерябина Елена Геннадьевна — д.м.н., ведущий научный сотрудник отделения антенатальной охраны плода ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0001-8955-5085.
Контактная информация: Мурзин Александр Викторович, e-mail: exeleris@yandex.ru.
Источник финансирования: работа выполнена в рамках государственного задания по научно-исследовательской работе Министерства здравоохранения Российской Федерации.
Конфликт интересов отсутствует.
Статья поступила 12.09.2023.
Поступила после рецензирования 05.10.2023.
Принята в печать 30.10.2023.
About the authors:
Oxana A. Melkozerova — D. Sc. (Med.), Associate Professor, Deputy Director for Science, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-4090-0578.
Alexander V. Murzin — post-graduate student, Junior Researcher of the Department Antenatal Fetus Protection, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0003-2035-7317.
Tatiana B. Tretyakova — C. Sc. (Med.), Senior Researcher, Head of the Laboratory of Genetics; Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-5715-7514.
Elena G. Deryabina — D. Sc. (Med.), Leading Researcher of the Department of the Antenatal Fetus Protection, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0001-8955-5085.
Contact information: Alexandr V. Murzin, e-mail: exeleris@yandex.ru.
Financial Disclosure: this work was carried out within the state assignment for research work of the Ministry of Health of the Russian Federation.
There is no conflict of interest.
Received 12.09.2023.
Revised 05.10.2023.
Accepted 30.10.2023.
Информация с rmj.ru





