Введение
Цитомегаловирусная инфекция (ЦМВИ) — широко распространенная вирусная инфекция, вызываемая возбудителем β-герпесвирусов, характеризующаяся многообразными проявлениями от бессимптомного до генерализованного течения с тяжелым поражением ЦНС и других органов. Инфекция в популяции взрослых встречается до 80–90% и у абсолютного большинства протекает бессимптомно. Тяжелые формы ЦМВИ описаны при врожденной форме и постнатально приобретенной инфекции у недоношенных детей или у пациентов с ослабленным иммунитетом [1].
Врожденная ЦМВИ является самой распространенной внутриутробной инфекцией в развитых странах. Распространенность ЦМВИ приблизительно составляет 7 на 1000 новорожденных [2]. По данным метаанализа 77 исследований из 36 стран, в которых анализировали данные 515 646 младенцев в возрасте до 3 нед. жизни, частота встречаемости врожденной ЦМВИ составила 0,67%. Частота встречаемости ЦМВИ в странах с низким и средним уровнем дохода была в 3 раза выше, чем в странах с высоким уровнем дохода [3]. Замечено, что у детей с нейросенсорной тугоухостью ЦМВИ определяется в 25% случаях [3], у детей с детским церебральным параличом — в 9,6% [4], течение ЦМВИ ассоциируется с потенциальным риском аутизма [5]. Ряд авторов отметили, что у недоношенных детей или у пациентов с ослабленным иммунитетом, сочетанной тяжелой патологией встречаются клинические проявления ЦМВИ и в постнатальном периоде [1].
В пользу постнатального инфицирования ЦМВ говорят такие данные: инфекция развилась у младенца не ранее 14 дней после родов, при этом ребенок имеет отрицательный результат первого тестирования на ЦМВ, выполненный в течение первых 3 нед. жизни [6].
Содержание статьи
Пути передачи постнатальной ЦМВИ
Известны основные пути постнатальной передачи ЦМВ: через грудное молоко, горизонтальная передача (при уходе за детьми) и при переливании компонентов крови.
В 1967 г. был впервые выделен вирус из грудного молока, с этого времени изучается постнатальная передача ЦМВ через грудное молоко. Долгое время передача ЦМВ через грудное молоко доношенным детям расценивалась исследователями как естественная иммунизация в связи с тем, что у доношенных детей не регистрировалось каких-либо клинических проявлений приобретенной ЦМВИ [4, 7].
Установлено, что реактивация ЦМВ у кормящей женщины может происходить локально (в клетках грудной железы). Таким образом вирус может передаваться через грудное молоко ребенку [6]. Было показано, что реактивация вируса в грудном молоке происходит примерно у 90% серопозитивных кормящих женщин. До конца не поняты механизмы локальной реактивации вируса в молочных железах ЦМВ-позитивных матерей, совпадающей с началом лактации [8]. При исследовании вирусной нагрузки грудного молока отмечено, что в молозиве ЦМВ не определяется или находится в очень малом количестве. ДНК ЦМВ в грудном молоке увеличивается и достигает максимума через 4–8 нед. после рождения ребенка, потом постепенно уменьшается и практически не выделяется после трехмесячного возраста ребенка [9]. ЦМВ в моче ребенка при постнатальном инфицировании определяется в возрасте от 4 до 12 нед., в среднем в 6–8 нед. Это означает, что ДНК ЦМВ не обнаруживается сразу в моче новорожденных, подвергшихся воздействию ЦМВ-положительного по результатам ПЦР грудного молока, и передача вируса от матери младенцу происходит через несколько недель [10]. По данным J.E. Lee et al. [11], вирусная нагрузка ЦМВ в грудном молоке увеличивалась и достигала пика на 3–5-й неделе после родов, а ДНК ЦМВ в моче большинства младенцев была обнаружена после шестинедельного возраста. Согласно данным, дети при инфицировании через грудное молоко могут выделять вирус от 3 нед. до 3 мес. после заражения, результаты ряда исследований свидетельствуют о выделении вируса до 4–8 лет [12]. T.M. Lanzieri et al. [13] показали, что частота передачи ЦМВ через грудное молоко составляет до 19% у младенцев с очень низкой массой тела (ОНМТ). Дети получали необработанное грудное молоко от ЦМВ-позитивных матерей, у 10% младенцев развилась симптоматическая ЦМВИ, 4% младенцев страдали от ЦМВ-сепсис-подобного синдрома. Другое исследование показало, что около 20% недоношенных детей, находящихся в отделениях реанимации и интенсивной терапии новорожденных (ОРИТ), получавших нативное грудное молоко, инфицировались ЦМВ [14]. По данным Американской академии педиатрии (ААП), передача ЦМВ через грудное молоко у недоношенных детей — частая и недооцененная проблема, поскольку приблизительно у 2800 недоношенных в год развивается постнатальная ЦМВИ [13].
До последнего времени ААП рекомендовала грудное вскармливание всем детям в течение первых 6 мес. жизни, подчеркивая преимущества кормления грудным молоком недоношенных детей и отмечая, что ценность грудного вскармливания перевешивает риски клинических заболеваний, при этом не сообщалось о каких-либо долгосрочных отклонениях в развитии нервной системы. Однако в 2018 г. ААП предложила использовать кратковременную пастеризацию грудного молока для недоношенных детей, родившихся на сроке менее 32 нед. беременности, если мать имеет положительный к ЦМВ серологический статус [15].
Анализируя значимые триггеры инфицирования постнатальной ЦМВИ, исследователи выделяют такие факторы риска, как длительное кормление грудным молоком, высокая вирусная нагрузка, преждевременное излитие околоплодных вод, длительный безводный промежуток [16].
Другими потенциальными способами инфицирования ЦМВ могут быть прохождение через естественные родовые пути во время родов (вирус выделяется в родовых путях) и постнатальная горизонтальная передача. Было показано, что степень выделения ЦМВ в родовых путях незначительна по сравнению с грудным молоком и не считается основным источником постнатальной ЦМВИ [17, 18]. Горизонтальная передача ЦМВ, включая передачу инфекции от малыша к малышу, остается одним из ведущих способов заражения среди детей младшего возраста. Следует учитывать потенциальную возможность заражения вирусом при уходе за детьми или других домашних контактах [19].
Следующим возможным путем инфицирования ЦМВ является переливание препаратов крови и плазмы. До введения современных технологий по обработке крови сообщалось, что частота ЦМВИ, передаваемой при переливании крови, достигала 13–37% у пациентов с ослабленным иммунитетом [20]. ЦМВ-безопасная кровь означала донорство от ЦМВ-серонегативных индивидуумов. В 1990-х годах была введена лейкоредукция, которая считалась безопасной для передачи ЦМВ, так же как и кровь от ЦМВ-серонегативных доноров [21]. Известно, что ЦМВ в основном присутствует в лейкоцитах. Современные фильтры для лейкоредукции значительно снизили риск инфицирования ЦМВ в клеточных продуктах с 59 до 10% при переливании свежей крови, до 3% или менее при переливании лейкоредуцированных продуктов [22]. Использование безопасных в отношении ЦМВИ препаратов крови в виде серонегативных к ЦМВ или лейкоредуцированных клеточных компонентов крови (<1–5×106 лейкоцитов в единице) показало значительное влияние на этот риск, снизив трансфузионную передачу ЦМВ, по оценкам, на 93,1 и 92,3% соответственно. Однако 1,2–3,0% пациентов, получающих «безопасные» в отношении ЦМВ препараты, имеют высокий риск заражения ЦМВИ [23]. Изучив возможные пути передачи постнатальной ЦМВИ, американские исследователи пришли к выводу, что трансфузия ЦМВ-серонегативных и лейкоредуцированных продуктов крови эффективно предотвращает передачу ЦМВИ недоношенным детям. C.D. Josephson et al. [16] показали, что переливание лейкоредуцированной крови от ЦМВ-серонегативных доноров полностью предотвращало передачу ЦМВ через трансфузию в большой выборке из 539 младенцев с ОНМТ (масса тела ≤1500 г), в которой было проведено 2061 переливание крови 310 младенцам. Почти все (27 из 28; 96%) случаи постнатальной ЦМВИ были связаны с кормлением нативным грудным молоком, которое было положительным на ДНК ЦМВ. В то же время в связи с дороговизной метода и сложностью подбора ЦМВ-серонегативных доноров исследователи задаются вопросом о целесообразности проведения и лейкоредукции и тестирования доноров на ЦМВ.
В исследовании, выполненном в Канаде [24], показано, что лейкоредукция препаратов крови, используемых для переливания, эффективна в профилактике ЦМВИ. Подтвержденных случаев посттрансфузионной ЦМВИ среди пациентов, которым выполнялась трансплантация органов, не было зарегистрировано при наблюдении за ними в течение 11 лет [24]. Международные рекомендации по лечению и профилактике ЦМВ при трансплантации солидных органов, принятые в 2018 г., рекомендуют использование либо лейкоредуцированных, либо серонегативных препаратов крови, содержащих ЦМВ, но не комбинированную стратегию у реципиентов органов [25]. Исследователи считают, что скрининг на ЦМВ-серонегативную кровь может быть затруднен с точки зрения логистики, особенно в регионах, где высока частота инфицирования ЦМВ и невелик пул ЦМВ-серонегативных доноров. В Канаде было принято решение больше не проводить дополнительный скрининг на ЦМВ-серонегативную кровь при трансплантации органов, за исключением ведения реестра редких случаев внутриутробного переливания [24].
Существует и альтернативное мнение. Так, K.G Badami et al. [21] считают, что, хотя лейкоредукция очень эффективна при удалении лейкоцитов, связанных с ЦМВ, она не может удалить ЦМВ, присутствующий в плазме. В исследовании M. Bianchi et al. [26] показано, что одной лейкоредукции недостаточно для снижения риска ЦМВИ, передаваемой при переливании препаратов крови новорожденным детям. В течение пяти лет в неонатальной клинике Рима для лечения 729 новорожденных детей было сделано в общей сложности переливание 4268 единиц крови (2626 доз эритроцитарной массы, 1642 дозы тромбоцитарной массы). Инфицирование ЦМВ произошло у 10 (0,9%) новорожденных детей, причем все дети были недоношенные с экстремально низкой массой тела (ЭНМТ). Исследователи подчеркивают, что, кроме ЦМВИ, не было зарегистрировано никаких других инфекций, передаваемых трансфузионно. Наблюдаемые дети никогда не получали материнского молока, поэтому заражение через грудное молоко было исключено [26]. Для окончательного принятия решения о необходимости использования ЦМВ-серонегативных доноров необходимо проведение двойного слепого рандомизированного контролируемого исследования, сравнивающего эффективность использования лейкоредуцированных и ЦМВ-серонегативных препаратов крови относительно только лейкоредуцированных препаратов крови в профилактике посттрансфузионной ЦМВИ у младенцев с ОНМТ и ЭНМТ [27].
Особенности клинических проявлений постнатальной ЦМВИ
В отличие от врожденной ЦМВИ, постнатальная ЦМВИ, как правило, протекает бессимптомно и не имеет особых серьезных клинических последствий (тугоухость, поражение ЦНС и др.). Постнатальная инфекция в первую очередь опасна для детей с факторами риска — это недоношенные дети с ОНМТ, ЭНМТ и доношенные дети с тяжелой и сопутствующей врожденной или приобретенной патологией, для которых заражение ЦМВ через грудное молоко или другим путем может привести к серьезным заболеваниям [28].
Почему доношенные дети редко болеют ЦМВИ? Это можно объяснить тем, что происходит передача защитных материнских антител, поэтому у доношенных детей редко развивается симптоматическая ЦМВИ без какой-либо альтернативной причины для нарушения иммунитета [29].
Как было сказано выше, группу высокого риска подвергшихся развитию серьезных симптомов и последствий после заражения постнатальной ЦМВИ составляют недоношенные дети. Объясняется это отсутствием пренатально приобретенных антител к ЦМВ в сочетании с присутствием ЦМВ в грудном молоке, что увеличивает риск заражения через грудное молоко у недоношенных детей [30].
Клинические проявления постнатальной ЦМВИ начинаются обычно на 2–3-м месяце жизни ребенка и отличаются от симптомов врожденной ЦМВИ. Одним из проявлений постнатальной ЦМВИ является ЦМВ-сепсис-подобный синдром, который протекает с апноэ, брадикардией, серостью кожных покровов. Симптомы сепсиса, включая пневмонию, гепатит и нейтропению/тромбоцитопению, наблюдаются примерно у 15% новорожденных с ОНМТ. Также возможно развитие острого гепатита, гепатоспленомегалии, пневмонии. Редко у младенцев с ЦМВИ развиваются энтероколит, желтуха с холестазом, лимфоаденопатия [6]. Симптомы интерстициальной ЦМВ-пневмонии схожи с симптомами других типов атипичной пневмонии. У детей раннего возраста при общем удовлетворительном состоянии может отмечаться упорный приступообразный сухой кашель, при этом физикальные данные скудные, на рентгенограммах органов грудной клетки отмечается усиление легочного рисунка, снижение прозрачности легких в виде «матового стекла». При прогрессировании состояния у детей нарастают одышка инспираторного или смешанного характера, слабость, анорексия, лихорадка [31]. Часто отмечается несоответствие клинической и морфологической картины. Клиническое течение часто длительное (до нескольких месяцев), иногда требуется искусственная вентиляция легких, на этом фоне присоединяется тяжелая бактериальная инфекция. У детей, погибших в первое полугодие жизни (чаще в возрасте 1–4 мес.), страдавших ЦМВИ, одно из первых мест по частоте поражения занимает патология легких, выявляемая в 20–67% случаев. При патологоанатомическом исследовании у детей отмечались незрелые и дистелектатические легкие, интерстициальный отек и васкулит [32]. По данным метаанализа было показано, что постнатальная ЦМВИ у недоношенных детей с ОНМТ связана с повышенным риском развития бронхолегочной дисплазии (БЛД) [33].
Следующим клиническим проявлением постнатальной ЦМВИ является гепатит, при котором развиваются гепатоспленомегалия, желтуха и повышается уровень трансаминаз. Имеются сообщения о тяжелых проявлениях гепатита с системным поражением, портальной гипертензией и прогрессированием заболевания до цирроза печени [34]. Однако ЦМВ-гепатит чаще протекает в легкой форме и имеет хороший исход у иммунокомпетентных пациентов. В исследовании, проведенном в Корее [35], из 132 младенцев с ЦМВ-поражением печени, средний возраст которых составил 8,5 мес., 55,3% были в возрасте до 3 мес. на время начала заболевания и 44,7% — старше 3 мес., на грудном вскармливании находились 41,7% детей. Отмечалась скудность жалоб и клинической симптоматики, у части детей самочувствие не страдало, в клинической картине у 40% детей наблюдалась лихорадка, у 20% пациентов младше 3 мес. — длительная желтуха, единичные случаи диареи и рвота. Признаки холестаза наблюдались у 52% детей, средняя продолжительность гипербилирубинемии составила 8 нед. У детей были изменения в биохимических показателях крови: общий билирубин от 1,88 до 376 мкмоль/л (медиана 33 мкмоль/л), прямой билирубин от 0,51 до 126,54 мкмоль/л (медиана 18,81 мкмоль/л), АСТ от 22 до 1838 Ед/л (медиана 219 Ед/л), АЛТ от 5 до 1517 Ед/л (медиана 251 Ед/л). В 97% случаев было повышение уровней щелочной фосфатазы и гамма-глутамилтрансферазы (ГГТ). Продолжительность повышения уровня АЛТ и АСТ варьировала от 2 до 48 нед. В 38% случаев у детей наблюдалась анемия, в 15% — лейкоцитоз, в 47% — моноцитоз, в 23,5% — лимфоцитоз. Ни у одного из детей не отмечалось тромбоцитопении и коагулопатии. На фоне терапии ЦМВ-гепатита наблюдался благоприятный клинический исход [35]. В Японии были проанализированы клинико-диагностические данные 26 младенцев с проявлениями ЦМВ-гепатита [36]. Клинические симптомы при поступлении включали лихорадку (62%), рвоту (15%), снижение аппетита и диарею. Ни у одного пациента не было желтухи или коагулопатии, уровень АЛТ в сыворотке крови от 71 до 1689 Ед/л (в среднем 574 Ед/л), продолжительность нарушения функции печени сохранялась более 3 мес. более чем у 50% пациентов, все дети выздоровели в течение нескольких лет.
Патогенез, особенности течения и лечение ЦМВ-гепатита у пациентов с ослабленным иммунитетом хорошо изучены, в то время как поражение печени при ЦМВИ у младенцев с нормальным иммунитетом изучено плохо [37]. Так, анализ течения ЦМВ-гепатита у 49 турецких детей (средний возраст 5,81±3,49 мес.) с нормальным иммунным статусом показал, что при поступлении в стационар у детей отмечались следующие симптомы: длительная желтуха у 14 (28,57%) из 49 детей, диарея у 11 (22,44%) из 44 детей, рвота у 5 (10,2%) из 49 детей, вздутие живота у 14 (28,57%) из 49 пациентов. У 14 (28,57%) пациентов не было активных жалоб, но отмечались изменения в лабораторных показателях [37]. При клиническом осмотре детей были диагностированы гепатомегалия у 42,8%, желтуха у 30,6%, спленомегалия у 20,4%, задержка роста у 6,12%, микроцефалия у 4,08%, хориоретинит у 2,04%. При физикальном осмотре 7 пациентов не было выявлено патологии. У всех пациентов отмечалось повышение уровня трансаминаз. Уровень АСТ варьировал от 64 до 2950 Ед/л (в среднем 300,1±476,3 Ед/л) и уровень АЛТ — между 69 и 2085 Ед/л (в среднем 256,6±350,4 Ед/л). Повышенный уровень билирубина определялся у 19 (38,7%) из 49 детей. Среднее значение уровня ГГТ составляло 146,48±118,20 (18–566) Ед/л, повышенный уровень ГГТ был определен у 26 (53,06%) из 49 детей. Гепатит осложнился развитием холестаза у 8 (26,5%) пациентов, восстановление функции печени составляло в среднем 53,92±40,8 дня. Ни одному из детей не проводилась биопсия печени.
Поражение желудочно-кишечного тракта (ЖКТ) является необычным проявлением ЦМВИ у иммунокомпетентных детей [38]. Постнатальное инфицирование доношенного новорожденного, как правило, протекает бессимптомно, но в редких случаях вызывает развитие тяжелого ЦМВ-энтероколита. ЦМВИ может вызывать рецидивы кишечных заболеваний у младенцев, страдающих воспалительными заболеваниями кишечника [39]. Р.К. Sue et al. [18] проанализировали 23 случая постнатальной ЦМВИ с поражением кишечника и показали, что средний возраст начала клинических проявлений составил 2,5 мес., среди пациентов чаще встречались мальчики, дети родились без задержки внутриутробного развития, недоношенности и не имели предшествующего инфекционного анамнеза. Большинство (14 (72%) из 20) пациентов находились исключительно на грудном вскармливании во время болезни, у трех на момент предъявления жалоб была аллергия на белок коровьего молока, у четырех детей — дефицит прибавки веса. У пациентов выявили жидкую водянистую (50%), кровянистую диарею (50%), продолжительность которой составляла до 13 дней. У детей отмечался выраженный лейкоцитоз (средний показатель лейкоцитов на момент начала заболевания составил 19,4×109/л) и тромбоцитоз (среднее количество тромбоцитов составило 545×109/л). Все пациенты были госпитализированы, 59% детей получили противовирусную терапию ганцикловиром, большинство (82%) пациентов полностью выздоровели. У трех пациентов отмечалось осложнение (перфорация, стриктура толстой кишки), один младенец умер, диагноз был поставлен при вскрытии [18]. G. Ekema et al. [40] представили клиническое наблюдение ЦМВИ с поражением ЖКТ у новорожденного, у которого развилась стриктура толстой кишки и проявилась клиническая картина, сходная с болезнью Гиршпрунга. Поражение кишечника представляло собой локализованную сегментарную ЦМВИ толстой кишки, при которой воспалительные изменения преобладали над гистологическими данными. Аналогичный случай описали C. Kumar et al. [41]: у пятимесячного ребенка интраоперационно была обнаружена стриктура толстой кишки в нисходящей ободочной кишке, которая по гистопатологии была классической для ЦМВИ.
Постнатальная ЦМВИ ассоциируется с повышенным риском развития некротического энтероколита (НЭК) у недоношенных детей с ОНМТ и ЭНМТ. По данным американских исследователей, частота НЭК была почти в 3 раза выше в группе с постнатальной ЦМВИ по сравнению с контрольной группой. Все недоношенные дети получали грудное молоко ЦМВ-серопозитивных матерей, показана корреляция между высоким содержанием ЦМВ в материнском грудном молоке и повышенным риском развития НЭК [42]. При тяжелом течении ЦМВ-воспаления кишки возможно возникновение осложнений, требующих хирургического вмешательства. Если диагностика ЦМВИ основывается только на обнаружении ЦМВ в резецированном или биопсийном материале, происходит недооценка роли ЦМВ в заболеваемости недоношенных [39]. Наличие характерных гистологических изменений (гигантские клетки c внутриядерными и цитоплазматическими включениями, напоминающие «совиный глаз») с иммуногистохимическим подтверждением в резецированных фрагментах кишки, биопсийном или аутопсийном материале в сочетании с обнаружением вируса в биосредах позволяет считать ЦМВ этиологическим фактором воспалительного процесса [43]. ЦМВ-энтероколит следует заподозрить у младенцев с пролонгированной секреторной диареей и непереносимостью кормления в качестве дополнения к стандартным алгоритмам [44]. Прямых доказательств наличия ЦМВ в слизистой оболочке ЖКТ может быть немного, особенно если воспаление было давним. Быстрый ответ на введение ганцикловира при ЦМВ-энтероколите следует рассматривать в качестве дополнительного диагностического и терапевтического инструмента [45]. Лабораторные проявления постнатальной ЦМВИ характеризуются следующими показателями: тромбоцитопения, нейтропения, повышение уровней трансаминаз, прямого билирубина, умеренное повышение уровня С-реактивного белка (СРБ). Довольно часто лабораторные изменения в крови являются единственными проявлениями постнатальной ЦМВИ, поэтому есть рекомендации, в которых предлагается недоношенных детей с признаками супрессии костного мозга тестировать на ЦМВИ. Постнатальная ЦМВИ является одной из наиболее распространенных причин длительной нейтропении [46]. Согласно исследованию K. Hamprecht et al. [47] у 17 (52%) из 33 инфицированных младенцев наблюдались нейтропения, тромбоцитопения или гепатопатия и у 4 (12%) детей развился сепсис-подобный синдром.
Диагностика постнатальной ЦМВИ
Для диагностики постнатальной ЦМВИ рекомендуется исследовать мочу и слюну методом ПЦР на ЦМВ не ранее, чем через 3 нед. после родов. Следующим условием постановки диагноза постнатальной инфекции является отрицательный результат на ЦМВ методом ПЦР, полученный в течение первых 3 нед. жизни, тогда последующий положительный результат подтверждает наличие именно постнатальной ЦМВИ. В западных странах используют сухое пятно для определения ДНК ЦМВ для исключения внутриутробного заражения. Предложен другой вариант подтверждения именно постнатального инфицирования — это отсутствие активной ЦМВИ у матери (IgG высокой авидности, IgM(-)). В 2019 г. исследователями из Оксфорда были предложены следующие показания для обследования на постнатальную ЦМВИ: срок гестации <32 нед., масса тела при рождении <1500 г, кормление грудным молоком ЦМВ-серопозитивной матери, клинико-рентгенологические признаки пневмонии, НЭК, лентикулостриарная васкулопатия, кисты герминального матрикса [6].
Лечение постнатальной ЦМВИ
Доказательства эффективности противовирусного лечения детей с постнатальной ЦМВИ ограниченны [48]. Специфическую терапию ЦМВИ проводят детям при наличии тяжелого поражения органов и систем, включая гепатит, супрессию костного мозга (анемия, нейтропения, тромбоцитопения), тяжелые поражения ЖКТ, пневмонию или обострение БЛД, сепсис-подобный синдром. Лечение проводится теми же лекарственными средствами и в тех же дозах, как и при врожденной ЦМВИ: ганцикловир (в дозе 6 мг/кг 2 р/сут внутривенно) или валганцикловир (16 мг/кг 2 р/сут перорально) в среднем в течение 4–6 нед. Возможно назначение гипериммунного глобулина, содержащего анти-ЦМВ антитела. Необходимо проводить тщательный мониторинг на предмет нежелательных явлений, а также измерять уровень лекарственного средства в крови, если это возможно. Опыт ведущих педиатров и инфекционистов Великобритании показывает, что клинически прагматичный подход заключается в проведении противовирусного лечения двухнедельными блоками, и в идеале это должно осуществляться при поддержке детского инфекциониста. Цитомегаловирусную нагрузку в крови следует еженедельно проверять [6]. Если симптомы заболевания сохраняются и продолжает выделяться вирус в крови, то лечение может быть продолжено в течение еще двух недель. Редко необходимо проведении лечения более чем 8 нед. [49].
Исходы постнатальной ЦМВИ
Показано, что у детей с постнатальной ЦМВИ увеличен риск развития БЛД, при этом риск развития нейросенсорной тугоухости не ассоциируется с постнатальной ЦМВИ. При долгосрочном наблюдении за детьми с перенесенной постнатальной ЦМВИ отмечались нарушения когнитивных и моторных функций в сравнении с неинфицированными детьми [50].
Представляем анализ серии клинических наблюдений детей, находившихся на лечении и обследовании в Перинатальном центре (ПЦ) СПбГПМУ. В анализ включены истории развития четырех доношенных детей (гестационный возраст 38,7±1,5 нед.), у которых была диагностирована постнатальная ЦМВИ. Диагностика ЦМВИ проводилась методом ПЦР с определением ДНК ЦМВ в моче, крови и слюне. Врожденный характер ЦМВИ был исключен, так как первое обследование на ЦМВ было сделано в возрасте до 21 дня жизни ребенка, ДНК ЦМВ не была обнаружена ни в одной из сред, по тяжести состояния дети не получали грудного вскармливания. Массо-ростовые показатели соответствовали сроку гестации (масса тела при рождении 3410±301,77 г, длина тела при рождении 52,5±0,8 см). Состояние всех детей при рождении расценивалось как тяжелое или средней тяжести, обусловленное сочетанной патологией с рождения, в дальнейшем все дети были переведены в ПЦ СПбГПМУ, находились в ОРИТ и отделении патологии новорожденных. При анализе клинической патологии отмечено: у первого ребенка после рождения была тяжелая врожденная пневмония с пневмотораксом, хилотораксом и врожденная дисфункция коры надпочечников; у второго ребенка с рождения диагностирована острая кишечная непроходимость (заворот кишки) с последующей резекцией тонкой кишки, тяжелая бактериальная инфекция; у третьего ребенка — болезнь Гиршпрунга (оперативное лечение) и бактериальная инфекция; у четвертого новорожденного — синдром Дауна, врожденный порок сердца (атриовентрикулярный ствол), недостаточность кровообращения 2А. Все дети имели сопутствующую сочетанную патологию в неонатальном периоде (см. таблицу). На фоне проведенного комплексного лечения (симптоматическая, патогенетическая или хирургическая терапия) заболеваний в ПЦ СПбГПМУ состояние детей было стабильным. На 3–4-м месяце жизни у младенцев отмечалось ухудшение общего состояния: у трех детей появились симптомы инфекционного токсикоза (серый оттенок кожи, брадикардия, апноэ, десатурация), у двух детей отмечалось повышение температуры выше 38,5 °C. При осмотре отмечалось увеличение печени и селезенки у четырех детей, признаки интестинальной недостаточности у двух детей, желтуха была у одного ребенка, рвоты и диареи ни у кого не отмечалось (см. таблицу).
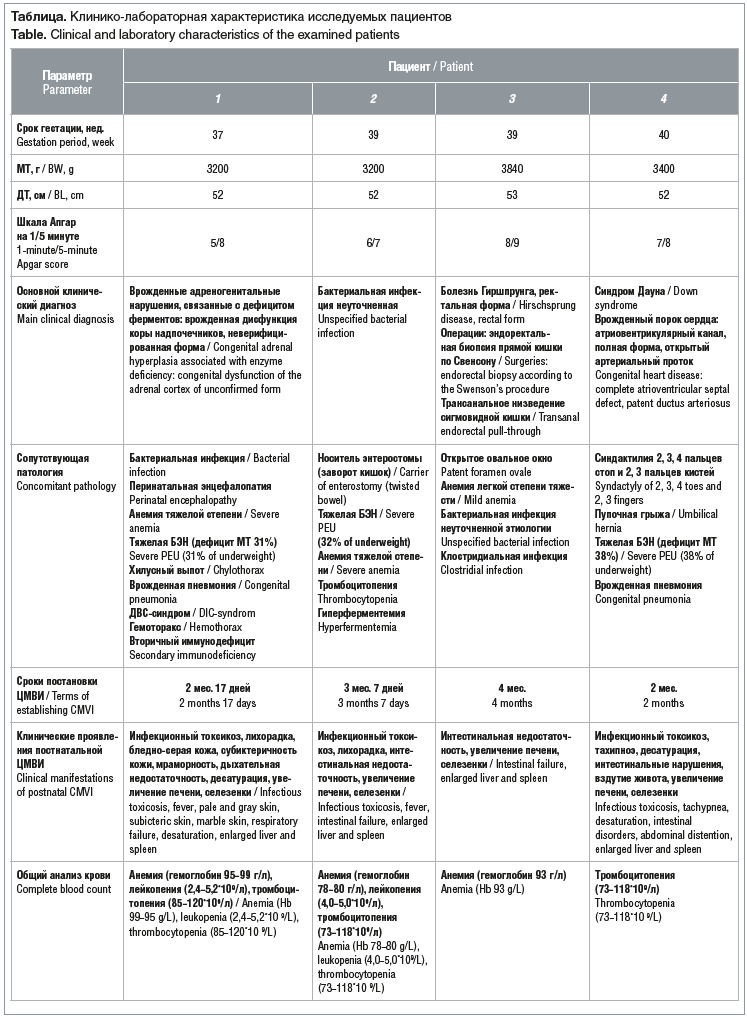

При проведении лабораторных исследований у детей были обнаружены изменения: лейкопения у двух детей, тромбоцитопения и анемия разной степени выраженности у трех детей. Анализ показал, что у четырех детей было отмечено нарастание в динамике уровня печеночных ферментов: АЛТ от 135 до 1089 Ед/л, АСТ от 168 до 919 Ед/л. У двух детей был диагностирован холестаз по повышению фракции прямого билирубина более 20%, у трех младенцев повышение СРБ, у одного — триглицеридов.
При проведении дифференциального диагноза дети были обследованы на ЦМВИ методом ПЦР в трех биологических средах (кровь, моча, слюна).
Тесты были положительными у всех детей. Ухудшение состояния детей было расценено как течение постнатальной ЦМВИ с преимущественным поражением печени. Всем детям в связи с наличием клинической симптоматики на фоне отягощенного преморбидного фона, лабораторных критериев (увеличение уровня АЛТ и АСТ, признаки холестаза) и данных ПЦР была диагностирована ЦМВИ и назначено индивидуальное специфическое лечение: ганцикловир и/или иммуноглобулин человека антицитомегаловирусный. На фоне терапии у детей отмечалась положительная клинико-лабораторная динамика, однако уровень печеночных трансфераз длительное время (6–8 нед.) оставался повышенным. При проведении контрольных обследований на ЦМВИ после проведенного лечения ПЦР-тесты были отрицательными.
Таким образом, в нашем анализе представлены доношенные дети с неблагополучным преморбидным статусом, длительно находящиеся в условиях госпитальной среды, неоднократно проводилась гемотрансфузия, в возрасте 2–3 мес. жизни отмечалось ухудшение состояния (сепсис-подобный синдром, интестинальный синдром на фоне лечения, включая антибактериальную терапию), изменения в лабораторных показателях (лейкопения, тромбоцитопения). Было выполнено тестирование на ЦМВИ методом ПЦР, так как были исключены другие причины инфекционного токсикоза, и диагностирована постнатальная ЦМВИ. На фоне специфической терапии наблюдалось быстрое улучшение клинической симптоматики.
Заключение
Традиционно считается, что постнатальная ЦМВИ — это проблема недоношенных детей, главным образом рожденных с экстремально низкой или очень низкой массой тела. Нами изучены данные литературы о течении постнатальной ЦМВИ у доношенных детей и выполнен анализ клинических наблюдений у доношенных иммунокомпрометированных новорожденных детей, который показал важные триггеры по развитию постнатальной ЦМВИ.
Группу риска по реализации постнатальной ЦМВИ составляют доношенные дети, имеющие с рождения проблемы в состоянии здоровья (врожденные пороки развития, хирургическая, хромосомная патология), коморбидные состояния (тяжелая белково-энергетическая недостаточность, анемия, персистирующие бактериальные инфекции), а также длительное время находящиеся в стационаре и получающие терапию препаратами крови. Клинические проявления постнатального ЦМВИ у доношенных компрометированных детей могут протекать по типу сепсис-подобного синдрома, с лихорадкой, гепатоспленомегалий, лабораторными изменениями. Клинико-лабораторный контроль и настороженность врача на проведение обследования по ЦМВИ поможет поставить правильный диагноз и назначить этиотропное лечение. Необходимо обращать внимание на пациентов группы риска по реализации постнатальной ЦМВИ, включая доношенных детей.
Сведения об авторах:
Панченко Александра Сергеевна — д.м.н., доцент, профессор кафедры неонатологии с курсами неврологии и акушерства-гинекологии ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194044, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-2313-3941.
Бем Елена Венедиктовна — к.м.н., ассистент кафедры неонатологии с курсами неврологии и акушерства-гинекологии ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194044, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0009-0008-9337-5667.
Чумакова Галина Николаевна — д.м.н., профессор кафедры неонатологии с курсами неврологии и акушерства-гинекологии ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194044, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0001-5353-4610.
Мызникова Ирина Владимировна — заведующая отделением патологии новорожденных перинатального центра ФГБОУ ВО СПбГПМУ Минздрава России; 194044, Россия, г. Санкт-Петербург, ул. Литовская, д. 2.
Контактная информация: Панченко Александра Сергеевна, e-mail: sashawomen18@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 17.02.2023.
Поступила после рецензирования 14.03.2023.
Принята в печать 05.04.2023.
About the authors:
Alexandra S. Panchenko — Dr. Sc. (Med.), Associate Professor, Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0003-2313-3941.
Elena V. Bem— C. Sc. (Med.), Assistant Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0009-0008-9337-5667.
Galina N. Chumakova — Dr. Sc. (Med.), Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5353-4610.
Irina V. Myznikova — Head of the Department of Neonatal Pathology, Perinatal Center of the St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation.
Contact information: Alexandra S. Panchenko, e-mail: sashawomen18@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 17.02.2023.
Revised 14.03.2023.
Accepted 05.04.2023.
Информация с rmj.ru


