Введение
Актуальность проблемы нутритивной коррекции после обширных резекций кишечника определяется эпидемиологическими, этиопатогенетическими и регенераторными причинами. Эпидемиологические причины свидетельствуют о том, что современный уровень развития хирургии, анестезиологии, реаниматологии и нутрициологии обеспечивает выживаемость пациентов даже с минимальной остаточной культей кишечника после резекции. Однако метаболическая коррекция последствий таких операций требует значительных усилий в связи с потерей массы тела, снижением концентрации альбумина плазмы крови менее 30 г/л, электролитными нарушениями, органной недостаточностью и пр. Выделяются последствия в виде синдрома короткой тонкой кишки (СКК), постколэктомического синдрома и последствия сочетанных тонко-толстокишечных резекций.
По статистическим данным, в Великобритании частота СКК составляет 2 случая на 1 млн человек в год, в Испании — 1,8 на 1 млн, в Германии — 2–3 на 100 тыс. [1]. C ростом онкологической патологии в мире и ее хирургическим лечением также увеличивается количество пациентов с резецированным кишечником. Кроме того, расширяются показания к резекциям при тяжелых формах воспалительных заболеваний кишечника. Так, необходимость в резекции кишечника через 5 лет наличия болезни Крона составляет 40% случаев, через 10 лет — 70%, через 20 лет — почти 90% [2]. Диффузный семейный полипоз, вероятность трансформации которого в онкологию составляет 100%, также подлежит оперативному лечению, и зачастую это обширные тонко-толстокишечные резекции [3].
Актуальность изучения этиопатогенетических причин высока, так как метаболический статус при СКК важен для выбора компонентов нутритивной коррекции. Так, в случае удаления всей двенадцатиперстной кишки в организм поступает недостаточное количество железа, кальция, магния, фолиевой кислоты, жирорастворимых витаминов (А, D, Е, К), поскольку эти нутриенты всасываются в основном в двенадцатиперстной и начальных отделах тонкой кишки. При удалении подвздошной кишки нарушается всасывание желчных кислот и витамина В12. Если слизистая оболочка подвздошной кишки воспалена или удалена, то соли желчных кислот проникают в толстую кишку и выделяются со стулом, жир хуже всасывается, появляется стеаторея, теряются с калом желчные кислоты, необходимые для усвоения жиров и жирорастворимых витаминов. При вовлеченности в процесс толстой кишки нарушаются микробиотические компоненты обработки рациона, что отражается на энтерогепатической циркуляции.
Особого внимания для выбора тактики нутритивной поддержки заслуживают адаптивные и регенераторные возможности самой кишки. Из существующих видов регенерации (физиологическая, репаративная, патологическая) наибольший интерес после резекции кишечника представляет ее репаративная клеточная форма.
Цель исследования: оценить возможности нутритивной коррекции после обширных резекций кишечника.
Материал и методы
Обследованы пациенты с сочетанной обширной резекцией тонкой кишки и правосторонней гемиколэктомией (47 мужчин и 49 женщин). Резекции выполнялись по поводу спаечной кишечной непроходимости, мезентериального тромбоза, полипоза кишечника, рака кишечника, болезни Крона, травматической болезни. Всем пациентам для оценки нутритивного статуса применяли параметры известного алиментационно-волического диагноза (АВД) [4]. Оценку метаболических сдвигов проводили по показателям плазмы (общий белок, альбумин, электролиты) и биоимпедансному показателю состава тела. Репаративные процессы подтверждались морфологическими данными и результатами определения катепсина L — продукта, участвующего в лизосомальном окислении, внутриклеточного маркера метаболизма — в сыворотке методом иммуноферментного анализа.
Для обработки данных применен метод сравнительного анализа. Статистическая обработка выполнялась с применением программы Statistica 10. Пороговый уровень статистической значимости выводов составлял величину р<0,05.
Результаты и обсуждение
Вследствие СКК у пациентов в оставшейся кишке развиваются процессы, направленные на восстановление функций и коррекцию метаболических нарушений, нутритивных изменений и сдвига адаптивно-репаративных процессов. Попытка организма восстановить утраченные функции основана на механизмах адаптации и частичной клеточной регенерации, а также на восстановлении электрической активности.
Известно, что электромоторная активность кишечника обусловливает его пищеварительно-всасывательные процессы [5, 6]. Однако до настоящего времени сведений о проведении электрического импульса через зону анастомоза после резекции кишки было недостаточно. При регистрации нами электрической активности в этой зоне было отмечено, что электрическая волна с отделов, лежащих выше места резекции, как бы перескакивает на отделы, лежащие ниже места анастомоза, не изменяя при этом своих амплитудно-частотных характеристик (табл. 1).
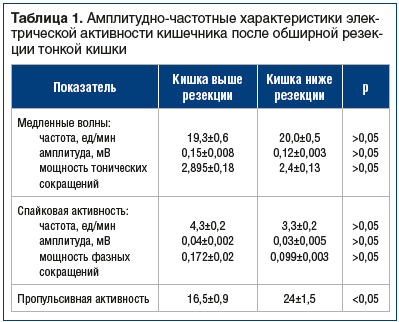
Это обусловлено наличием собственных водителей ритма в кишечнике и поэтому обеспечивает условия, необходимые для восстановления процессов всасывания в доступных пределах, которые тем не менее угнетены из-за отсутствия выпавшего участка кишки и в зависимости от сохранности водителей ритма. При поступлении химуса непосредственно в нижележащие отделы, следующие за удаленным отрезком и испытывающие поэтому повышенную пищеварительно-транспортную нагрузку, развиваются адаптивные перестройки эпителиоцитов (подтверждено морфологически). Кроме того, в области анастомоза на расстоянии около 3–4 см в обе стороны от пострезекционного шва возможно развитие процессов клеточной регенерации, дополнительно стимулирующих всасывание на данных участках. В связи с этим у 65–90% пациентов в отдаленном периоде (в зависимости от объема и уровня резекции) отмечено некоторое восстановление эпителиоцитов и их функций. В сроки от года до 2 лет могли наблюдаться преходящие диспепсические нарушения, снижение трудоспособности, метаболические осложнения, а в сроки более 2 лет — незначительные морфологически подтвержденные адаптации, стабилизация массы тела. Данные симптомы коррелировали с размером остаточной культи (табл. 2).
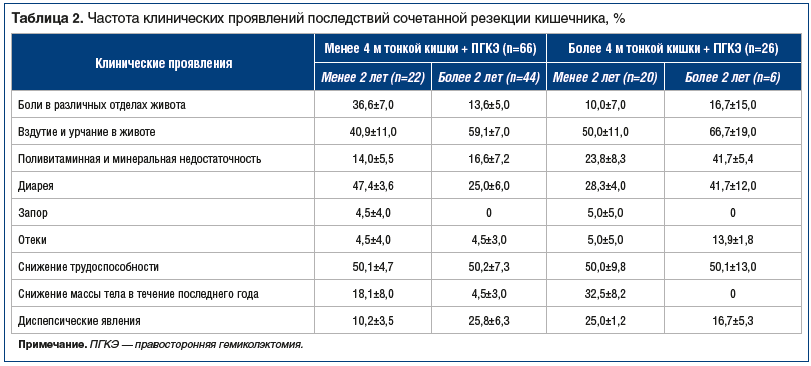
Положительная динамика в отношении метаболического статуса связана с адаптивными и регенераторными возможностями органов, лимитирующих усвоение, их тенденцией к нормализации функционального и морфологического статуса, в том числе клеточных регенераторных процессов.
В других лимитирующих пищеварение и нутритивный статус органах (печень, поджелудочная железа, билиарный тракт) также выявлен ряд дисфункциональных сдвигов, ярко выраженных непосредственно после обширной резекции кишечника, сохраняющихся до 1,5–2 лет с постепенной тенденцией к нормализации. У пациентов, перенесших сочетанную резекцию кишечника (менее 4 м тонкой кишки и правостороннюю гемиколэктомию), в относительно ранние сроки адаптации (до 2 лет) после операции в основном превалировали диффузные изменения печени и поджелудочной железы, а желчнокаменная болезнь встречалась достаточно редко (4,5% случаев). В то же время в более поздние сроки (более 2 лет) после операции имелась выраженная тенденция к увеличению частоты случаев желчнокаменной и мочекаменной болезни. Описанные изменения функций органов, лимитирующих усвоение питательных веществ, подтверждались при лабораторных исследованиях (табл. 3).
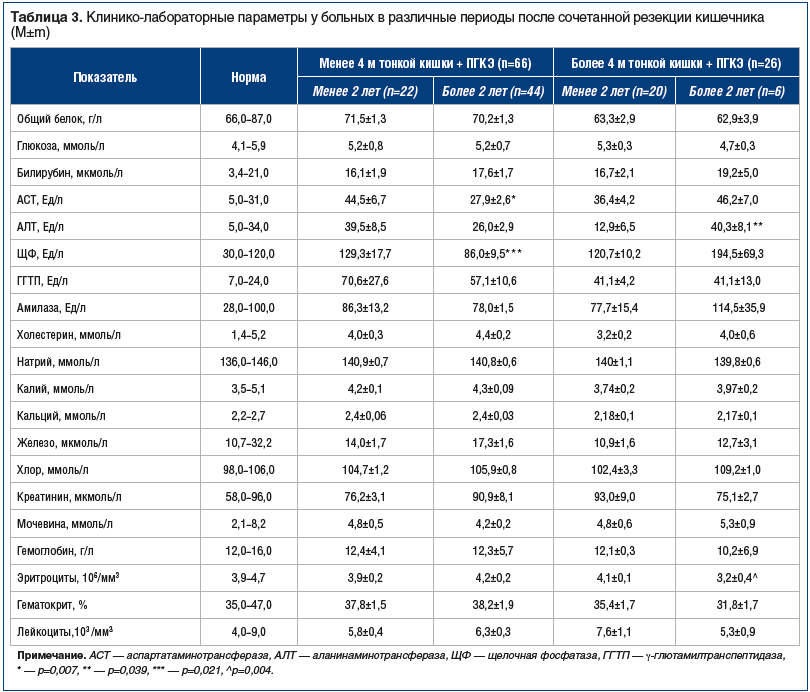
Клинико-биохимические параметры крови были сопоставимы с интегральными характеристиками, отражающими нутритивный статус. Так, в нутритивной коррекции в группе с резекцией менее 4 м и правосторонней гемиколэктомией в сроки менее 2 лет после операции нуждались 41% больных (по шкале NRS-2002), а в более позднем периоде (свыше 2 лет) — только 7%, что обусловлено адаптационными механизмами пищеварительной системы. А в группе с резекцией более 4 м и правосторонней гемиколэктомией число больных, нуждающихся в нутритивной коррекции, было существенно выше (см. рисунок).
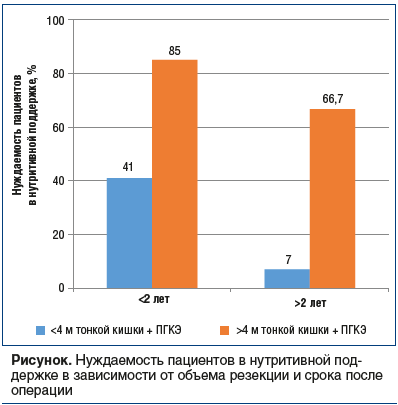
На основании полученных данных и анализа традиционных алгоритмов лечения СКК с кишечной недостаточностью нами были предложены модифицированные схемы нутритивной поддержки с учетом степени кишечной недостаточности и функционального резерва лимитирующих усвоение органов. Они включали: а) парентеральную коррекцию белково-энергетического гомеостаза с учетом фракционного резерва (ФР) печени (аминостерил-гепа + омегавен + глюкоза 10%), почек (аминостерил-нефро + омегавен + глюкоза 10%); при сохраненном или частично сохраненном ФР печени — смофкабивен или кабивен; б) усилители: омега-3 жирные кислоты, аргинин, глутамин; в) дополнительное использование фармаконутриентов в структуре алиментации, в том числе широкого спектра факторов роста, цитокинов, пептидов, а также внеклеточные везикулы. Для характеристики внутриклеточных маркеров метаболизма определялись продукты, участвующие в лизосомальном окислении.
После комбинированного лечения под прикрытием нутритивной коррекции определенный в сыворотке крови катепсин L в 69% случаев соответствовал целевым значениям, в 25% — имел тенденцию к снижению, а в 6% — оставался повышенным. При нормальном или сниженном уровне катепсина L после лечения отмечалась стабилизация нутритивного статуса. Пациенты с повышенным содержанием катепсина L в 86% случаев имели неблагоприятный прогноз [7].
При биоимпедансометрии состава тела отмечался рост общей и внеклеточной воды, активной массы тела, фазового угла, что говорило о связи катепсина L с метаболической активностью лизосом с последующим распадом клеточных компонентов и снижением синтеза белка. Катепсин L оказался прогностическим фактором негативных восстановительных процессов, позволяющим, по-видимому, определять показания к стимуляции внутриклеточной регенерации, в частности препаратами энтероглюкагона-2 (тедуглютид). По данным литературы [8–10], он способствует восстановлению слизистой кишечника — ворсин, обеспечивающих всасывание, — и участвует в регуляции энергогомеостаза. Однако регенераторные и адаптивные процессы в трансплантате до настоящего времени продолжают изучаться. Кроме того, 3D-печать кишечника, ставшая доступной в ряде клиник мира (например, в Корнелльском университете), позволяет понять, как развиваются клетки под влиянием движения жидкости и пищи, что весьма важно при оценке возможностей препаратов, стимулирующих регенераторные и адаптивные процессы, в частности тедуглютида. Элементы клеточной регенерации позволяют улучшить состояние организма в период его адаптации к новым анатомическим условиям. При невозможности поддерживать гомеостаз консервативным путем рекомендовано прибегать к оперативной коррекции. Восстановление утраченной части кишки возможно и путем трансплантации [11]. В мировой практике решается вопрос и о трансплантации искусственного органа (на 3D-принтере ученые уже пробовали печатать кишечник). Применяют также STEP, операцию Бианчи, реже — антиперистальтические анастомозы [12].
Заключение
После тонко-толстокишечной резекции имеет место относительно длительный процесс структурно-функциональной адаптации. Структурная адаптация затрагивает все слои стенки кишки и подразумевает пролиферацию клеток в составе крипт, увеличение высоты ворсинок, соотношения длины крипт к длине ворсинок, площади всасывающей поверхности и массы слизистой оболочки, а также увеличение диаметра просвета и утолщение стенок кишки. Также проявляются внутриклеточные адаптивно-регенераторные возможности, опирающиеся на лизосомальные механизмы.
Для выбора оптимального алгоритма нутритивной коррекции целесообразно пользоваться АВД как наиболее полно отражающим методом оценки метаболических расстройств после обширных резекций кишечника различного уровня и объема. При этом алгоритм индивидуальной оптимизированной программы необходимо выбирать с учетом кишечной недостаточности, тяжести состояния и функционального резерва органов, используя в показанных случаях тедуглютид.
Информация с rmj.ru






