Непереносимость углеводов
В.О. Кайбышева1, Е.К. Баранская2
Цель обзора. Изложить современные представления об этиологии и патогенезе пищевой непереносимости, проанализировать современные стратегии диагностики и лечения непереносимости углеводов.
Основные положения. У пациентов, у которых наблюдаются абдоминальная боль, диарея, вздутие живота, при отсутствии органических заболеваний необходимо исключить непереносимость компонентов продуктов питания, в первую очередь углеводов. В случае подтверждения пищевой непереносимости высокоэффективными методами лечения являются коррекция рациона с исключением непереносимых продуктов питания, добавление в схему терапии соответствующих ферментных препаратов.
Заключение. Непереносимость углеводов нередко является причиной возникновения абдоминальной боли, вздутия живота, диареи у практически здоровых людей и больных с функциональными заболеваниями желудочно-кишечного тракта. Своевременное выявление непереносимого компонента пищи и исключение его из рациона позволяют значительно уменьшить выраженность имеющихся симптомов.
Ключевые слова: непереносимость углеводов, лактазная недостаточность, гиполактазия взрослых, метеоризм, альфа-галактозидаза.
Кайбышева Валерия Олеговна — кандидат медицинских наук, старший научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, врач-гастроэнтеролог Городской клинической больницы № 31, г. Москва. Контактная информация: valeriakаi@mаil.ru; 119415, г. Москва, ул. Лобачевского, д. 42
Баранская Елена Константиновна — доктор медицинских наук, профессор, лауреат премии правительства РФ в области науки и техники, профессор кафедры пропедевтики внутренних болезней лечебного факультета — послевузовская подготовка стажированных врачей по специальности «Гастроэнтерология», Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский университет)
Введение
Прием пищи — жизненно важная потребность человека, необходимая для пополнения запасов энергии, поддержания жизнедеятельности, обеспечения синтетических процессов, роста и созревания организма. Немаловажным в питании человека является фактор получение удовольствия от еды. Обеспечивая организм необходимыми витаминами, минералами, белками, жирами и углеводами, продукты питания оказывают на него лечебное воздействие, служат средой для развития микробиоты. В то же время компоненты продуктов питания могут вызывать раздражение слизистой оболочки желудочно-кишечного тракта (ЖКТ) и даже индуцировать развитие тяжелых заболеваний, объединенных в широком смысле общим термином «нежелательные реакции на компоненты продуктов питания».
Нежелательные реакции на отдельные компоненты продуктов питания — это группа заболеваний, характеризующихся возникновением клинических симптомов со стороны ЖКТ, а также внекишечных проявлений спустя несколько часов– дней, а иногда и недель после приема определенных продуктов питания.
Согласно современным представлениям, нежелательные реакции на пищу могут развиваться по типу пищевой аллергии, аутоиммунных заболеваний и пищевой непереносимости [1].
В патогенезе пищевой аллергии и аутоиммунных заболеваний ключевую роль играет иммунная система. Так, при пищевой аллергии на некоторые компоненты пищевых продуктов, как правило определенных белков, возникает активация адаптивной иммунной системы, протекающая по типу реакции гиперчувствительности немедленного типа с выработкой антител IgE и IgG4. При пищевой аллергии период времени от приема продукта-аллергена до возникновения клинических симптомов составляет не более нескольких часов.
Морфологические изменения в стенке тонкой кишки при пищевой аллергии представлены увеличением числа эозинофилов в собственной пластинке слизистой оболочки [1–3].
Наиболее ярким и изученным примером заболеваний, в основе патогенеза которых лежит аутоиммунный процесс с выработкой перекрестно реагирующих аутоантител, служит целиакия, триггером для возникновения которой является употребление продуктов из злаков, содержащих белок глиадин. В периферической крови больных с целиакией обнаруживают аутоантитела класса IgA и IgG к структурам внеклеточного матрикса, в том числе к эндомизию (соединительная ткань, окружающая гладкомышечные элементы кишечных крипт) и ретикулину, аутоантитела к тканевой трансглутаминазе (фермент, участвующий в метаболизме глютена), антитела к глиадину. Морфологическим субстратом при целиакии являются массивная лимфоплазмоцитарная инфильтрация слизистой оболочки тонкой кишки, атрофия ворсинок, гиперплазия крипт. От приема продукта-триггера до возникновения клинико-морфологических изменений проходит не менее нескольких недель [1, 3].
Патологические реакции на компоненты продуктов питания могут протекать и без участия иммунной системы. В данном случае речь идет о так называемой пищевой непереносимости [4].
Пищевая непереносимость — это группа заболеваний, клиническими проявлениями которых служат боль и распирание в животе, вздутие, диарея, возникающие через несколько часов после приема в пищу определенных продуктов (как правило, углеводов) в связи с недостатком или отсутствием пищеварительных ферментов, участвующих в их метаболизме или абсорбции [2, 4]. При пищевой непереносимости, несмотря на наличие выраженных клинических симптомов со стороны ЖКТ, не удается выявить изменения в периферической крови, отсутствуют морфологические изменения слизистой оболочки тонкой и толстой кишки (рис. 1).
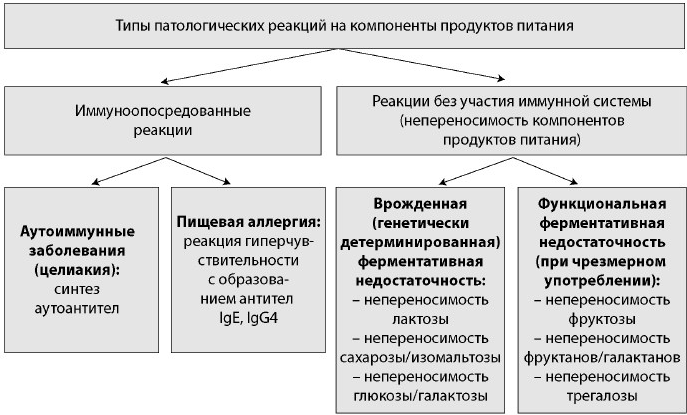
Рис. 1. Классификация патологических реакций на компоненты продуктов питания
Fig. 1. Classification of pathological responses to nutrients
Целиакия и пищевая аллергия — хорошо изученные заболевания, в то время как пищевая непереносимость мало знакома врачам-клиницистам в связи с отсутствием специфических лабораторных маркеров и референсных методов инструментальной диагностики. Как правило, больным с пищевой непереносимостью устанавливают диагноз «функциональная диспепсия» или «синдром раздраженного кишечника» и назначают лечение без учета возможного влияния пищевых продуктов на возникновение симптомов.
Непереносимость углеводов
В клинической практике наиболее часто наблюдается непереносимость углеводов (фруктозы, лактозы, фруктанов и галактанов и т.д). Интересно, что непереносимость белков практически не встречается, поскольку на прием белков чаще всего развиваются реакции с вовлечением иммунной системы (целиакия, пищевая аллергия).
Актуальность проблемы непереносимости углеводов обусловлена в первую очередь тем, что за последние десятилетия употребление углеводов (преимущественно за счет пищевого сахара) возросло на 900%, что привело к катастрофическому увеличению числа больных с ожирением, сахарным диабетом и чрезвычайно высокой распространенности непереносимости углеводов [1, 3, 5]. Согласно последним статистическим данным, пищевая непереносимость наблюдается примерно у 20% населения планеты, ¾ из них в качестве триггера возникновения симптомов указывают на углеводы [4, 6–9].
Особенно актуальна проблема непереносимости углеводов среди больных с синдромом раздраженного кишечника (СРК), поскольку до 50–84% из них утверждают, что возникновение или увеличение выраженности симптомов со стороны ЖКТ связано с приемом продуктов, содержащих такие углеводы, как лактоза, фруктоза, фруктаны, галактаны и др. [7–12].
Таблица 1. Продукты, наиболее часто вызывающие симптомы пищевой непереносимости
| Группа продуктов | Продукты | Число больных с СРК, указавших на непереносимость, % |
| Продукты из зерна | Свежий пшеничный хлеб | 4,8-34,8 |
| Овощи | Капуста Лук Бобы |
9,6-57 8,9-56 21,4-46 |
| Молочные продукты | Молоко | 4,4-41,7 |
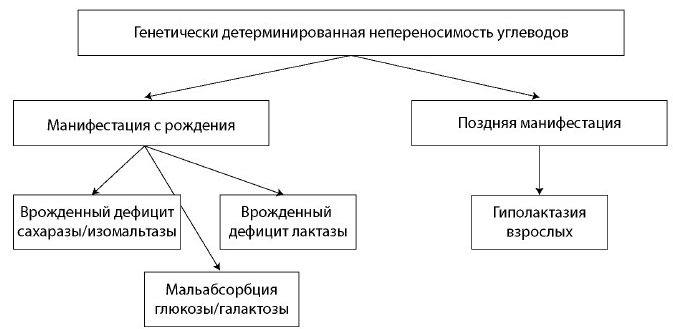
Рис. 2. Классификация непереносимости углеводов. Часть 1
Fig. 2. Carbohydrate intolerance classification. Part 1
Согласно результатам популяционных исследований, из плохо переносимых продуктов, содержащих простые и сложные углеводы, пациенты с СРК наиболее часто отмечают фрукты и овощи, свежий пшеничный хлеб, бобовые, лук, чеснок, алкоголь, молоко (табл. 1) [4, 10–12].
Классификация
Непереносимость углеводов может быть врожденной: отсутствие либо недостаточный синтез того или иного фермента, отвечающего за метаболизм или транспорт углеводов через мембрану энтероцита, генетически детерминированы и манифестируют с рождения (рис. 2) [1, 3, 4]. К врожденным состояниям относят, например, врожденный дефицит лактазы и сахаразы/изомальтазы, мальабсорбцию глюкозы/галактозы.
Существуют заболевания, при которых генетически детерминированная ферментативная недостаточность проявляется только у взрослых (гиполактазия взрослых) (см. рис. 2). Кроме того, непереносимость некоторых углеводов может быть связана не с отсутствием фермента в организме, а с его низкой функциональной активностью. В данном случае симптомы пищевой непереносимости возникают при чрезмерном употреблении того или иного углевода. Чаще всего симптомы непереносимости углеводов развиваются по описанному выше механизму при употреблении большого количества продуктов, содержащих фруктозу (фрукты), трегалозу (грибы), сорбитол, фруктаны и галактаны (овощи, фрукты) (рис. 3) [1, 3, 4].
Патогенез
Нормальная физиология переваривания углеводов включает процесс расщепления ферментами пищеварительного тракта дисахаридов, олигосахаридов, полисахаридов до моносахаридов. Слюнные железы и поджелудочная железа вырабатывают амилазу, расщепляющую крахмал и гликоген (полисахариды, состоящие из молекул глюкозы) до дисахарида мальтозы. Дисахаридазы щеточной каймы тонкой кишки метаболизируют дисахариды до моносахаридов: лактаза расщепляет молочный сахар лактозу на молекулу глюкозы и молекулу галактозы, мальтаза — дисахарид мальтозу на 2 молекулы глюкозы, сахараза — сахарозу на глюкозу и фруктозу, трегалаза — трегалозу на 2 молекулы глюкозы. Образовавшиеся моносахариды глюкоза, фруктоза, галактоза транспортируются через мембрану энтероцита с помощью транспортных белков-переносчиков [2].
В случае генетически детерминированного отсутствия фермента или белка-транспортера либо при их сниженной функциональной активности молекулы углеводов не подвергаются достаточному метаболизму и абсорбции. Неабсорбированные углеводы, оказывая выраженное осмотически активное действие, обусловливают задержку жидкости в просвете тонкой кишки, ускорение кишечной перистальтики, развитие осмотической диареи. Попадая в нерасщепленном виде в просвет толстой кишки, углеводы подвергаются метаболизму бактериальными ферментами толстокишечной микрофлоры с образованием короткоцепочечных жирных кислот (КЦЖК), молочной кислоты, углекислого газа, метана, водорода и воды, вызывающих раздражение толстой кишки и активизацию ее моторики. Образование большого количества газов в просвете толстой кишки в свою очередь приводит к возникновению боли и вздутию живота [1, 2, 4, 6].
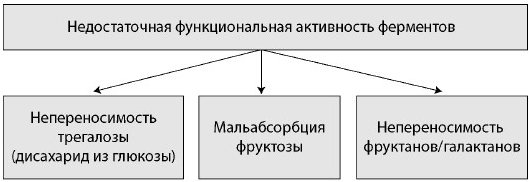
Рис. 3. Классификация непереносимости углеводов. Часть 2
Fig. 3. Hundred intolerance classification. Part 2
Клиническая картина
Клиническая картина пищевой непереносимости крайне неспецифична и включает как кишечные симптомы, характерные для многих заболеваний ЖКТ, так и внекишечные. Наиболее характерными жалобами больных с непереносимостью углеводов являются боль в животе (68%), вздутие и увеличение живота, распирание, водянистая диарея (33%), тошнота и рвота [3, 4, 6, 7]. Важно отметить, что, несмотря на столь выраженную клиническую картину, воспалительные и другие морфологические изменения в стенке толстой кишки при непереносимости углеводов, как правило, отсутствуют [3, 4, 6].
Такие симптомы, как боли в суставах и костях (11%), фибромиалгия, мышечный гипертонус (34%), чувство онемения в руках и ногах (20%), хроническая усталость (33%), головная боль и мигрень, сонливость, расстройства внимания, депрессия (22%), гиперактивность, атаксия, эритема и экзема, выпадение волос, также описываются в литературе как возможные проявления непереносимости углеводов. Прямых доказательств связи между развитием внекишечных симптомов и непереносимостью углеводов нет. Возникновение внекишечных симптомов в данном случае связывают с токсичными метаболитами, образующимися при бактериальной ферментации углеводов, поступивших в непереваренном виде в толстую кишку [13].
Существует также теория, объясняющая внекишечные проявления пищевой непереносимости феноменом так называемого «синдрома повышенной проницаемости кишечника» («leaky gut syndrom»). Речь идет об увеличении транс- и парацеллюлярной проницаемости слизистой оболочки тонкой кишки вследствие повреждающего действия крупномолекулярных веществ, не подвергшихся должному ферментативному расщеплению. Увеличение проницаемости кишечного барьера для иммуногенных белков приводит к их попаданию в кровеносное русло и развитию иммуноиндуцированного воспаления в периферических тканях [14–18].
Непереносимость молока (лактазная недостаточность, гиполактазия)
Непереносимость молока и молочных продуктов — пример мальабсорбции лактозы, связанной с отсутствием или недостаточной активностью фермента щеточной каймы энтероцитов — лактазы [19].
Врожденная лактазная недостаточность характеризуется полной неспособностью вырабатывать лактазу, манифестирует с рождения, является крайне редким заболеванием с аутосомно-рецессивным типом наследования (описано всего 40 случаев) [20].
Конституциональная лактазная недостаточность (гиполактазия взрослых) проявляется генетически детерминированным снижением активности лактазы при переходе на взрослый тип питания с одновременным повышением активности сахаразы/изомальтазы, расщепляющей дисахариды сахарозу и мальтозу [21, 22].
Примечательно, что лактазная недостаточность наблюдается у 80% афроамериканцев и более чем у 90% азиатских народностей, тогда как у 80% представителей белой расы в странах северной Европы лактаза вырабатывается в достаточных количествах всю жизнь. Распространенность лактазной недостаточности среди взрослого населения России составляет 16–18%, однако имеются данные, согласно которым у некоторых северных народностей (ненцы) распространенность гиполактазии взрослых достигает 90% [23].
Гиполактазия взрослых обусловлена наличием полиморфизма гена лактазы LCT (LACTASE gene), а именно его регуляторного участка MCM6 (Minichromosome Maintenance Complex component 6), который кодирует аминокислотную последовательность фермента лактазы. Наиболее распространенный вариант полиморфизма с.-13910С ассоциирован со снижением синтеза мРНК фермента по сравнению с вариантом полиморфизма с.-13910Т, носители которого хорошо усваивают лактозу [22]. В настоящее время доступно генетическое тестирование, позволяющее обнаружить полиморфизм указанного гена в гомозиготной или гетерозиготной форме, ассоциированный с непереносимостью лактозы [22].
Кроме генетически детерминированной лактазной недостаточности, у пациентов с заболеваниями тонкой кишки (целиакия, болезнь Крона, острый гастроэнтерит) может наблюдаться так называемая вторичная лактазная недостаточность [1].
Патогенез лактазной недостаточности в точности повторяет описанные выше механизмы развития непереносимости других углеводов: при недостаточной активности лактазы нерасщепленная лактоза остается в просвете кишки и оказывает выраженное осмотическое действие. Поступая в толстую кишку, лактоза становится питательным субстратом для микроорганизмов, ферментирующих ее до КЦЖК, молочной кислоты, углекислого газа, метана, водорода и воды, что приводит к развитию боли, вздутия, осмотической диареи [24, 25]. Характерные симптомы непереносимости лактозы возникают, как правило, через 1–2 ч после употребления молочных продуктов. Выраженность клинической симптоматики лактазной недостаточности широко варьирует в зависимости от количества принятой лактозы, степени лактазной недостаточности, ферментативной активности кишечной флоры (бактерии с бета-галактазидазной активностью снижают выраженность симптомов), индивидуальных особенностей чувствительности толстой кишки, психологических аспектов [24, 25].
Терапия лактазной недостаточности предусматривает полное исключение молока и молочных продуктов из рациона на 2–4 нед с постепенным их введением в небольших количествах. Как правило, взрослые с конституциональной лактазной недостаточностью способны усвоить до 12 г лактозы, что эквивалентно одной кружке молока (примерно 250 мл), особенно если молоко было принято одновременно с другой пищей. Выпитое за один раз молоко в количестве 400–500 мл и более вызывает у больных с гиполактазией выраженные симптомы [21, 26, 27].
При конституциональной и вторичной лактазной недостаточности кисломолочные продукты практически не вызывают симптомов непереносимости, поскольку содержат бактериальную лактазу. Из кисломолочных продуктов предпочтение следует отдавать йогуртам, так как термофильный молочный стрептококк (Streptococcus thermophilus) и молочно-кислая болгарская палочка (Lactobacillus bulgaricus) обладают ярко выраженной лактазной активностью. Согласно современным представлениям, бактериальная лактаза, вырабатываемая йогуртовыми культурами, является одним из определяющих факторов, улучшающих усвоение лактозы при конституциональной и вторичной лактазной недостаточности [28].
Кроме того , в исследовании, проведенном I. Labayen и соавт. [29], было показано, что благодаря более вязкой консистенции йогурта в сравнении с молоком замедляется эвакуация содержимого желудка в двенадцатиперстную кишку и увеличивается время кишечного транзита, поэтому лактоза медленнее поступает в тонкую кишку, в результате чего уменьшается вероятность развития клинических проявлений лактазной недостаточности.
Хорошим подспорьем в поддержании качества жизни пациентов с непереносимостью молока является применение безлактозных продуктов (безлактозные молоко, йогурты). В рацион пациентов, находящихся на безлактозной диете, необходимо включить продукты, богатые кальцием, витамином D и фосфором: брокколи, консервированный лосось, витаминизированные соки, фасоль пинто, шпинат, препараты кальция в количестве 1300 мг /сут [21]. Существуют также биологически активные добавки, содержащие ферменты бета-галактозидазу и лактазу (лактаза бэби, лактазар).
Мальабсорбция глюкозы-галактозы
В норме моносахариды глюкоза и галактоза транспортируются через мембрану эпителиальных клеток тонкой кишки в кровеносное русло с помощью белка — котранспортера глюкозы и галактозы и двух молекул натрия (SGLT — sodium glucose transporter) по градиенту концентрации натрия. В основе патогенеза мальабсорбции глюкозы-галактозы лежит нарушение синтеза белка — транспортера этих моносахаридов, вследствие чего глюкоза и галактоза не всасываются, а подвергаются метаболизму бактериальными ферментами в толстой кишке. Выраженное осмотически активное действие глюкозы и галактозы, оказываемое ими при нахождении в просвете тонкой кишки, приводит к развитию тяжелой диареи и обезвоживанию организма [30].
Основной симптом заболевания — водянистая пенистая диарея с кислой реакцией среды (бактериальное брожение), манифестирующая сразу после рождения на фоне грудного вскармливания или кормления смесями, содержащими глюкозу и галактозу. Фруктозу больные переносят хорошо [30].
Диагностика мальабсорбции глюкозы-галактозы основывается в первую очередь на характерной клинической картине: раннее (сразу после рождения) начало диареи, отсутствие клинического улучшения на фоне безлактозной диеты. Из инструментальных методов исследования можно применить водородный дыхательный тест, показывающий увеличение концентрации водорода в выдыхаемом воздухе после приема глюкозы, галактозы, лактозы. При биопсии стенки тонкой кишки обнаруживают неизмененную структуру ворсинок и нормальную активность дисахаридаз щеточной каймы, что позволяет исключить лактазную недостаточность. Верификацию диагноза проводят по результатам генетического тестирования на наличие мутаций гена SLC5A1 (описано 40 мутаций) [30, 31].
Лечение мальабсорбции глюкозы-галактозы включает строжайшую диету с исключением из рациона молока и молочных продуктов, при метаболизме которых образуется галактоза, а также сахара и сладостей, являющихся источниками глюкозы. Разрешены к употреблению овощи, фрукты, мясо, рыба, яйца, жиры, фруктоза, мед [30, 31].
Мальабсорбция фруктозы
Другой вид непереносимости моносахаридов — мальабсорбция фруктозы. В отличие от мальабсорбции глюкозы-галактозы она не является генетически детерминированным заболеванием, а обусловлена так называемой функциональной несостоятельностью белка–транспортера фруктозы, проявляющейся только при чрезмерном употреблении в пищу продуктов, содержащих фруктозу [32, 33].
Транспорт фруктозы через апикальную и базальную мембраны энтероцита в норме осуществляют белки GLUT-2 и GLUT-5 (glucosa transport family), являющиеся глюкозозависимыми. Это значит, что белки–транспортеры фруктозы активируются и встраиваются в апикальную мембрану энтероцита только после активизации другого белка–транспортера глюкозы (SGLT). В связи с этим фруктоза хорошо абсорбируется (в соотношении 1:1) совместно с глюкозой, недостаток которой может вызвать характерные симптомы пищевой непереносимости: диарею, боль в животе, его вздутие, у любого индивида при употреблении большого количества фруктозы [32–34].
Согласно результатам клинических исследований [35], доза фруктозы, которую способен усвоить практически каждый человек без возникновения дискомфорта в ЖКТ, составляет 10–15 г (что соответствует, например, 300 г груш, 250 г яблок, 100 г кураги). При однократном приеме более 50 г фруктозы вероятность возникновения симптомов пищевой непереносимости увеличивается до 50% [35]. В случае добавления к продуктам, содержащим фруктозу, сахара (глюкозы) способность к абсорбции фруктозы значительно возрастает.
Важно отметить, что алкоголь блокирует белок — транспортер фруктозы (GLUT-5), значительно снижая способность усваивать фруктозу, что приводит к развитию выраженных клинических симптомов [32, 33].
Врожденный дефицит сахаразы-изомальтазы
Кроме молочного сахара (лактозы), огромную долю в рационе современного человека составляет обычный пищевой сахар (сахароза) — дисахарид, расщепляемый до глюкозы и фруктозы ферментом щеточной каймы энтероцитов сахаразой — изомальтазой. Как следует из названия, этот фермент участвует также в расщеплении крахмала и мальтозы [1, 2, 36].
Снижение активности или полное прекращение синтеза сахаразы/изомальтазы является следствием мутаций, приводящих к развитию врожденного заболевания с аутосомно-рецессивным типом наследования (распространенность 1:5000). Известно несколько мутаций (p.Val577Gly, p.Gly1073Asp, Phe1745Cys, p.Arg1124X)[37], выявление которых у детей с хронической диареей позволяет установить диагноз и назначить правильное лечение. Альтернативными методами диагностики являются оценка активности сахаразы/изомальтазы в биоптатах стенки тонкой кишки [36], проведение дыхательного теста с С13, меченным углеродом [38].
Клиническая картина заболевания представлена осмотической диареей, выраженность которой зависит от степени дефицита фермента и количества принятой сахарозы или крахмала. Заболевание манифестирует после прекращения грудного вскармливания и введения в рацион крахмала и сахара [39].
Лечение врожденного дефицита сахаразы-изомальтазы основано на исключении из рациона всех продуктов, содержащих сахар, также запрещены яблоки, абрикосы, бананы, дыня, грейпфрут, манго, апельсины, ананасы и другие сладкие фрукты, бобы, фасоль, горох, соя. Разрешены все овощи, кроме картофеля и моркови, молоко и молочные продукты, сыр, йогурт с фруктозой, мясо, рыба, яйца, жиры, рис, пшеница, кукуруза, рожь, макароны, хлеб, авокадо, ягоды, киви, лимон, гранат, мед, фруктоза. С каждым приемом пищи больным рекомендован прием фермента сахаразы [39,40].
Непереносимость трегалозы (функциональное снижение активности трегалазы)
Еще один дисахарид, содержащийся в грибах, водорослях, дрожжах, — трегалоза. Несмотря на то что трегалоза, так же как мальтоза и крахмал, состоит из остатков глюкозы, она не может расщепляться мальтазой или амилазой. В связи с наличием особой химической связи между двумя остатками глюкозы необходимо воздействие особого фермента щеточной каймы энтероцитов — трегалазы.
Эволюционно человеческий организм способен вырабатывать крайне небольшое количество данного фермента, поэтому при переедании грибов и других трегалозосодержащих продуктов возникают так называмая функциональная недостаточность фермента и характерные симптомы пищевой непереносимости [41, 42].
Непереносимость галактанов и фруктанов
В продуктах питания человека, кроме моносахаридов (глюкоза, фруктоза, галактоза) и дисахаридов (сахароза, лактоза, трегалоза), состоящих соответственно из одной и двух молекул, содержатся крупномолекулярные углеводы, например, крахмал и гликоген (полимеры из глюкозы), фруктаны (полимеры из фруктозы), галактаны (полимеры из галактозы).
Эволюционно поджелудочной железой и слюнными железами, а также щеточной каймой энтероцитов синтезируется достаточное количество ферментов (амилаза и мальтаза), расщепляющих крахмал и гликоген до молекул глюкозы. В то же время у человека практически отсутствуют ферменты, расщепляющие связи во фруктанах и галактанах, содержащихся преимущественно во фруктах и овощах. Так, отсутствие фермента альфа-галактозидазы, расщепляющего 1- и 6-галактозные связи, приводит к тому, что лишь 5–15% поступивших с пищей фруктанов и галактанов абсорбируется в тонкой кишке [43–45]. Оставшаяся доля этих углеводов поступает в толстую кишку, вызывая сильнейшее вздутие, боль и диарею.
Между тем фруктаны и галактаны в большом количестве содержатся в ежедневном рационе человека: в фасоли (белой, красной, коричневой), чечевице, салате, капусте (бело- и краснокачанной, брюссельской, цветной, брокколи, кольраби), луке, чесноке, моркови, свекле, бобах, орехах, петрушке, муке и изделиях из нее (особенно цельных семенах зерновых), фисташках, семенах кунжута, сое и соевых продуктах (соевом молоке, тофу), спарже и др. [43].
Пациентам, у которых отмечаются выраженные симптомы пищевой непереносимости на фоне приема овощей и фруктов, рекомендовано применение фермента альфа-галактозидазы (препарат «Орликс®» по 1–3 таблетки с первыми порциями пищи). Альфа-галактозидаза — фермент, расщепляющий 1- или 6-галактозные связи в олигоса-харидах и тем самым предотвращающий процессы, лежащие в основе непереносимости углеводов (избыточное образование кишечных газов, развитие осмотической диареи). Оптимальной считают дозу 5 мг (1 таблетка) на перекусы, 10 мг (2 таблетки) на основные приемы пищи и 15 мг (3 таблетки) при чрезмерном потреблении перечисленных продуктов [44, 45].
Проведен ряд клинических исследований, в которых была доказана эффективность альфа-галактозидазы при метеоризме. Так, двойное слепое перекрестное исследование по оценке эффективности альфа-галактозидазы у лиц с непереносимостью олигосахаридов, проведенное T.G. Ganiats и соавт. [44], показало статистически значимое снижение частоты метеоризма у респондентов, дополнительно получавших альфа-галактозидазу. При этом статистически значимые различия между двумя группами выявлены уже через 5 ч после пробного завтрака (р = 0,04).
В рандомизированном исследовании, выполненном M. Hillila и соавт. [45], в котором приняли участие 125 больных с СРК, было выявлено, что в группе пациентов, принимавших альфа-галактозидазу в течение 16 нед, наблюдалась отчетливая тенденция к снижению частоты вздутия живота по сравнению с группой плацебо.
В рандомизированном двойном слепом плацебоконтролируемом исследовании, проведенном G. Di Nardo и соавт. [46], в которое были включены 52 ребенка с выраженным метеоризмом, отмечено значительное уменьшение доли детей с этой патологией (р=0,024) на фоне приема альфа-галактозидазы в течение 2 нед по сравнению с группой плацебо. Побочные эффекты альфа-галактозидазы не зарегистрированы.
Процесс получения этого фермента заключается в культивировании бактерии E. coli с геном, отвечающим за выработку альфа-галактозидазы. «Орликс®» включен в Российские рекомендации по лечению больных c СРК, его предлагают использовать при неэффективности диетических ограничений. Препарат рекомендуют принимать с первыми порциями пищи, содержащей овощи, фрукты, бобовые продукты.
Необходимо помнить , что при непереносимости углеводов, несмотря на выраженную боль в животе, вздутие, диарею, отсутствуют воспаление и другие органические изменения в слизистой оболочке кишечника. Более того, крупномолекулярные углеводы, поступающие в толстую кишку человека, являются пребиотиками, так как ферментируются бактериями с образованием широкого спектра конечных метаболитов, которые служат субстратом для роста и размножения других бактерий (симбиоз) [3, 4].
Какие вещества образуются при бактериальном метаболизме пищевых веществ, в значительной мере зависит от характера питания. Брожение сложных углеводов, таких как пищевые волокна и крахмал, происходит с образованием КЦЖК, например ацетата, пропионата, бутирата (уксусная, пропионовая, масляная кислоты). КЦЖК являются питательной средой для эпителиальных клеток кишечника, функционируют как сигнальные молекулы, их синтез необходим для нормального функционирования ЖКТ [47, 48].
Роль КЦЖК в возникновении симптомов заключается в воздействии на окончания чувствительных нервных волокон. Так, в нескольких исследованиях [47, 48, 50, 51] было показано, что бутират натрия уменьшает выраженность абдоминальной боли у больных с СРК. Предполагают, что он снижает чувствительность механорецепторов кишечной стенки и изменяет высвобождение нейротрансмиттеров, отвечающих за перистальтику кишки.
Примечательно, что свойство некоторых углеводов попадать в толстую кишку, минуя всасывание в тонкой кишке, было положено в основу механизма действия осмотических слабительных, например препарата «Лактитол» («Экспортал®»), который по составу относится к классу олигосахаридов, подклассу дисахаридов: его молекула состоит из остатков галактозы и фруктозы. Фермента, который расщеплял бы такую связь, в организме человека нет. Благодаря этому лактитол не всасывается в тонкой кишке, обладает высокой осмотической активностью и достаточно быстро попадает в толстую кишку, где расщепляется бактериальными ферментами (является пребиотиком) с образованием КЦЖК, углекислого газа и воды. В результате увеличивается объем содержимого толстой кишки и ускоряется ее опорожнение [52].
Диагностика пищевой непереносимости
Для большинства компонентов продуктов питания, вызывающих пищевую непереносимость, отсутствуют специфические диагностические тесты (за исключением генетического тестирования), и диагноз пищевой непереносимости устанавливают только после исключения других заболеваний ЖКТ (целиакия, панкреатит, синдром избыточного бактериального роста, кишечные инфекции и т. д.) [50, 51, 53, 54].
«Золотым стандартом» в диагностике непереносимости компонентов продуктов питания считается клинически значимое улучшение самочувствия больного или полное исчезновение симптомов после исключения непереносимого компонента на 2–4 нед до достижения ремиссии с постепенным введением его в рацион для установления количества, не вызывающего клинических симптомов [4].
Одним из важнейших методов диагностики непереносимости углеводов является дыхательный тест с нагрузкой соответствующим углеводом. Принцип его заключается в следующем. В организме человека при метаболизме пищевых веществ водород не образуется, а во время брожения углеводов с участием бактериальных ферментов образуются водород и метан, которые абсорбируются в кровь и выводятся из организма с выдыхаемым воздухом. Таким образом, при непереносимости углеводов водородный дыхательный тест дает возможность обнаружить увеличение содержания водорода в выдыхаемом воздухе после приема соответствующего углевода (лактоза, глюкоза, фруктоза, галактоза) по сравнению с исходным уровнем (до пищевой нагрузки) [55].
Методика проведения теста включает обязательную двухнедельную подготовку, во время которой исключают прием антибиотиков, пробиотиков и слабительных, процедуры по очистке кишечника. Пациент в течение 12 ч до диагностической процедуры не должен принимать пищу. Процедуру проводят следующим образом: за 5 мин до приема раствора с углеводом осуществляют забор образца выдыхаемого воздуха, затем пациенту предлагают выпить 50 г водного раствора лактозы (фруктозы 25 г, сорбитола 10 г), после чего в течение 2 ч через каждые 20 мин проводят забор образцов выдыхаемого воздуха и анализ содержания в нем водорода (Н2) и метана (СН4). Как показало исследование, проведенное C.H. Wilder-Smith и соавт. [54], использование водородного дыхательного теста позволило выявить у 51% больных с функциональными расстройствами ЖКТ непереносимость лактозы и у 60% — непереносимость фруктозы.
Для диагностики лактазной недостаточности существует также ряд других тестов, например гликемический нагрузочный тест с лактозой: в норме в течение 60 мин после приема лактозы (1 г на 1 кг массы тела, но не более 50 г) уровень глюкозы в крови должен повыситься не менее чем на 20% от исходного (примерно на 1 ммоль/л), в том случае, если этого не происходит, делают вывод о нарушении расщепления лактозы (гиполактазия) [26–28].
В некоторых случаях помощь в диагностическом поиске может оказать морфологическое исследование биоптатов слизистой оболочки тонкой кишки с определением активности дисахаридаз.
В том случае, если речь идет о врожденных, генетически обусловленных заболеваниях, точный диагноз устанавливают с помощью генетического тестирования. Вспомогательным методом диагностики непереносимости углеводов служит определение рН кала, в котором обнаруживают повышенную кислотность (рН 5,5 и ниже) [33].
Кроме того, коммерческие лаборатории предлагают большое количество других методик, не имеющих при наличии пищевой непереносимости никакой диагностической ценности. К ним относятся анализ крови на IgG4, анализ кала «на дисбиоз», определение содержания в кале КЦЖК и т. д. Эти методы не следует использовать при подозрении на пищевую непереносимость [4].
Заключение
Причиной мальдигестии и мальабсорбции пищевых веществ могут быть различные органические заболевания ЖКТ (целиакия, хронический панкреатит, острые кишечные инфекции и др.). В случае исключения органической патологии и персистирования таких симптомов, как абдоминальная боль, диарея, вздутие живота и распирание, необходимо помнить о возможном наличии у больного непереносимости какого-либо из компонентов продуктов питания. Часто внимательное отношение к жалобам больного и скрупулёзный сбор анамнеза позволяют значительно улучшить качество жизни пациента лишь благодаря индивидуальной коррекции рациона путем ограничения потребления непереносимых продуктов питания и добавления в схему терапии соответствующих ферментных препаратов.
Список литературы / References
- Ивашкин В.Т., Шептулин А.А., Склянская О.А. Синдром диареи. М.: ГЭОТАР-Медицина ; 2002. 185 с. [Ivashkin V.T., Sheptulin A.A., Sklyanskaya O.A. Diarrhea syndrome. M.: GEOTAR — Medicine; 2002. 185 p.].
- Коротько Г.Ф. Пищеварение — естественная технология. Краснодар : Эдви ; 2010. 304 с . [Korotko G.F. Digestion as natural technology. Krasnodar: EDVI; 2010. 304 p.].
- Berni Canani R., Pezzella V., Amoroso A. et al. Diagnosing and Treating Intolerance to Carbohydrates in Children. Nutrients 2016, 10;8(3):157.
- Lomer M.C.E. The aetiology, diagnosis, mechanisms and clinical evidence for food intolerance. Aliment Pharmacol Ther 2015; 41:262-75.
- Malik V.S., Schulze M.B., Hu F.B. Intake of sugar sweetened beverages and weight gain: A systematic review. Am J Clin Nutr 2006; 84:274-88.
- Hammer H.F., Hammer J. Diarrhea caused by carbohydrate malabsorption. Gastroenterol Clin N Am 2012; 41:611-27.
- Bohn L., Storsrud S., Tornblom H. et al. Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life. Am J Gastroenterol 2013; 108:634-41.
- Hayes P.A., Fraher M.H., Quigley E.M. Irritable bowel syndrome: the role of food in pathogenesis and management. Gastroenterol Hepatol 2014; 10:164-74.
- Hayes P., Corish C., O’Mahony E. et al. A dietary survey of patients with irritable bowel syndrome. J Hum Nutr Diet 2014; 27:36-47.
- Monsbakken K., Vandvik P., Farup P. Perceived food intolerance in subjects with irritable bowel syndrome — Etiology, prevalence and consequences. Eur J Clin Nutr 2006; 60:667-72.
- Simren M., Mansson A., Langkilde A.M. et al. Food-related gastrointestinal symptoms in the irritable bowel syndrome. Digestion 2001; 63:108-15.
- Hayes P., Corish C., O’Mahony E., Quigley E.M. A dietary survey of patients with irritable bowel syndrome. J Hum Nutr Diet 2014; 27:36-47.
- Campbell A.K., Matthews S.B. Bacterial metabolic «toxins»: A new mechanism for lactose and food intolerance, and irritable bowel syndrome. Toxicology 2010; 278:268-76.
- De Magistris L., Familiari V., Pascotto А. et al. Alterations of the intestinal barrier in patients with autism spectrum disorders and in their first-degree relatives. J Pediatr Gastroenterol Nutr 2010; 51:418-24.
- Millward C. Gluten- and casein-free diets for autistic spectrum disorder. Cochrane Database Syst Rev 2008; 2.
- Jackson J., Eaton W., Cascella N. et al. Gluten sensitivity and relationship to psychiatric symptoms in people with schizophrenia. Schizophr Res 2014; 159(0):539-42.
- De Magistris L., Familiari V, Pascotto A. et al. Alterations of the intestinal barrier in patients with autism spectrum disorders and in their first-degree relatives. J Pediatr Gastroenterol Nutr 2010. 51(4):418-24.
- Peters S.L. Biesiekierski J.R., Yelland G.W. et al. Randomised clinical trial: gluten may cause depression in subjects with non-coeliac gluten sensitivity — an exploratory clinical study. Aliment Pharmacol Ther 2014; 39(10):1104-12.
- Matthews S.B., Waud J.P. Systemic lactose intolerance: a new perspective on an old problem. Postgrad Med J 2005; 81:167-73.
- Diekmann L., Pfeiffer K., Naim H.Y. Congenital lactose intolerance is triggered by severe mutations on both alleles of the lactase gene. BMC Gastroenterol 2015; 15:36.
- Di Rienzo T., D’angelo G., D’aversa F. et al. Lactose intolerance: from diagnosis to correct management. Eur Rev Med Pharmacol Sci 2013; 17:18-25.
- Enattah N.S., Sahi T., Savilahti E. et al. Identification of a variant associated with adult-type hypolactasia. Nat Genet 2002; 30:233-7.
- Khabarova Y., Grigoryeva V., Tuomisto S. et al. High prevalence of lactase non-persistence among indigenous nomadic Nenets, north-west Russia. Int J Circumpolar Health 2012 Apr 25;71:1-6.
- Zhao J., Fox M., Cong Y. et al. Lactose intolerance in patients with chronic functional diarrhoea: The role of small intestinal bacterial overgrowth. Aliment Pharmacol Ther 2010; 31:892-900.
- Tomba C., Baldassarri A., Coletta M. et al. Is the subjective perception of lactose intolerance influenced by the psychological profile? Aliment Pharmacol Ther 2012; 36:660-9.
- Mattar R., de Campos Mazo D.F., Carrilho F.J. Lactose intolerance: diagnosis, genetic, and clinical factors. Clin Exp Gastroenterol 2012;5:113-21.
- Shaukat A., Levitt M.D., Taylor B.C. et al. Systematic review: effective management strategies for lactose intolerance. Ann Intern Med 2010 Jun 15;152(12):797-803.
- Montalto M., Curigliano V., Santoro L. et al. Management and treatment of lactose malabsorption. World J Gastroenterol 2006;12(2):187-91.
- Labayen I., Forga L., González A. et al. Relationship between lactose digestion, gastrointestinal transit time and symptoms in lactose malabsorbers after dairy consumption. Aliment Pharmacol Ther 2001 Apr;15(4):543-9.
- Vallaeys L., van Biervliet S., de Bruyn G. et al. Congenital glucose-galactose malabsorption: A novel deletion within the SLC5A1 gene. Eur J Pediatr 2013; 172:409-11.
- Bothinah Ghazali, Sultan A. Almedhesh, Ali M. Alsuheel et al. Congenital glucose-galactose malabsorption: A rare cause of chronic diarrhea. Intern J Med Medical Scienc 2014; 6(2):59-62.
- Gomara R.E., Halata M.S. Fructose intolerance in children presenting with abdominal pain. J Pediatr Gastroenterol Nutr 2008; 47:303-8.
- Jones H.F., Butler R.N., Brooks D.A. Intestinal fructose transport and malabsorption in humans. Am J Physiol Gastrointest Liver Physiol 2011; 300:G202-G206.
- Ledochowsky M., Widner B., Bair H. et al. Fructose and sorbitol reduced diet improves mood and gastrointestinal disturbances in fructose malabsorbers. Scand J Gastroentrol 2000; 35:1048-52.
- Frieling T. Fructose malabsorption: how much fructose can a healthy subject tolerate? Digestion 2011; 84:269-72.
- Puntis J.W., Zamvar V. Congenital sucrase-isomaltase deficiency: Diagnostic challenges and response to enzyme replacement therapy. Arch Dis Child 2015; 100:869-71.
- Uhrich S., Wu Z., Huang J.-Y. et al. Four mutations in the SI gene are responsible for the majority of clinical symptoms of CSID. J Pediatr Gastroent Nutr 2012; 55(Suppl 2):S34- S35.
- Robayo-Torres C.C., Opekun A.R., Quezada-Calvillo R. et al. 13C-breath tests for sucrose digestion in congenital sucrase isomaltase-deficient and sacrosidase-supplemented patients. J Pediatr Gastroenterol Nutr 2009; 48:412-18.
- Treem W.R. Clinical aspects and treatment of congenital sucrase-isomaltase deficiency. J Pediatr Gastroenterol Nutr 2012; 55:S7-S13.
- Macdonald S. Carbohydrate intolerances. In: Shaw V. ed. Clinical paediatric dietetics, 4th edn. Chichester: Wiley Blackwell; 2015. P. 121-3.
- Murray I.A., Coupland K., Smith J.A. et al. Intestinal trehalase activity in a UK population: estabilishing a normal range and the effect of disease. Br J Nutr 2000: 83; 241-5.
- Arola H., Koivula T., Karvonen A.L. et al. Low trehalase activity is associated with abdominal symptoms caused by edible mushrooms. Scand J Gastroenterol 1999 Sep; 34(9):898-903. PubMed PMID: 10522609.
- Gibson P.R. History of the low FODMAP diet. J Gastroenterol Hepatol 2017 Mar; 32(Suppl 1):5-7. doi: 10.1111/jgh.13685. Review. PubMed PMID: 28244673.
- Ganiats T.G., Norcross W.A., Halverson A.L. et al. Does Beano prevent gas? A double-blind crossover study of oral alpha-galactosidase to treat dietary oligosaccharide intolerance. J Fam Pract 1994; 39(5):441-5.
- Hillila M., Fakkila M.A., Sipponen T. et al. Does oral alpha-galactosidase relieve irritable bowel symptoms? Scand J Gastroenterol 2016; 51(1):16-21.
- Di Nardo G., Oliva S., Ferrari F. et al. Efficacy and tolerability of alpha-galactosidase in treating gas-related symptoms in children. A randomized, double-blind, placebo-controlled trial. BMC Gastroenterol 2013; 13:142.
- Banasiewicz T., Krokowicz L., Stojcev Z. et al. Micro-encapsulated sodium butyrate reduces the frequency of abdominal pain in patients with irritable bowel syndrome. Colorectal Dis 2013; 15:204-9.
- Kannampalli P., Shaker R., Sengupta J.N. Colonic butyrate- algesic or analgesic? Neurogastroenterol Motil 2011; 23:975-9.
- Tana C., Umesaki Y., Imaoka A. et al. Altered profiles of intestinal microbiota and organic acids may be the origin of symptoms in irritable bowel syndrome. Neurogastroenterol Motil 2010; 22(5):512-9.
- Monsbakken K., Vandvik P., Farup P. Perceived food intolerance in subjects with irritable bowel syndrome — Etiology, prevalence and consequences. Eur J Clin Nutr 2006; 60:667-72.
- Simren M., Mansson A., Langkilde A.M. et al. Food-related gastrointestinal symptoms in the irritable bowel syndrome. Digestion 2001; 63:108-15.
- Miller L.E., Tennilä J., Ouwehand A.C. Efficacy and tolerance of lactitol supplementation for adult constipation: a systematic review and meta-analysis. Clin Exp Gastroenterol 2014; 7:241-8.
- Hayes P., Corish C., O’Mahony E., Quigley E.M. A dietary survey of patients with irritable bowel syndrome. J Hum Nutr Diet 2014; 27:36-47.
- Wilder-Smith C.H., Materna A., Wermelinger C. et al. Fructose and lactose intolerance and malabsorption testing: the relationship with symptoms in functional gastrointestinal disorders. Aliment Pharmacol Ther 2013; 37:1074-83.
- Saad R.J., Chey W.D. Breath tests for gastrointestinal disease: the real deal or just a lot of hot air? Gastroenterology 2007; 133(6):1763-6.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru






