В профилактике рецидивов после проведенного наружного полноценного лечения поверхностных микозов кожи важная роль отводится ундециленовой кислоте – неспецифическому компоненту врожденной иммунной системы кожи. Являясь физиологичным продуктом, ундециленовая кислота с успехом применяется в дерматологической практике в лекарственной форме мазь (противогрибковый препарат Микосептин®) для лечения и профилактики рецидивов поверхностных микозов у взрослых и детей старше 2-х лет. Ундециленовая кислота и ее соли оказывают выраженное фунгистатическое действие в отношении дерматофитов.
Ключевые слова: дерматофитии, наружная терапия, циклопирокс, ундециленовая кислота, клинические исследования, профилактика рецидивов.
Для цитирования: Касихина Е.И. Возможности лечения и профилактики рецидивов поверхностных микозов кожи // РМЖ. Медицинское обозрение. 2017. №11. С. 854-858
Kasikhina E.I.
Central State Medical Academy of the Facilities and Property Management Office under the RF President, Moscow
Central State Medical Academy of the Facilities and Property Management Office under the RF President, Moscow
The article presents data of randomized clinical trials confirming the efficacy and safety of 1% cream of cyclopyrox (Batrafen) used for external therapy of superficial mycoses of skin of dermatophyte and non-dermatophytic etiology. Cyclopyrox belongs to the chemical class of hydroxypyridones with a unique multilevel antifungal mechanism of action, different from other external antifungal agents. Cyclopyrox and its salt, cyclopyroxolamine, has a moderate anti-inflammatory effect, proven in clinical studies as well as in vitro. The review presents the data of studies of pharmacodynamics and mycological activity of the drug in various layers of the skin. Despite the lower efficacy of cyclopyrox compared to systemic antimycotics, it has a good benefit / risk ratio due to its excellent tolerability and complete absence of serious adverse effects.
A part of the article is devoted to the prevention of relapses after a complete external treatment of superficial skin mycoses, it describes an important role played by undecylenic acid, a nonspecific component of the innate immune system of the skin. As a physiological product, undecylenic acid is successfully used in dermatological practice in the form of ointment (antifungal drug Mikoseptin) for the treatment and prevention of relapses of superficial mycoses in adults and children over 2 years of age. Undecylenic acid and its salts have a pronounced fungistatic effect against dermatophytes.
Key words: dermatophytosis, external therapy, cyclopyrox, undecylenic acid, clinical studies, prevention of relapses.
For citation: Kasikhina E.I. The possibilities of treatment and prevention of relapses of superficial skin mycoses // RMJ. 2017. № 11. P. 854 –858.
Рассмотрены возможности лечения и профилактики рецидивов поверхностных микозов кожи
Содержание статьи
Введение
Поверхностные микозы кожи по праву могут считаться междисциплинарной проблемой во всем мире: у 20% населения Земли регистрируются те или иные грибковые поражения кожи, волос и ногтей. Для многих стран мира микозы кожи, вызываемые дерматофитами, – важная проблема общественного здравоохранения. Доля поверхностных микозов в структуре дерматологических заболеваний составляет 37–40% [1, 2].
В структуре дерматофитий лидируют микозы стоп, их доля в общем числе обращений – 80%. Риск заболеть микозами стоп многократно возрастает у лиц с сопутствующими заболеваниями и удваивается каждые 10 лет жизни. Так, доля микозов стоп среди 7–10-летних составляет 1,8%, среди 14–17-летних – 13,4% и среди юношей и девушек 15–18 лет – 17,1% [3]. Это объясняется популяризацией спорта, посещением бассейнов, саун, бань, а также ростом числа эндокринно-метаболических заболеваний и хронических воспалительных болезней кожи. Инфекционные заболевания, вызываемые микроорганизмами рода Trichophyton, включают не только микоз стопы (так называемая стопа атлета) и онихомикоз, но также инфекционные заболевания паховой области (дерматомикоз паховый), которые широко распространены среди лиц мужского пола. Кроме того, существует проблема развития патологического процесса на коже верхней части тела (микоз гладкой кожи туловища), особенно среди молодых людей, занимающихся спортивной борьбой, частота встречаемости данной патологии у этого контингента варьирует в диапазоне от 24 до 77% [4].
Лечение
Существует мнение, что системные противогрибковые препараты более эффективны для лечения поверхностных микозов кожи, чем топические средства, и, следовательно, должны рассматриваться как препараты выбора, но следует не забывать о возможности развития побочных реакций. Так, например, частота возникновения нежелательных реакций при приеме системного тербинафина составляет около 10% (самыми грозными осложнениями являются агранулоцитоз и синдром Стивенса – Джонсона). Оральные азолы (в частности, флуконазол и итраконазол) могут вызывать по меньшей мере одну неблагоприятную реакцию примерно у 39% пациентов: сыпь, гепатотоксичность и ряд других вплоть до тератогенного эффекта. Кроме того, существует высокий риск взаимодействия с другими лекарственными препаратами при их одновременном приеме [5].
Следовательно, использование современных наружных противогрибковых средств для лечения поверхностных микозов (терапия первой линии) представляется более рациональным, поскольку эти средства способны обеспечить клиническое и микологическое излечение, сопоставимое с системной терапией, и при этом без развития побочных эффектов.
Механизм противогрибкового действия большинства топических антимикотиков, используемых в клинической практике, сходен и основан на ингибировании биосинтеза или молекулярного взаимодействия с эргостеролом – основным компонентом грибковой клеточной мембраны. Единственным классом топических противогрибковых средств с иным механизмом действия являются гидроксипиридоны. Известный представитель этого класса в России – циклопирокс (Батрафен®), выпускаемый в различных лекарственных формах для наружного применения (рис. 1). К гидроксипиридонам также относятся рилопирокс (экспериментальный препарат, находится на доклиническом этапе испытаний) и менее известный в России октопирокс, который в последнее время проходит доклинические и клинические исследования [6]. Циклопирокс, включая его соль циклопироксоламин, – относительно старое противогрибковое средство, разработанное в конце 1960-х годов [7]. Начиная с 1976 г. проведены многочисленные клинические исследования эффективности препарата при лечении поверхностных микозов, результаты опубликованы в журнале Arzneimittel Forschung в 1981 г. [7, 8]. 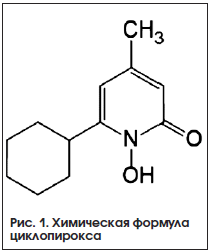
Поскольку оламин не изменяет фармакологических свойств циклопирокса в любом соотношении, между этими двумя формами не проводится никакого различия и в научной литературе обычно используется термин «циклопирокс» (ciclopirox). Препарат до сих пор является объектом научных и клинических исследований по изучению его механизма действия и эффективности при различных инфекционных состояниях, вызванных поверхностными грибами.
Циклопирокс – современное фунгицидное средство, активное в отношении дерматофитов (Trichophyton rubrum, Epidermophyton floccosum, Microsporum canis, T. mentagrophytes) и недерматофитов (дрожжеподобных и мицелиальных грибов, плесеней). Значения фунгицидных концентраций при однодневном применении превышают максимальную плазменную концентрацию в 20–30 раз. Циклопирокс также активен в отношении Malassezia furfur и некоторых устойчивых к азолам видов Candida spp. (C. glabrata и C. krusei), некоторых штаммов грамположительных (включая резистентные штаммы Staphylococcus aureus) и большинства штаммов грамотрицательных бактерий (Escherichia coli, Pseudomonas aeruginosa, Salmonella typhimurium, Klebsiella aerogenes, Enterobacter cloacae, Gardnerella vag.), действует бактериостатически. Для лечения грибковых поражений кожи (разноцветный лишай, кандидоз кожи и дерматофитии) циклопирокс в виде крема наносят на пораженные области кожи 2 р./сут. После нанесения крема участок кожи подсушивают. Лечение обычно продолжают в течение 2-х недель до исчезновения всех симптомов заболевания. Затем для предотвращения рецидива циклопирокс применяют еще в течение 1–2-х недель.
С помощью ряда экспериментальных фармакологических и клинических исследований были изучены особенности проникновения циклопирокса крема в разные слои кожи [9]. А. Täuber et al. в 2015 г. проанализировали проницаемость и проникновение циклопироксоламина in vitro через кератиновые пленки и пластины бычьих копыт, которые явились моделями искусственных ногтей, а также рогового слоя кожи человека. Композиции состояли из полоксамера 407 (Р407), двойной дистиллированной воды, пропиленгликоля, изопропилового спирта и триглицеридов со средней длиной цепи в заданных соотношениях. Все составы имели полутвердую и жидкую консистенцию и были изотропны под поляризационным микроскопом. При включении циклопироксоламина, составы становились более мягкими, а величина предела текучести снижалась. Данные исследований проницаемости через кератиновые пленки и пластины показали более высокую скорость проницаемости для 8% лака, но способность сохранять терапевтические уровни препарата в кератине были выше для 1% крема циклопирокс [9].
Радиологические исследования трупной кожи человека показали, что концентрации 70–600 мг/мл обнаруживаются в верхних слоях эпидермиса уже в течение 1–2 ч после местного применения и что эти высокие концентрации сохраняются в течение всего периода лечения на поверхности кожи, в волосяных фолликулах и эпидермисе. Концентрации препарата уменьшаются с увеличением глубины кожи, но в пределах 20–30 мг/мл (значительно превышающих минимальные ингибирующие концентрации для чувствительных организмов) определяются в сосочковом слое дермы. Трансэпидермальная проницаемость 1% крема циклопирокс, нанесенного различными способами, была изучена in vitro и in vivo в нескольких клинико-фармакологических исследованиях [10, 11]. Показано, что через 1,5–6 ч после нанесения на кожу концентрация крема превышает минимальную подавляющую концентрацию (МПК) в отношении патогенных грибов во много раз (МПК для дерматофитов, грибов рода кандида, плесневых и дрожжеподобных грибов – 0,98–3,9 мкг/мл, для микоплазмы и Trichomonas vaginalis – 7,8–31,3 мкг/мл). При нанесении циклопирокса на обширные поверхности (750 см2) и на длительное время (6 ч и более) препарат может обнаруживаться в крови (1,3% дозы), при этом 94–97% его связывается с белками плазмы. Период полувыведения составляет около 1,7 ч. Способность всасываться – 1,3–2,4%. Метаболиты препарата в виде глюкуронидов выводятся из организма через почки.
Циклопирокс отличается низкой растворимостью в воде. Лекарственная форма 1% крем (что соответствует 0,77% активного вещества) представляет собой эмульсию по типу «масло в воде», где активный ингредиент растворен в парафине. Клиническая эффективность топических форм циклопирокса отражена в табл. 1. Необходимо отметить, что в доступных источниках опубликовано около 20 рандомизированных, двойных слепых и плацебо-контролируемых клинических исследований антифунгальной активности циклопирокса при лечении микозов кожи (кандидоза кожи, микозов стоп, разноцветного лишая и микозов кожи туловища и других локализаций). Клиническое и микологическое выздоровление в отдаленные сроки составляет 30–90%. 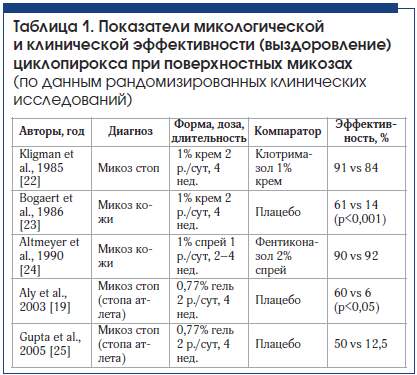
В последнее десятилетие вырос интерес к циклопироксу как к эффективному средству для лечения себорейного дерматита. В связи с этим было проведено 13 рандомизированных клинических испытаний, в которых приняли участие более 3200 человек [12]. Изучается лечебный эффект циклопирокса как альтернативы кетоконазолу в терапии себорейного дерматита, поскольку он подавляет рост дрожжеподобных грибов Malassezia spp. [13]. При проведении испытания циклопирокса его МПК в отношении M. globosa и M. restricta cоставила 7,3 мг/мл [14]. Результаты клинических испытаний показали эффективность циклопирокса, аналогичную кетоконазолу с относительным увеличением субъективного облегчения симптомов себорейного дерматита из-за присущих циклопироксу противовоспалительных свойств [13].
Также неоднократно проводилась оценка безопасности препарата. В литературе описаны явления контактного дерматита, встречающиеся не чаще 5% в исследуемой популяции. Безопасность циклопирокса при аппликациях на кожу была тщательна изучена еще в 1985 г. Jue S.G. et al. [15]. Препарат хорошо переносился пациентами. Неблагоприятные эффекты ограничивались локальными реакциями, характеризующимися раздражением, покраснением, болью, жжением или зудом, и возникали у 1% пациентов.
Оценка безопасности циклопирокса в лечении поверхностных микозов, в т. ч. себорейного дерматита, была проведена А.К. Gupta et al. [16, 17]. Побочные явления в исследованиях были редкими. Самые распространенные жалобы, включая жжение, раздражение, покраснение, боль или зуд, возникали менее чем у 5% пациентов. Сообщения об аллергическом контактном дерматите в литературе встречаются редко, проявления быстро разрешались после отмены циклопирокса и лечения дерматита [18, 19].
С целью профилактики грибковых инфекций у лиц с высоким риском их возникновения 1% крем циклопирокс рекомендуют применять еще в течение 1–2-х недель после исчезновения всех клинических симптомов. В состав вспомогательных веществ крема циклопирокс включена молочная кислота, оказывающая благоприятный эффект на рН и барьерные функции кожи.
Противорецидивное лечение
Профилактика рецидива микозов после адекватно проведенной антимикотической терапии с каждым годом становится актуальнее и требует от практического врача определенных знаний. К группе риска относят пациентов пожилого и старческого возраста, которым по ряду причин противопоказаны системные антимикотики, пациенты с сахарным диабетом, гипотиреозом, хронической венозной недостаточностью. Следует помнить, что защитная функция кожных покровов и слизистых оболочек обеспечивается не только их анатомическими, физиологическими особенностями, но также неспецифическими (постоянство рН-среды, присутствие лизоцима, ундециленовой кислоты и т. д.) и специфическими (секреторный IgА) факторами защиты. Исследованиями показано, что полноценно зрелая кожа характеризуется наличием водно-липидной мантии и физиологическими значениями рН 4,5–6,0 [20]. Кислая pH необходима для эффективного функционирования ферментов в роговом слое (в частности, мирамидазы), компонентов врожденной иммунной системы (лизоцима и лактоферрина, антимикробных пептидов), обеспечивая адекватную защитную функцию рогового слоя и подавляя колонизацию и адгезивную активность патогенов (липофильных грибов и дерматофитов, S. аureus). Рядом исследований показано, что ферменты верхних слоев эпидермиса оптимально функционируют при уровне pH 5,6. Кислотность кожи более постоянная в областях, где функционируют эккриновые потовые железы. В местах локализации апокриновых потовых желез уровень рН изменчив и ближе к слабощелочному. В подмышечных впадинах с приближением полового созревания уровень рН приближается к нейтральному, а во время пубертата становится щелочным. Чем выше содержание солей в поте, тем он менее кислый (важно при патологии почек). Пот, выделяемый при действии высокой температуры, имеет значимо низкий рН (кислую реакцию), чем выделяемый при физических нагрузках или под влиянием медикаментов. Приуроченность очагов дерматофитий к тем или иным участкам кожного покрова определяется микротравмами, измененным сало- и потоотделением, нарушением процессов деления клеток кожи.
На формирование рН и функционирование противогрибковой врожденной защиты влияет синтезируемая организмом ундециленовая кислота – одноосновная карбоновая кислота с низкой молекулярной массой. Являясь физиологичным продуктом, ундециленовая кислота с успехом применяется в дерматологической практике в лекарственной форме как мазь (противогрибковый препарат Микосептин®) для лечения и профилактики поверхностных микозов у детей старше 2-х лет. Ундециленовая кислота и ее соли оказывают выраженное фунгистатическое действие в отношении дерматофитов рода Trichophyton, Epidermophyton, Microsporum.
Микосептин® благодаря уникальному физиологическому химическому составу не утратит активности со временем. Входящая в состав средства ундециленовая кислота является физиологичным фактором для поддержания кислой рН кожи, которая, в свою очередь, влияет на процесс адекватной кератинизации, предотвращает избыточную трансэпидермальную потерю жидкости и натурального увлажняющего фактора (NMF). Для грибов-ксерофилов нарушение вышеуказанных процессов создает благоприятные условия для размножения. Осмопротекторы (молочная кислота, ундециленовая кислота, аминокислоты NMF, липиды) нарушают адаптацию мицелиальных и дрожжевых грибов в роговом слое, индуцируя образование в клетке гриба особых стрессовых белков. Адгезивные свойства грибов зависят от температуры окружающей среды, влажности, завышения показателей рН кожи, длительности контакта и соотношения клеток эпителия хозяина и клеток гриба, т. е. массивности обсеменения [21]. Роль ундециленовой кислоты заключается в нарушении адгезии грибов к клеткам рогового слоя, поэтому препараты с ее содержанием с успехом применяются для профилактики поверхностных микозов в группах риска (в т. ч. у лиц, склонных к гиперкератозу и сухости кожи). Цинк, входящий в состав мази Микосептин®, оказывает вяжущее действие, снижая, таким образом, проявления признаков раздражения кожных покровов, способствуя более быстрому заживлению микродефектов.
Для лечения поверхностных дерматофитий мазь Микосептин® наносят на чистую, сухую поверхность пораженной кожи 2 р./сут. Продолжительность курса лечения составляет 4–6 нед. После исчезновения клинических проявлений заболевания, для предотвращения рецидива рекомендуется наносить мазь 1 р./сут в течение недели и далее – через день или 2 р./нед. в течение 1 мес. (табл. 2).
По рекомендации специалиста возможно использовать ундециленовую кислоту как средство вторичной профилактики, т. е. у пациентов, уже перенесших онихомикоз или микозы другой локализации. Особенно это касается лиц из групп риска, часто посещающих бассейны, спортивные залы. Частое и длительное пребывание в бассейне способствует развитию инфекционных заболеваний паховой области (дерматомикоз паховый), которые широко распространены у лиц мужского пола. Первичная профилактика грибковой инфекции у пациентов, ранее не болевших микозами, включает соблюдение санитарно-гигиенических норм: использование индивидуальной удобной обуви, одежды и предметов обихода, гигиену стоп, уход за ногтями, предотвращение травматизации кожи и ногтей.
Заключение
Несмотря на значительный прогресс, достигнутый в системной терапии микозов, лечение дерматофитий редко обходится без наружной терапии. Поздняя обращаемость больных к микологу и дерматологу, самолечение или неудачно пролеченный процесс (например, онихомикоз) зачастую приводят к хроническому воспалительному процессу с преобладанием застойных сквамозно-гиперкератотических явлений. Наиболее перспективно применение антимикотических препаратов с уникальным сочетанием антибактериального и противовоспалительного действия: 8% лак, 1% крем циклопирокс (Батрафен®). Учитывая, что в большинстве случаев противогрибковая терапия назначается на продолжительное время, врачу важно убедиться в отсутствии лекарственной устойчивости дерматофитов к препарату. Рядом микробиологических исследований доказано отсутствие формирования резистентности к циклопироксу [2]. С позиций доказательной медицины в терапии дерматомикозов и онихомикозов циклопирокс является одним из наиболее эффективных современных наружных противогрибковых препаратов, используемых для лечения поверхностных микозов.
Учитывая, что большинство поверхностных микозов лечатся амбулаторно, рациональный подход к профилактике рецидива не менее важен, чем базовый курс лечения. С этой целью после исчезновения клинических проявлений заболевания, для предотвращения рецидива рекомендуется наносить мазь Микосептин® 1 р./сут в течение недели, далее – через день или 2 р./нед. в течение 1 мес. Антимикотик Микосептин® благодаря своему уникальному химическому составу – сочетанию ундециленовой кислоты и ундецилената цинка – способствует не только устранению инфекта, но и формирует условия, неблагоприятные для существования грибов.
Литература
1. Havlickova A., Czaika V.A., Friedrich M. Epidemiological trends in skin mycoses worldwide // Mycoses. 2008. Vol. 51(4). P. 2–1511.
2. Ghannoum M., Isham N. Fungal Nail Infections (Onychomycosis): A Never-Ending Story? // PloS Pathog. 2014. Vol. 10(6). P. 104–113.
3. Файзулина Е.В. Организация системы профилактики микозов стоп среди населения на основании факторного анализа распространенности грибковой патологии // Практ. мед. 2014. № 84(8). С. 39–43 [Fayzulina Ye.V. Organizatsiya sistemy profilaktiki mikozov stop sredi naseleniya na osnove faktornogo analiza rasprostranennosti gribkovoy patologii // Prakt.med. 2014. № 84(8). S. 39–43 (in Russian)].
4. Аdams B.B. Tinea corporis gladiatorum: a cross-sectional study // J. Am. Acad. Dermatol. 2000. Vol. 43. P. 1039–1041.
5. Chen S. C.A., Sorrell T.C. Antifungal agents // Med J Aust. 2007. Vol. 187. P. 404–409.
6. Veraldi S., Menter A., Innocenti M. Treatment of mild to moderate seborrhoeic dermatitis with MAS064D (Sebclair), a novel topical medical device: results of a pilot, randomized, double-blind, controlled trial // J Eur Acad Dermatol Venereol. 2008. Vol. 22. P. 290–296.
7. Dittmar W., Lohaus G. HOE 296, a new antimycotic compound with a broad antimicrobial spectrum // Arzneimittelforschung. 1973. Vol. 23. P. 670–674.
8. Subissi A., Monti D., Togni G. Ciclopirox recent nonclinical and clinical data relevant to its use as a topical antimycotic agent // Drugs. 2010. Vol. 70. P. 2133–2152.
9. Täuber A., Müller-Goymann C.C. In vitro permeation and penetration of ciclopirox olamine from poloxamer 407-based formulations-comparison of isolated human stratum corneum, bovine hoof plates and keratin films // Int J Pharm. 2015. Vol. 15. P. 489(1–2), 73–82.
10. Ceschin-Roques C.G., Hanel H., Pruja-Bougaret S.M. et al. Ciclopiroxolamine cream 1%: in vitro and in vivo penetration into the stratum corneum // Skin Pharmacol. 1991. Vol. 4(2). P. 95–99.
11. Coppi G., Silingardi S., Girardello R. Pharmacokinetics of ciclopirox olamine after vaginal application to rabbits and patients // J Chemother. 1993. Vol. 5. P. 302–306.
12. Mayser P., Kupfer J., Nemetz D. et al. Treatment of head and neck dermatitis with ciclopiroxolamine cream: results of a double-blind, placebo-controlled study // Skin Pharmacol Physiol. 2009. Vol. 19. P. 153–158.
13. Ratnavel R.C., Squire R.A., Boorman G.C. Clinical efficacies of shampoos containing ciclopirox olamine (1.5%) and ketoconazole (2.0%) in the treatment of seborrhoeic dermatitis // J Dermatolog Treat. 2007. Vol. 18(2). P. 88–96.
14. Roques C., Brousse S., Panizzutti C. In vitro antifungal efficacy of ciclopirox olamine alone and associated with zinc pyrithione compared to ketoconazole against Malassezia globosa and Malassezia restricta reference strains // Mycopathologia. 2006. Vol. 162(6). P. 395–400.
15. Jue S.G., Dawson G.W., Brogden R.N. Cyclopirox olamine 1% cream: a preliminary review of its antimicrobial activity and therapeutic use // Drugs. 1985. Vol. 29. P. 330–341.
16. Gupta A.K., Skinner A.R. Ciclopirox for the treatment of superficial fungal infections: a review // Int J Dermatol. 2003. Vol. 42 Suppl. 1. P. 3–9.
17. Gupta A.K., Nicol K.A. Ciclopirox 1% shampoo for the treatment of seborrheic dermatitis // Int J Dermatol. 2006 . Vol. 45 (1). P. 66–69.
18. Aly R., Katz H.I., Kempers S.E. et al. Ciclopirox gel for seborrheic dermatitis of the scalp // Int J Dermatol. 2003. Vol. 42 Suppl. 1. P. 19–22, 92.
19. Aly R., Fisher G., Katz I. et al. Ciclopirox gel in the treatment of patients with interdigital tinea pedis // Int J Dermatol. 2003. Vol. 42 Suppl. 1. P. 29–35.
20. Giusti F., Martella A., Bertoni L. et al. Skin barrier, hydration, and pH of the skin of infants under 2 years of age // Pediatr Dermatol. 2001. Vol. 18. P. 93–96.
21. Сергеев А.Ю., Сергеев Ю.В. Факторы резистентности и иммунитет при грибковых инфекциях кожи и слизистых оболочек // Иммунопатология, аллергология, инфектология. 2004. №1. C. 6–14 [Sergeyev A.Yu., Sergeyev Yu.V. Faktory rezistentnosti i immunitet pri gribkovykh infektsiyakh kozhi i slizistykh obolochek // Immunopatologiya, allergologiya, infektologiya. 2004. №1. S. 6–14 (in Russian)].
22. Kligman A.M., Bogaert H., Cordero C. et al. Evaluation of ciclopirox olamine cream for the treatment of tinea pedis: multicenter, double-blind, comparative studies // Clin Ther. 1985. Vol. 7. P. 409–17.
23. Bogaert H., Cordero C., Ollague W. et al. Multicentre double-blind clinical trials of ciclopirox olamine cream 1% in the treatment of tinea corporis and tinea cruris // J Int Med Res. 1986. Vol. 14. P. 210–216.
24. Altmeyer P., Nolting S., Kuhlwein A. et al. Effect of fenticonazole spray in cutaneous mycosis: a double-blind clinical trial versus cyclopyrox olamine spray // J Int Med Res. 1990. Vol. 18(1). P. 61–67.
25. Gupta A.K., Skinner A.R., Cooper E.A. Evaluation of the efficacy of ciclopirox 0.77% gel in the treatment of tinea pedis interdigitalis (dermatophytosis complex) in a randomized, double-blind, placebo-controlled trial // Int J Dermatol. 2005. Vol. 44(7). P. 590–593.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru