Урология
Ключевые слова: рак предстательной железы, внутритканевая лучевая терапия, высокомощностная брахитерапия, Ir-192 , показания, противопоказания.
Для цитирования: Каприн А.Д., Бирюков В.А., Карякин О.Б., Галкин В.Н., Иванов С.А., Обухов А.А., Борышева Н.Б., Лепилина О.Г., Гуменецкая Ю.В., Гулидов И.А. Применение высокомощностной брахитерапии Ir-192 в лечении рака предстательной железы // РМЖ. 2017. №8. С. 492-495
Kaprin A.D.1, Biryukov V.A.2, Karyakin O.B.2, Galkin V.N.2, Ivanov S.A.2, Obukhov A.A.2, Borysheva N.B.2, Lepilina O.G.2, Gumenetskaya Yu.V.2, Gulidov I.A.2
1 National medical research radiological center, Moscow
2 Medical Radiological Research Center named after A.F. Tsyba — Branch of the National medical research radiological center, Obninsk
The development of modern technologies and software has opened before radiotherapists and oncologists the new opportunities for the use of interstitial radiation therapy, namely a high-dose rate (HDR) brachytherapy. This method provides more effective and economically efficient treatment of the patients with prostate cancer with both a localized and regional variant of the disease. The article briefly describes the stages of development of HDR brachytherapy of prostate cancer. The main advantages and disadvantages of the method are reflected in accordance with the data of the International Atomic Energy Agency (IAEA) as compared to the low-dose rate brachytherapy. Methodical recommendations on the application of the method are given, as well as summary data on the effectiveness of HDR brachytherapy both in combination with remote radiation therapy and alone. The article shows the results of HDR brachytherapy application in the Medical Radiological Research Center named after A.F. Tsyba. A clinical example is given to demonstrate the possibility of using this technique in the treatment of recurrent prostate cancer after previously performed low-dose rate brachytherapy.
Key words: prostate cancer, interstitial radiation therapy, high-dose rate (HDR) brachytherapy, Ir-192, indications, contraindications.
For citation: Kaprin A.D., Biryukov V.A., Karyakin O.B. et al. The use of high-dose rate brachytherapy Ir-192 in the treatment of prostate cancer // RMJ. 2017. № 8. P. 492–495.
Статья посвящена возможностям применения брахитерапии Ir-192 в лечении рака предстательной железы
Содержание статьи
Введение
Высокомощностная брахитерапия рака предстательной железы (РПЖ) представляет собой закономерное развитие техники внутритканевой лучевой терапии с использованием временных источников излучения с активностью от 12 Гр/ч и выше. Данная методика была впервые предложена в 1955 г. в New York Memorial Hospital (США) немецким врачом Ulrich Henschke, разработавшим новый принцип внутритканевой терапии (afterloading), предусматривающий последовательное введение интрастатов и радиопрепаратов [1]. Современный этап развития высокомощностной брахитерапии РПЖ начался в 1986 г. в Киле (Германия), а в 1989 и 1991 гг. собственные разработки появились в университетских клиниках Сиэтла, Калифорнии и Мичигана [2].
Наиболее часто в современных клиниках, применяющих высокомощностную брахитерапию, используется короткоживущий гамма-препарат иридий-192 (Ir-192), представляющий собой микроисточник длиной около 3,5 мм и диаметром не более 0,5 мм.
Преимущества и недостатки брахитерапии в лечении РПЖ
В лечении РПЖ высокомощностная внутритканевая лучевая терапия в сравнении с низкомощностной брахитерапией, согласно рекомендациям Международного агентства по атомной энергии (МАГАТЭ) [3], имеет ряд преимуществ:
• нераспространение радиационных доз на персонал и посетителей;
• исключение подготовки и транспортировки источников для каждого пациента;
• меньший дискомфорт и более низкие риски тромбоэмболии в связи с коротким временем пребывания пациента в литотомическом положении;
• оптимальное распределение дозы;
• возможность интеграции дистанционной лучевой терапии и высокомощностной брахитерапии, что приводит к сокращению общей продолжительности лечения и потенциально лучшему контролю за опухолью;
• более высокая пропускная способность крупных специализированных центров;
• сокращенный период обучения персонала;
• отсутствие миграции источника относительно целевого объема в течение всего сеанса лучевого лечения;
• эффективный потенциал оптимизации дозы-объема, связанный с технологией движения источника;
• меньшая токсичность благодаря улучшенной защите зон риска: уретры, прямой кишки, мочевого пузыря, луковицы полового члена.
Те же рекомендации МАГАТЭ [3] указывают на недостатки высокомощностной брахитерапии:
• необходимость обеспечения высокого уровня гарантии качества перед каждым применением высокомощностной брахитерапии, связанная с использованием в схеме лечения нескольких фракций, требующих повторного введения интрастатов;
• отсутствие сравнительных и проспективных рандомизированных исследований качества жизни;
• неясная экономическая выгода по сравнению с низкомощностной брахитерапией. (Однако при высокой пропускной способности медицинского центра монотерапия Ir-192 имеет экономическое преимущество.)
С точки зрения современной радиобиологии при лучевой терапии РПЖ предпочтительно применение режимов гипофракционирования и, следовательно, высокомощностной брахитерапии. Так, соотношение α/β для аденокарциномы простаты принято считать равным 1,5 Гр (1,2–3 Гр). Для большинства опухолей и тканей, остро реагирующих на лучевую терапию, это соотношение приближается к 10 Гр. При этом для тканей, окружающих предстательную железу, соотношение α/β для поздних лучевых реакций равно 3 Гр. Опухоли с низким соотношением α/β являются более чувствительными при гипофракционировании, что позволяет считать применение высокомощностной брахитерапии при РПЖ более эффективной методикой по сравнению с традиционными технологиями лучевого лечения даже с эскалацией дозы, а также с низкомощностной брахитерапией.
Показания к высокомощностной брахитерапии
При отборе пациентов для высокомощностной брахитерапии необходимо учитывать критерии, включающие начальный уровень простатспецифического антигена (ПСА), стадию заболевания, уродинамические показатели, а также наличие предшествующих вмешательств на предстательной железе. В отличие от низкомощностной брахитерапии данный метод лечения ввиду своих особенностей и преимуществ позволяет проводить лечение практически у всех пациентов с локализованным и местнораспространенным РПЖ. Основные показания и противопоказания в соответствии с руководством Американского общества брахитерапевтов (ABS) [4] приведены в таблице 1.![Таблица 1. Показания и противопоказания к проведению высокомощностной брахитерапии [4] Таблица 1. Показания и противопоказания к проведению высокомощностной брахитерапии [4]](https://medblog.su/wp-content/uploads/2018/05/primenenie-vysokomoshhnostnoj-brahiterapii-ir-192-v-lechenii-raka-predstatelnoj-zhelezy-kaprin-a-d-biryukov-v-a-karyakin-o-b-galkin-v-n-ivanov-s-a-obuhov-a-a-borysheva-n-b-lepilina-o-g-gumenet.png)
Методика высокомощностной брахитерапии при РПЖ
Методика проведения высокомощностной брахитерапии сходна по своему исполнению с процедурой низкомощностной контактной лучевой терапии и описана ранее [5]. Изначально брахитерапия высокой мощностью дозы выполнялась только как буст (boost) – дополнение к дистанционной лучевой терапии (ДЛТ). В последующем, с развитием технологии, выполнением радиобиологических и клинических исследований появилась возможность использования высокомощностной брахитерапии в режиме монотерапии [6–8]. Возможно также применение высокомощностной брахитерапии в качестве спасительной (сальважной) при локальных рецидивах после предшествующей ДЛТ либо низкомощностной брахитерапии [9].
На сегодняшний день наиболее широкое применение получил режим с одной фракцией брахитерапии в сочетании с ДЛТ, демонстрирующий преимущество в снижении токсичности лечения, с не менее эффективным ответом по безрецидивной выживаемости (табл. 2) [10].
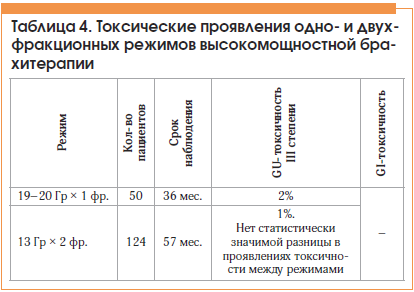
Использование высокомощностной брахитерапии в монорежиме в последние годы становится все более популярным. Некоторые исследователи демонстрируют хороший эффект и незначительные побочные реакции лечения, проводимого в монорежиме. Следует также отметить наметившуюся тенденцию к уменьшению количества проводимых фракций брахитерапии вплоть до выполнения лечения за один сеанс, что увеличивает преимущества данного метода лечения и делает его более востребованным [11, 12] (табл. 3 и 4).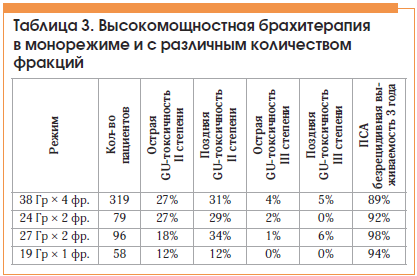
Собственный опыт
В марте 2016 г. в МРНЦ им. А.Ф. Цыба – филиале ФГБУ НМИРЦ МЗ РФ начато лечение больных локализованным и местнораспространенным РПЖ с использованием высокомощностной брахитерапии (Ir-192) в моно- и сочетанном режимах. Пациентам с благоприятным прогнозом (n=42) проводилась высокомощностная брахитерапия в монорежиме. Выполняли 2 фракции по 15 Гр каждая, что при переводе в дозу, эквивалентную облучению в режиме обычного фракционирования (EQD), рассчитанную согласно линейно-квадратической модели (при соотношении α/β для РПЖ, равном 1,5), составляет около 140 Гр. Интервал между фракциями составлял 2–3 нед. Пациентам с промежуточным и неблагоприятным прогнозом (n=46) проводили сочетанную лучевую терапию: сеанс высокомощностной брахитерапии 15 Гр за одну фракцию и курс 3-D конформной дистанционной лучевой терапии в суммарной очаговой дозе 40–46 Гр с включением в объем облучения предстательной железы и семенных пузырьков. Кроме того, трем пациентам выполнена спасительная высокомощностная брахитерапия при рецидиве после предшествующего лечения методом брахитерапии I-125 и дистанционного облучения.
На данный момент максимальный срок наблюдения за больными составляет 11 мес. У всех пациентов с низким уровнем онкологического риска, которым мы выполняли высокомощностную брахитерапию в монорежиме, отмечено снижение уровня ПСА, в среднем ниже 1,5 нг/мл. Пациенты с умеренным и высоким уровнем онкологического риска в настоящее время завершили или находятся в процессе реализации курса 3-D конформной ДЛТ в комбинации с гормональной терапией. Уровень ПСА в данной группе наблюдения составляет в среднем ниже 1,0 нг/мл.
Из клинически значимых осложнений, отмеченных нами при проведении лечения 91 больного РПЖ, следует отметить макрогематурию, наблюдавшуюся лишь в 1,0% случаев. Дизурические явления выше II степени тяжести (RTOG) не зарегистрированы. Реакции со стороны прямой кишки отмечены у пациентов, получающих сочетанное лучевое лечение, и не превысили токсичности I степени тяжести (RTOG).
Клинический пример
Пациент Б.В.К. 1939 года рождения. В 2008 г. установлен диагноз «рак предстательной железы» Т2NоMo, ПСА-45 нг/мл, Глисон 6(3+3). С 2008 г. начата гормонотерапия аналогами лютеинизирующего гормона рилизинг-гормона (ЛГРГ). В 2009 г. проведен курс сочетанной лучевой терапии: низкомощностная брахитерапия I-125 (СОД=140 Гр) и ДЛТ на область малого таза (СОД=40 Гр, РОД=2 Гр). В последующем получал адъювантную гормонотерапию аналогами ЛГРГ в течение 24 мес. С 2014 г. отмечен рост ПСА, в июле 2016 г. – до 9,13 нг/мл. Проведена позитронно-эмиссионная томография и компьютерная томография с холином, получены данные о наличии активной опухоли в основании предстательной железы с распространением на правый семенной пузырек. Данных за метастатическое поражение лимфоузлов и костей нет. Получено гистологическое подтверждение (биопсия) местного рецидива – ацинарная аденокарцинома Глисон 7(3+4). Урофлоуметрия (03.10.16): Qmax – 19 мл/с. Оценка баллов по шкале IPSS – 13. Объем предстательной железы, по данным МРТ, составил 25 см3. 25.10.2016 пациенту проведена спасительная (сальважная) высокомощностная внутритканевая лучевая терапия Ir-192, РОД=15 Гр (эквивалентно 71 Гр, при отношении α/β=1,5). С целью уменьшения лучевой нагрузки на прямую кишку выполнено введение формирующего геля, содержащего коллаген, между передней стенкой прямой кишки и предстательной железой. Следует отметить, что благодаря возможностям системы планирования высокомощностной брахитерапии в область семенных пузырьков и основания предстательной железы фокально удалось подвести дозу 18–22,5 Гр (эквивалентно более 120 Гр) (рис. 1 и 2).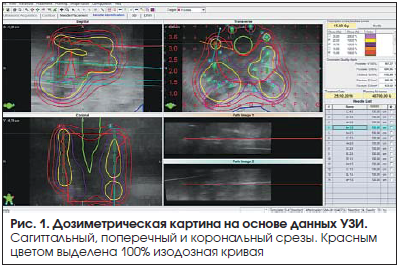

Уретральный катетер удален в день имплантации. Самостоятельное мочеиспускание восстановлено в полном объеме. Пациенту возобновлена гормонотерапия аналогами ЛГРГ. За 6-месячный период наблюдения побочных реакций со стороны нижних отделов мочевыводящих путей и прямой кишки не отмечено. Пациент находится под динамическим наблюдением.
Заключение
Данные, полученные к настоящему времени, подтверждают клиническую эффективность и безопасность применяемой методики, что, в свою очередь, дает основание продолжать и совершенствовать технологию высокомощностной брахитерапии в нашем центре: проводить клиническую апробацию новых режимов при моно- и сочетанной лучевой терапии, применять спасительную (сальважную) высокомощностную брахитерапию при рецидивах после лучевого лечения, а в перспективе – планировать выполнение фокальной высокомощностной брахитерапии у пациентов группы низкого риска.
Литература
1. J.N. Aronowitz Whitmore, Henschke, and Hilaris: The reorientation of prostate brachytherapy (1970–1987) // Brachytherapy. 2012. Vol. 11. P. 157–162.
2. D. Jeffrey Demanes, Michel I Ghilezan High-dose-rate brachytherapy as monotherapy for prostate cancer // Brachytherapy. 2014. Vol. 13. P. 529–541.
3. Implementation of High Dose Rate Brachytherapy in Limited Resource Settings. IAEA. 2015. 116 p.
4. Yamada Y., Rogers L., Demanes D.J. et al. American Brachytherapy Society consensus guidelines for high-dose-rate prostate brachytherapy // Brachytherahy. 2012. Vol. 11. P. 20–32.
5. Каприн А.Д., Паньшин Г.А., Альбицкий И.А. и др. Новая медицинская технология: Брахитерапия (локализованного) рака предстательной железы. Разрешение ФС № 2009/218 от 27.07.2009 [Kaprin A.D., Pan’shin G.A., Al’bitskiyI.A. et al. Novaya medicynskaya technologiya: Brachyterapiya (lokalisovannogo) raka predstatel’noy gelezy. Rasreshenie ФС № 2009/218 27.07.2009 (in Russian)].
6. Martinez A.A., Pataki I., Edmundson G. et al. Phase II prospective study of the use of conformal high-dose-rate brachytherapy as monotherapy for the treatment of favorable stage prostate cancer: A feasibility report // Int J Radiat Oncol Biol Phys. 2001. Vol. 49. Р. 61–69.
7. Rodriguez R.R., Demanes D.J., Altieri G.A. High dose rate brachyther- apy in the treatment of prostate cancer // Hematol Oncol Clin North Am. 1999. Vol. 13. Р. 503–523.
8. Schmid M., Crook J.M., Batchelar D. et al. A phantom study to assess accuracy of needle identification in real-time planning of ultrasound-guided high-dose-rate prostate implants // Brachytherapy.2013. Vol. 12. Р. 56–64.
9. Tharp M. et al. Prostate high-dose-rate brachytherapy as salvage treatment of local failure after previous external or permanent seed irradiation for prostate cancer // Brachytherapy. 2008. Vol. 7. P. 231–236.
10. Gaudet M. et al. Biochemical Control Rates and Toxicity of 3 Regimens of HDR Brachytherapy Boost for LocalizedProstate Cancer // Brachytherapy. 2016. Vol. 15. P. 182.
11. Krauss D. et al. Low and Intermediate Risk Prostate Cancer Treated with Single Fraction 19 Gy High Dose Rate Brachytherapy as Monotherapy: Outcomes Comparison to Multi-Fraction Regimens // Brachytherapy. 2016. Vol. 15. P. 75.
12. Hoskin P. et al. Single Dose Versus Two Fractions High-Dose Rate Afterloading Brachytherapy for Localised Prostate Cancer // Brachytherapy. 2016. Vol. 15. P. 50.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
