Введение
Транстиретиновая семейная амилоидная полинейропатия (ТТР-САП) — редкое генетическое прогрессирующее мультисистемное заболевание с преимущественным поражением периферической нервной системы, для которого характерно отложение амилоидного белка в различных органах и тканях. Амилоидные фибриллы, помимо эндоневрия периферических нервов, также откладываются в сердце, глазных яблоках, стенках средних и мелких артерий, органах желудочно-кишечного тракта (ЖКТ), почках, лептоменингеальных сосудах головного мозга и др. [1, 2]. ТТР-САП имеет аутосомно-доминантный тип наследования и развивается вследствие точечной мутации в гене транстиретина (TTR), располагающегося на 18-й хромосоме и имеющего 4 экзона [3, 4]. В настоящее время известно около 150 мутаций в гене TTR, причем некоторые из них преимущественно связаны с отложением эндоневрального амилоида, что приводит к развитию карпального туннельного синдрома и/или полинейропатии (например, Val30Met), другие — с накоплением амилоида в кардиомиоцитах, что способствует формированию кардиомиопатии (например, Val122Ile, Thr60Ala,Ile68Leu, Leu111Me) или смешанного фенотипа [1, 4]. В настоящее время не выделяют отдельный фенотип ATTR-нефропатии, несмотря на большое число случаев изолированного или комбинированного поражения почек у пациентов [5, 6].
Клиническая симптоматика ТТР-САП представлена прогрессирующей сенсомоторной полинейропатией (ПНП), вовлекающей преимущественно дистальные отделы верхних и, в большей степени, нижних конечностей [4]. На начальных стадиях заболевания поражаются в основном тонкие волокна периферических нервов, отвечающие за вегетативную, болевую и температурную чувствительность [7]. Тонковолоконная сенсорно-вегетативная ПНП проявляется нейропатическим болевым синдромом, нарушением работы потовых желез, ЖКТ, а также ортостатической гипотензией, эректильной дисфункцией и нейрогенным мочевым пузырем [8–10]. В ряде случаев заболевание дебютирует с клинических признаков карпального туннельного синдрома (КТС). В динамике наблюдается неуклонное прогрессирование неврологической симптоматики, обусловленное тотальным поражением нервных волокон разного калибра и приводящее к формированию тяжелой инвалидизации [2, 4].
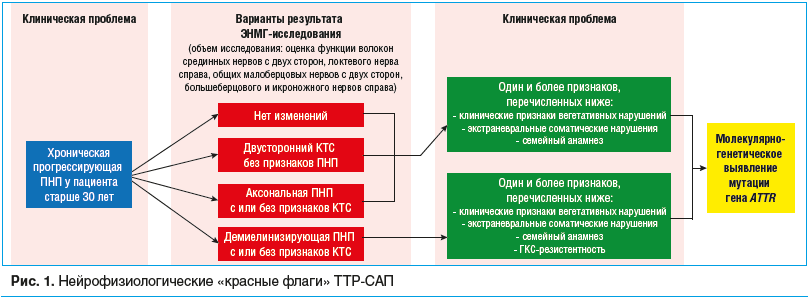
Во всех неэндемичных по ТТР-САП странах наблюдаются большие сложности с первичным выявлением пациентов, особенно на ранних стадиях заболевания, когда патогенетическая терапия является наиболее эффективной. Специалисты не оставляют попыток поиска настораживающих факторов, или «красных флагов», которые обладали бы убедительной специфичностью и позволили бы заметно улучшить диагностику и выявляемость данной категории больных. Система «красных флагов» в эндемичных и неэндемичных регионах имеет свои особенности. В эндемичных регионах ТТР-САП следует заподозрить при сочетании прогрессирующей сенсорной ПНП или вегетативных нарушений с одним и более признаками: наличие отягощенного семейного анамнеза, параклинических признаков нарушения работы сердца и/или почек, а также необъяснимое снижение массы тела более чем на 5 кг. К «красным флагам» в неэндемичных регионах в настоящее время относят: наличие прогрессирующей симметричной сенсомоторной аксональной ПНП неясного генеза или хронической воспалительной демиелинизирующей полирадикулонейропатии (ХВДП), рефрактерной к патогенетической терапии, сочетанных c одним и более признаками, указанными выше, и/или двусторонним КТС [2].
Целью данной статьи является обзор и систематизация публикаций, посвященных современным лабораторным и инструментальным методам обследования пациентов с ТТР-САП, позволяющим предположить данный диагноз. Поиск публикаций проводился в базах данных PubMed Central, Medline, Clinicaltrials.gov c глубиной поиска до 10 лет и анализом более ранних ключевых научных работ, посвященных ТТР-САП. Отбор публикаций осуществлялся по ключевым словам: «транстиретиновая семейная амилоидная полинейропатия», «идиопатическая полинейропатия», «тонкие нервные волокна», «TTR», «карпальный туннельный синдром». Для анализа были выбраны публикации, преимущественно содержащие результаты рандомизированных контролируемых исследований, систематические обзоры, а также менее крупные научные работы с современными методами обследования.
Современные подходы к диагностике и лечению ТТР-САП
Молекулярно-генетическое тестирование
Выявление мутации в гене TTR у пациентов с прогрессирующей ПНП позволяет достоверно подтвердить диагноз ТТР-САП. При этом крупное многоцентровое исследование, проведенное в Нидерландах, с включением 338 пациентов с хронической идиопатической ПНП показало, что скрининговое молекулярно-генетическое исследование нецелесообразно — авторам удалось подтвердить диагноз только в 3% случаев. Выводом данной работы является следующее: проведение молекулярно-генетического исследования показано только при наличии настораживающих признаков («красных флагов») заболевания [11].
В настоящее время молекулярно-генетическое тестирование в РФ можно провести в отдельных неврологических клиниках с использованием метода «сухого пятна» бесплатно пациентам группы риска при наличии «красных флагов» [6]. Следует учитывать, что ген TTR содержится в неполовых хромосомах и для развития ТТР-САП достаточно наличия патогенного варианта в одной копии гена, т. е. его гетерозиготное состояние [12, 13]. В ряде случаев (при наличии убедительной клинической симптоматики и отсутствии мутации в гене TTR) проводится секвенирование по Сэнгеру, позволяющее идентифицировать редкие или ранее неизвестные мутации [14–16].
Наличие мутации в гене TTR при отсутствии клинической симптоматики даже при положительном семейном анамнезе не является основанием для постановки диагноза ТТР-САП [2, 14, 17]. Данная категория пациентов (асимптомные носители мутантного гена) требует наблюдения в динамике, по показаниям им проводится морфологическое и другие исследования (рассмотрено ниже).
Таким образом, молекулярно-генетическое исследование на 100% подтверждает диагноз, может быть рекомендовано при наличии «красных флагов» ТТР-САП, но нецелесообразно в качестве рутинного метода скрининга всем пациентам с ПНП неясного генеза.
Содержание статьи
- 1 Нейрофизиологическое исследование толстых нервных волокон
- 2 Нейрофизиологическое исследование тонких нервных волокон
- 3 Сонографическое исследование периферических нервов
- 4 МРТ-исследование периферических нервов и мышц
- 5 Морфологическое исследование периферических нервов
- 6 Общесоматическое параклиническое обследование
- 7 Лабораторная диагностика
- 8 Заключение
Нейрофизиологическое исследование толстых нервных волокон
Специфических нейрофизиологических изменений при ТТР-САП не существует. ЭНМГ-исследование не позволяет заподозрить или исключить у пациента данное заболевание без совокупного анализа всех данных. Роль ЭНМГ-исследования, прежде всего, заключается в верификации генерализованного неврального уровня поражения, определении типа вовлеченных волокон и характера их поражения.
Нейрофизиологические изменения при ТТР-САП крайне гетерогенны и варьируют в зависимости от фенотипа и стадии болезни. Так, при проведении ЭНМГ-исследования у асимптомных носителей мутации TTR или на ранних этапах болезни в случае изолированного поражения тонких нервных волокон изменения не выявляются: в первом случае в связи с отсутствием патологических изменений на доклинической стадии, во втором — из-за ограниченных возможностей метода [18].
При ЭНМГ-исследовании пациентов с ТТР-САП на развернутой стадии болезни в подавляющем большинстве случаев выявляются признаки генерализованного симметричного поражения аксонов сенсорных и моторных нервных волокон конечностей с локальным нарушением проведения возбуждения по срединным нервам на уровне лучезапястных суставов (ЛЗС) или без такого нарушения. В настоящее время ряд зарубежных исследователей при наличии нейрофизиологических признаков сочетанного генерализованного поражения периферических нервов и КТС рекомендуют подозревать ТТР-САП, рассматривая данное сочетание как «красный флаг» заболевания [19–21].
В работе S. Tozza et al. [21] предложен алгоритм, сочетающий клинические, анамнестические и электрофизиологические параметры, для скрининга ТТР-САП. Он состоит из 7 пунктов с общим количеством баллов от 0 до 12 (см. таблицу).
![гиперТаблица. Комплексный диагностический алгоритм ТТР-САП [21] гиперТаблица. Комплексный диагностический алгоритм ТТР-САП [21]](https://medblog.su/wp-content/uploads/2024/05/Transtiretinovaya-semejnaya-amiloidnaya-polinejropatiya-rol-i-diagnosticheskaya-znachimost-laboratornyh-i.png)
Исследование продемонстрировало, что совокупная оценка по указанному алгоритму с пороговым значением ≥5 баллов позволяет заподозрить ТТР-САП с чувствительностью 96,6% и специфичностью 63,6% [21]. Следует отметить, что электрофизиологическая характеристика данного алгоритма направлена на верификацию лишь аксонального повреждения двигательных и чувствительных нервов и не позволяет подтвердить или исключить сопутствующий полинейропатии КТС. Нам видится, что включение в данный протокол такого параметра, как латентность потенциала действия сенсорных волокон срединного нерва (при соблюдении фиксированного расстояния между активным отводящим электродом и катодом стимулирующего электрода) повысило бы его диагностическую значимость, учитывая, что указанный ЭНМГ-параметр является ключевым в верификации КТС.
Несмотря на то, что у подавляющего большинства больных с ТТР-САП при ЭНМГ-исследовании регистрируются признаки повреждения аксонов периферических нервов, у небольшой части пациентов (особенно при дебюте в позднем возрасте) может выявляться иной характер поражения — демиелинизирующий [22, 23]. В подобных случаях у пациентов с ТТР-САП нейрофизиологические изменения могут быть настолько схожими с электродиагностическими критериями ХВДП, что ошибка при постановке диагноза достигает более 60% [24]. В работе P. Lozeron et al. [23] данные ЭНМГ-исследования пациентов с ТТР-САП сравнили с результатами обследования больных с ХВДП и парапротеинемическими демиелинизирующими полинейропатиями (ПДП). У пациентов с ТТР-САП с демиелинизирующим характером поражения периферических нервов, в отличие от ХВДП и ПДП, не было зарегистрировано блоков проведения, а с течением заболевания снижение амплитуды М-ответов с мышц кистей и стоп было статистически значимо более быстрым и выраженным (p<0,05), что демонстрировало факт преобладания аксонального повреждения над демиелинизирующим. Кроме того, значительно замедлялась скорость проведения по сенсорным волокнам срединных нервов на уровне кисти (р=0,02), что указывало на прогрессирование КТС, характерного для ТТР-САП. Полученные данные согласуются с более ранними исследованиями [25, 26].
Таким образом, несмотря на неспецифичность изменений, выявляемых при ЭНМГ-исследовании, сочетание признаков генерализованного поражения моторных и сенсорных волокон периферических нервов смешанного или аксонального характера с локальным нарушением проведения по срединным нервам на уровне ЛЗС, при наличии соответствующих клинико-анамнестических данных следует заподозрить ТТР-САП (рис. 1).
Нейрофизиологическое исследование тонких нервных волокон
В настоящее время, помимо клинического обследования, для параклинической оценки функции тонких сенсорных и вегетативных волокон в РФ доступны такие методики, как количественное сенсорное тестирование (КСТ), вариабельность сердечного ритма (ВСР), кожный симпатический вызванный потенциал (КСВП) и конфокальная микроскопия роговицы (КМР) [1, 27].
По данным F. Escolano-Lozano et al. [27], при КСТ у пациентов на ранних стадиях ТТР-САП отмечается нарушение восприятия тепла и холода на руках и механическая гипералгезия. Данные вегетативного тестирования (ВСР и КСВП) также демонстрируют изменения на ранних стадиях заболевания. Так, в работе P. Guaraldi et al. [14] особое внимание было уделено оценке ВСР у пациентов с генетически подтвержденным ТТР-САП из неэндемичных регионов. ВСР оценивалась с включением таких методов, как проба Вальсальвы, пассивная ортостатическая проба, гипервентиляция, холодовой тест («тест холодного лица»), стресс-тест, направленный на ритмичное напряжение мышц верхних конечностей (hand grip test). Результаты исследования показали, что вегетативная дисфункция, характеризующаяся либо симпатическими, либо парасимпатическими нарушениями, выявляется соответственно у 37 и 63% пациентов с ТТР-САП. Авторы подчеркивают необходимость использования всей батареи вегетативных тестов, поскольку только совокупный анализ позволяет определить тип или тяжесть вегетативной недостаточности.
У асимптомных носителей мутации в гене TTR наблюдалось значительное изменение вегетативных реакций изолированно при проведении пробы Вальсальвы по сравнению с контрольной группой [14]. Подобные результаты были получены ранее и другими исследователями [13, 15]. Нарушение кардиовагального ответа у пациентов без выраженных клинических симптомов, имеющих мутацию в гене TTR, позволяет предположить, что парасимпатическая нервная система поражается при ТТР-САП раньше симпатической. Данное утверждение согласуется с результатами морфологических исследований, показавших наличие массивных отложений амилоида и дегенеративные изменения в блуждающем нерве по сравнению с другими нервами [17].
Большое количество работ посвящено изменениям, выявляемым у пациентов с ТТР-САП при исследовании судомоторной функции тонких волокон с помощью прибора «Судоскан», показана высокая значимость исследования в дифференциальной диагностике ТТР-САП и ХВДП [28, 29]. Однако данный метод диагностики недоступен в РФ.
Поражение тонких нервных волокон роговицы при ТТР-САП можно диагностировать с помощью КМР [30–32]. Изменение таких количественных показателей КМР, как увеличение коэффициента симметричности направленности волокон и уменьшение коэффициента анизотропии, подтверждает наличие нейропатии [32]. В работе Y. Zhang et al. [31] данные параметры имели отрицательную динамику по мере прогрессирования заболевания. При этом у асимптомных пациентов отмечалось только изменение длины нижнего завитка, в то время как для начальной стадии ТТР-САП были характерны изменения и других параметров КМР. В России данный диагностический метод доступен только в специализированных офтальмологических центрах [32].
К сожалению, изменения, выявляемые с помощью указанных методов исследования, не являются патогномоничными для ТТР-САП и могут выявляться при тонковолоконных полинейропатиях другого генеза.
Таким образом, проведение нейрофизиологической оценки функции тонких нервных волокон у пациентов с подозрением на тонковолоконную сенсорно-вегетативную ПНП позволяет, прежде всего, объективизировать поражение, однако изменения, выявляемые при обследовании, без проведения молекулярно-генетического тестирования не позволяют заподозрить и/или подтвердить диагноз ТТР-САП.
Сонографическое исследование периферических нервов
При УЗ-исследовании у пациентов с ТТР-САП выявляются характерные для КТС изменения: увеличение площади поперечного сечения (ППС) срединного нерва на уровне ЛЗС, а также увеличение толщины удерживателя сухожилий сгибателей пальцев [4, 33]. Однако с учетом высокой распространенности КТС в общей популяции указанные изменения являются чувствительными, но чрезвычайно неспецифичными, что, с одной стороны, может затруднять раннюю диагностику, с другой — привести к гипердиагностике ТТР-САП. В то же время A. Salvalaggio et al. [34] оценили результаты УЗ-исследования срединных нервов на уровне ЛЗС у 62 пациентов с ТТР-САП (34 мужчины, 28 женщин, средний возраст 59,8±12 лет) и продемонстрировали особенности: в отличие от идиопатического КТС, у больных с ТТР-САП отсутствует корреляция между тяжестью КТС (выраженностью симптомов) и величиной ППС срединного нерва на уровне ЛЗС (r=-0,473).
Диффузное увеличение ППС периферических нервов для пациентов с ТТР-САП, как правило, нехарактерно. Тем не менее некоторыми авторами, помимо локального увеличения ППС срединных нервов на уровне ЛЗС, было отмечено увеличение ППС и других невральных структур. Так, в работе A. Salvalaggio et al. [34] ППС плечевого сплетения в надключичной области у асимптомных носителей мутации в гене TTR составила 65,5 мм2, тогда как у пациентов с клиническими проявлениями ТТР-САП — 97,5 мм2 (р<0,001). В исследовании K. Du et al. [12] с включением 18 пациентов с ТТР-САП показаны большие величины ППС блуждающих нервов у больных по сравнению со здоровыми лицами (3,5 и 2,5 мм2 против 2,0 и 1,0 мм2 справа и слева соответственно; p<0,001). Кроме того, средние значения ППС блуждающих нервов положительно коррелировали с течением заболевания (r=0,7203, p=0,0016) и тяжестью вегетативных нарушений по шкале COMPASS 31 (r=0,5252, p=0,0252). В исследовании S. Arvidsson et al. [35] по сравнению с контрольной группой (здоровые лица) у пациентов с ТТР-САП было показано увеличение ППС большеберцового нерва на уровне медиальной лодыжки (p=0,001), икроножного нерва на уровне голени (p<0,001), малоберцового нерва в подколенной ямке (p=0,003) и локтевого нерва на уровне средней трети плеча (p=0,007). Увеличение ППС периферических нервов авторы объясняют отложениями амилоида в эндоневрии, что делает нервные волокна уязвимыми к растяжению на уровне костных структур и за их пределами [35, 36].
Интересной является работа K. Du et al. [37], в которой был проведен сравнительный анализ сонографических изменений у пациентов с ХВДП (n=13), ТТР-САП (n=18) и здоровых лиц группы контроля (n=14). У больных обеих рассматриваемых групп по сравнению с контрольной группой ППС периферических нервов конечностей оказалась увеличенной, отмечалось большее увеличение ППС нервов в проксимальных отделах конечностей. При этом величина ППС нервов у больных с ХВДП оказалась статистически значимо больше, чем при ТТР-САП (p<0,01). Кроме того, вариабельность ППС срединных нервов (ППС максимальная / ППС минимальная) была значительно выше при ХВДП, чем при TTР-САП (чувствительность 69%, специфичность 83%). Соответственно, у пациентов с ТТР-САП авторы продемонстрировали мягкое увеличение ППС периферических нервов с меньшей вариабельностью ППС срединных нервов, чем у пациентов с ХВДП, что может помочь при проведении дифференциальной диагностики.
Следует отметить, что увеличение ППС периферических нервов нехарактерно для большинства хронических аксональных ПНП, соответственно, наличие диссоциации, когда при аксональной ПНП при УЗ-исследовании выявляется нерезкое утолщение периферических нервов в проксимальных отделах с сопутствующим локальным увеличением ППС срединных нервов на уровне ЛЗС или без него, должно насторожить — возможна ТТР-САП [38]. Кроме того, если при прогрессирующей хронической демиелинизирующей ПНП при УЗ-исследовании отсутствуют характерные для ХВДП сонографические изменения (диффузное, более выраженное в проксимальных отделах значительное увеличение ППС нервов), также следует предположить ТТР-САП, особенно при наличии клинико-анамнестических «красных флагов» заболевания.
Таким образом, при ТТР-САП наблюдаются разнонаправленные сонографические изменения, которые в ряде случаев могут запутать клинициста. В этой связи мы рекомендуем ориентироваться на наличие УЗ-признаков двустороннего КТС с диффузными сонографическими изменениями или без них, при обязательном сопоставлении результата исследования с клинико-анамнестическими и нейрофизиологическими данными.
МРТ-исследование периферических нервов и мышц
МРТ-исследование периферических нервов при ТТР-САП начало развиваться относительно недавно. Первые работы появились в начале 2010-х годов и демонстрировали локальную гиперинтенсивность МР-сигнала от проксимальных отделов периферических нервов верхних и нижних конечностей [26, 39]. Так, J. Hodel et al. [39] показали, что у пациентов с ТТР-САП отмечается повышение интраневрального МР-сигнала от корешков, спинальных нервов и стволов пояснично-крестцовых сплетений на Т2-взвешенных изображениях с подавлением жира (STIR) и увеличение их диаметра. В этой связи особую сложность представляет интерпретация данных МРТ сплетений при проведении дифференциальной диагностики между ХВДП и ТТР-САП с демиелинизирующим характером поражения нервов, так как в обоих случаях могут выявляться однонаправленные нейровизуализационные изменения [40, 41].
Недавно опубликована работа C. Durelle et al. [42], в которой изучалась значимость МРТ мышц нижних конечностей у пациентов с ТТР-САП. Авторы показали, что для пациентов с ТТР-САП характерно жировое замещение мышц нижних конечностей с преимущественным вовлечением латеральной и задней групп мышц голеней. Кроме того, продемонстрировано, что появление жирового замещения латеральной головки икроножной мышцы может указывать на переход из досимптомной стадии заболевания в симптомную.
Таким образом, при МРТ периферических нервов у пациентов с ТТР-САП, как и при УЗ-исследовании, могут наблюдаться разнонаправленные неспецифические изменения, не позволяющие, например, четко дифференцировать ХВДП и ТТР-САП.
Морфологическое исследование периферических нервов
Для морфологического исследования при подозрении на ТТР-САП выбирают пораженный орган [43, 44]. При морфологическом исследовании необходимо окрашивание препаратов ткани красителем конго красный с последующей микроскопией в поляризованном свете. Диагноз подтверждается при выявлении конгофильных масс, обладающих способностью к яблочно-зеленому или желтоватому свечению в поляризованном свете. Для более точной диагностики амилоидоза применяют также метод окраски тиофлавином Т, который дает светло-зеленое свечение амилоида.
Биопсия нерва обладает высокой специфичностью и чувствительностью при ТТР-САП (79 и 88% соответственно), однако неравномерное распределение амилоидных отложений может ограничивать диагностическую ценность метода, потенциально требуя повторных биопсий нерва или других органов [45, 46]. Учитывая, что морфологическое исследование является инвазивной, технически сложной процедурой, данный метод в настоящий момент сохраняет свою ценность лишь в сложных клинических случаях и постепенно замещается другими, неинвазивными и доступными методами обследования, о которых идет речь в настоящей статье [32, 33, 39].
Общесоматическое параклиническое обследование
Общесоматическое параклиническое обследование важно при подозрении на ТТР-САП, учитывая, что рассматриваемое заболевание является системным [6]. Органами, которые требуют обследования, являются сердце, почки, ЖКТ и глаза (рис. 2).
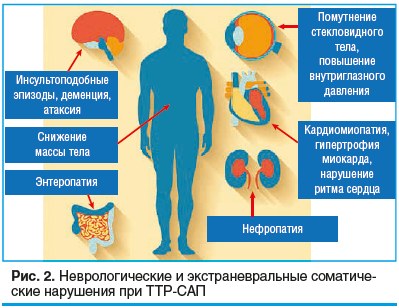
На ЭКГ для кардиомиопатии, ассоциированной с мутацией в гене TTR, характерны широкий комплекс QRS; несоответствие между вольтажом (низкий) и массой миокарда (гипертрофия); псевдоинфарктные изменения [2, 47]. При проведении ЭхоКГ характерными чертами амилоидной кардиомиопатии являются выраженная необъяснимая гипертрофия левого желудочка >12 мм (при отсутствии анамнеза гипертонической болезни, гипертрофической кардиомиопатии и других состояний); умеренный выпот в перикарде; бивентрикулярная гипертрофия и утолщение клапанов сердца; феномен «apicalsparing» (сохранение продольной деформации в области верхушки с одновременным значимым уменьшением данного показателя в базальных отделах); дилатация левого предсердия; низкий градиент при low-flow аортальном стенозе [48, 49]. Высокоинформативным методом верификации амилоидной кардиомиопатии является сцинтиграфия миокарда с мечеными 99mTс фосфатными комплексами, которая с чувствительностью 91% и специфичностью 92% (площадь под кривой 0,960) позволяет верифицировать амилоидоз сердца при ТТР-САП. Данный метод по своей значимости соответствует эндомиокардиальной биопсии и в современной практике заменяет ее [2, 50].
При полном офтальмологическом обследовании (измерение внутриглазного давления (ВГД), исследование передней камеры и глазного дна, биомикроскопия с осмотром зрачка) при ТТР-САП может выявляться помутнение стекловидного тела, повышение ВГД с последующим снижением остроты зрения вследствие отложения амилоида [2, 51]. В случае поражения почек акцент делается на таких лабораторных показателях, как скорость клубочковой фильтрации (СКФ) и наличие протеинурии, позволяющих оценить степень почечной недостаточности. Такие методы, как сцинтиграфия или УЗИ, применение которых рекомендовано при обследовании сердца, практически не используются для оценки почечной функции [2, 6, 52]. В настоящий момент не существует специфических изменений, выявляемых при стандартных обследованиях ЖКТ (колоноскопия, эзофагогастродуоденоскопия (ЭФГДС), рентген брюшной полости, компьютерная томография), позволяющих предположить энтеропатию, обусловленную ТТР-амилоидозом. При проведении ЭФГДС возможен забор биоптата для последующего морфологического исследования, для чего биоптат должен содержать мышечный слой слизистой оболочки и подслизистую оболочку [5, 53].
Лабораторная диагностика
Специфических для ТТР-САП лабораторных маркеров не существует. Тем не менее показано, что у пациентов с ТТР-САП могут отмечаться увеличение уровня креатинина в сыворотке крови (20–40%), протеинурия (30–50%) или микроальбуминурия (40–60%), а также повышение уровня тропонина и мозгового натрийуретического гормона (40–60%), снижение СКФ, свидетельствующие в пользу сопутствующих ПНП экстраневральных нарушений — соответственно нефропатии и кардиомиопатии [9, 10].
Таким образом, анализ результатов общесоматического обследования имеет большое значение при обследовании пациента с целью диагностики причины имеющейся у него полинейропатии. Поскольку транстиретиновый амилоидоз является заболеванием, поражающим не только периферическую нервную систему, но и внутренние органы, выявление признаков нарушения их функции, даже не самых грубых, позволяет врачу заподозрить ТТР-САП и провести прицельный диагностический поиск.
Современные подходы к лечению
Таким образом, ТТР-САП — редкое прогрессирующее системное заболевание с преимущественным поражением периферической нервной системы, для которого в настоящее время разработано патогенетическое лечение. В РФ уже несколько лет активно используется препарат тафамидис (торговое наименование Виндакель), эффективность которого продемонстрирована в крупных сравнительных исследованиях [54, 55]. Тафамидис является селективным стабилизатором транстиретина; связываясь с двумя тироксинсвязывающими участками транстиретина в нативной (тетрамерной) форме, он предотвращает диссоциацию комплекса на мономеры и замедляет амилоидогенез. В этой связи вопрос ранней диагностики данного заболевания стоит достаточно остро. В ходе лабораторного, нейрофизиологического и нейровизуализационного обследований удается выявить лишь неспецифические изменения, которые необходимо интерпретировать строго с учетом клинико-анамнестических данных.
Заключение
Наибольшую сложность представляет проведение дифференциальной диагностики между ХВДП и ТТР-САП, при которых в ряде случаев регистрируются однонаправленные нейрофизиологические и нейровизуализационные изменения. В подобных ситуациях следует учитывать наличие сопутствующих полинейропатии клинико-параклинических признаков поражения тонких нервных волокон, КТС и соматических нарушений, что будет указывать на ТТР-САП. Таким образом, высокоспецифичного лабораторного или инструментального маркера ТТР-САП, позволяющего заподозрить этот диагноз, не существует. В настоящее время только проведение молекулярно-генетического тестирования у пациентов с «красными флагами» заболевания позволяет достоверно верифицировать диагноз.
Информация с rmj.ru
