Введение
Спирамицин, 16-членный кольцевой макролидный антимикробный препарат, впервые был выделен из Streptomyces ambofaciens в 1954 г. [1]. Он состоит из трех компонентов: спирамицина I (~63%), спирамицина II (~24%) и спирамицина III (~13%), содержащих различные заместители С3-гидроксильной группы [1]. Спирамицин демонстрирует высокую эффективность в борьбе с несколькими микроорганизмами, включая грамположительные бактерии, Chlamydia и Mycoplasma, а также некоторые грамотрицательные агенты, ответственные за инфекции дыхательных путей.
Интерес к макролидам, в частности спирамицину, который в течение длительного времени применялся для лечения инфекций нижних дыхательных путей, обусловлен не только антибактериальным эффектом, но и обоснованием нового применения данного антимикробного препарата с противовоспалительной целью. В контексте антибиотиков это особенно ценно, учитывая высокую стоимость и длительность разработок и внедрения в клиническую практику новых антибактериальных препаратов [2–4]. Кроме того, «перепрофилирование» препарата помогает в борьбе с глобальной чрезвычайной ситуацией, вызванной быстрым распространением бактерий с множественной лекарственной устойчивостью, несмотря на уменьшение количества одобренных антибиотиков [5]. Имеющиеся примеры изменения показаний к использованию антибиотиков касаются в том числе некоторых макролидов, активность которых в качестве противовирулентных препаратов была продемонстрирована в отношении устойчивых к другим макролидам бактерий, в частности Pseudomonas aeruginosa. Это позволило предположить, что макролиды могут действовать при псевдомонадных инфекциях, подавляя либо воспалительную реакцию, либо вирулентность P. aeruginosa [6]. Немаловажной причиной для проведения дополнительных исследований явился полный уход с международного рынка представителя макролидов джозамицина (Вильпрафен, Вильпрафен солютаб, Astellas, Япония). Однако в Российской Федерации зарегистрированы два препарата, также относящихся к 16-членным макролидам и представляющих собой почти полные аналоги джозамицина, которые имеют те же показания к применению, — мидекамицин и спирамицин. И по мнению члена-корреспондента РАН, главного специалиста Минздрава России по клинической микробиологии и антимикробной резистентности Р. Козлова, «прекращение производства в стране антибиотика джозамицина не несет рисков для пациентов», так как «всегда есть антибиотики, которые можно назначить даже в том случае, если инфекция вызвана устойчивыми к ним бактериями».
Принимая во внимание широкий спектр антимикробной активности спирамицина при достаточной легочной пенетрации, мы провели исследование с целью оценить клиническую эффективность спирамицина при бронхолегочных инфекциях.
Содержание статьи
Материал и методы
Проведено проспективное нерандомизированное исследование с участием 50 пациентов с инфекциями нижних дыхательных путей, из них 20 (40%) — с пневмонией, 10 (20%) — с ХОБЛ в стадии обострения, 9 (18%) — с хроническим бронхитом в стадии обострения, 11 (22%) — с острым бронхитом.
Критерии включения в исследование: возраст пациентов старше 18 лет, отсутствие антибактериальной терапии на предыдущем этапе лечения. Критерии невключения: период грудного вскармливания; применение β-лактамных антибиотиков или респираторных хинолонов на предыдущем этапе терапии. Возраст пациентов составил от 28 до 59 лет (в среднем 53,5±6,7 года). В ходе исследования 33 (66%) пациента находились на лечении в стационаре БУЗОО «ОКБ», из них 20 (60,6%) — с пневмонией, 10 (30,3%) — с ХОБЛ в стадии обострения, 3 (9,1%) — с острым бронхитом бактериальной этиологии. Остальные 17 (34%) пациентов лечились амбулаторно. Исследуемой группе больных были выполнены лабораторные (общий анализ крови, исследование С-реактивного белка (СРБ), стандартный биохимический анализ крови), бактериологические (при пневмонии — микробиологическое исследование мокроты или бронхоальвеолярной лаважной жидкости) и иммунологические (полимеразная цепная реакция (ПЦР) на вирусы гриппа А/В и SARS-CoV-2) тесты; при подозрении на пневмонию проводилась мультиспиральная компьютерная томография (МСКТ) органов грудной клетки. У 5 пациентов с пневмонией получены положительные результаты бактериологического исследования мокроты, были выделены: Streptococcus viridans — 3 случая, Streptococcus pyogenes — 1, Streptococcus pneumoniae — 1 случай.
Все пациенты получали спирамицин (Дорамитцин ВМ) в дозе 3 млн МЕ 3 р/сут перорально в течение 10 сут. В схему лечения также были включены бронходилататоры короткого действия, вводимые посредством небулайзера, и мукоактивные средства, а также НПВП при температуре тела выше 38 °С.
В ходе исследования эффективности спирамицина оценивали динамику нормализации температуры тела, уменьшения кашля и одышки, а также рентгенологических признаков пневмонии. В соответствии со сроками применения антибиотиков уменьшение (исчезновение) основных симптомов инфекций нижних дыхательных путей оценивалось спустя 10 сут от начала терапии.
Статистическую обработку полученных данных выполняли с использованием программного обеспечения IBM SPSS Statistics 23.0.0.0. Статистически значимой для всех видов анализа считали величину р ≤0,05.
Результаты исследования
Характеристика основных проявлений инфекции нижних дыхательных путей и их динамика у обследованных 50 пациентов представлены в таблице 1.
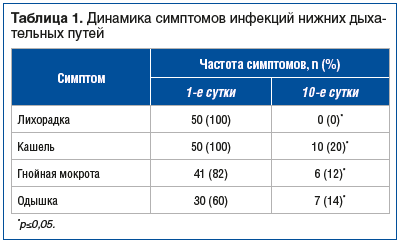
Как видно из таблицы 1, к 10-м суткам терапии, независимо от нозологии, у всех пациентов нормализовалась температура тела, у большинства пациентов уменьшились кашель и одышка (частично сохранялись только у пациентов с ХОБЛ), у значительной части пациентов не стало гнойной мокроты.
Анализ клинико-лабораторных и рентгенологических критериев антимикробной эффективности спирамицина проводили у 33 пациентов, находившихся на лечении в стационаре, из них у 20 больных динамика инфильтративно-очаговых изменений в легких оценивалась на основании данных МСКТ.
При анализе объективных показателей (по данным аускультации легких до лечения хрипы были выявлены у 41 больного) (табл. 2) достоверно установлено исчезновение влажных хрипов в легких у большинства пациентов с пневмонией, уменьшение интенсивности сухих хрипов у больных с хроническими заболеваниями легких (ХОБЛ, хронический бронхит) и полное исчезновение аускультативных признаков бронхоспазма у пациентов с острым бронхитом.
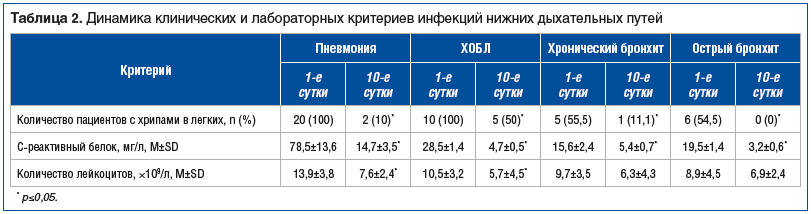
Уровень СРБ — острофазового показателя системного воспаления — достоверно снизился у пациентов с пневмонией и полностью нормализовался у пациентов без пневмонии. Подобная закономерность проявилась и в динамике уровня лейкоцитов (см. табл. 2).
По данным МСКТ, положительная рентгенологическая динамика (уменьшение/редукция инфильтративно-очаговых изменений в легких) достигнута практически у всех пациентов с пневмонией — 19 (95%). У одного пациента потребовалось дальнейшее обследование для исключения специфического процесса в легких.
Необходимо отметить, что ни у одного из пациентов не зарегистрировано нежелательных явлений (в том числе и свойственных группе макролидов диспепсических), которые могли бы потребовать отмены спирамицина.
Для демонстрации антимикробной эффективности препарата спирамицина приводим клиническое наблюдение.
Клиническое наблюдение
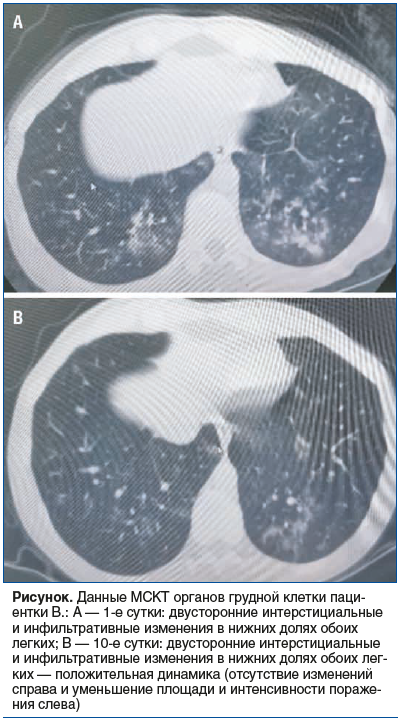
Пациентка В., 1986 года рождения, госпитализирована в отделение пульмонологии БУЗОО «ОКБ» в декабре 2023 г. с жалобами на повышение температуры тела до 38 °С, кашель со слизисто-гнойной мокротой, хрипы в грудной клетке, общую слабость. Продолжительность заболевания до госпитализации составила 6 дней. Проводимая терапия включала только противовирусный препарат. По данным МСКТ, в нижних долях обоих легких выявлены многочисленные зоны инфильтрации легочной паренхимы сливного характера с мелкими участками консолидации (см. рисунок, А). ПЦР-тесты на SARS-CoV-2 и вирусы гриппа А и В отрицательные. В общем анализе крови: лейкоцитоз до 12,8×109/л, палочкоядерный сдвиг до 9%. Уровень СРБ составил 113 мг/л. Бактериологическое исследование (посев мокроты) выявило положительный рост S. pyogenes (106 КОЕ/мл). Первоначальный план терапии включал цефалоспорин III поколения для внутривенного введения (цефтриаксон) и макролид (спирамицин) в таблетированной форме, однако у пациентки в анамнезе имел место ангионевротический отек на введение цефтриаксона. С учетом молодого возраста больной и отсутствия сопутствующих заболеваний было решено проводить монотерапию антибактериальным препаратом спирамицина (Дорамитцин ВМ) в дозе 3 млн МЕ 3 р/сут перорально в течение 10 сут.
На фоне терапии спустя 2 сут полностью нормализовалась температура тела, к 10-м суткам констатировали отсутствие кашля и одышки. В лабораторных тестах получены позитивные изменения к 10-м суткам лечения: уровень СРБ составил 0,43 мг/л, количество лейкоцитов 5,3×109/л, лейкоцитарная формула в норме. Рентгенологический контроль через 10 сут показал положительную динамику — частично разрешились участки инфильтрации в нижних долях обоих легких, уменьшилась их интенсивность (см. рисунок, B). Пациентка выписана из стационара на 10-е сутки.
Обсуждение
«Ренессанс» спирамицина в пульмонологической практике связан с уникальными свойствами данного антибактериального препарата: высокие и длительно сохраняющиеся тканевые и внутриклеточные концентрации (в том числе в легочной ткани); противовоспалительный эффект (снижение уровней оксида азота, интерлейкинов 1 и 6); постантибиотический (более выражен, чем у 14-членных макролидов и азитромицина) и проантибиотический (подавление бактерий в субингибирующих концентрациях, что снижает функциональную активность микроорганизма и его вирулентность) эффекты [7]. Исходя из нашего опыта, а также основываясь на ранее полученных знаниях о группе макролидных антибиотиков, включая спирамицин [7], нами выделены показания к назначению спирамицина: пневмония (нетяжелое течение, молодой возраст, без сопутствующих заболеваний (возможна монотерапия) или, при наличии факторов риска лекарственной устойчивости возбудителей, в комбинации с β-лактамным антибиотиком); ХОБЛ 1–2-й степени тяжести, без частых обострений и применения системных кортикостероидов и антибиотиков в течение предшествующих 3 мес.; острый бактериальный бронхит; обострение хронического бронхита. Считаем также важным отметить, что в одном из последних руководств по инфекциям нижних дыхательных путей у госпитализированных пациентов эксперты Европейского респираторного общества рекомендуют добавление именно макролидов, а не фторхинолонов к β-лактамным антибиотикам для эмпирической терапии тяжелой внебольничной пневмонии [8].
Заключение
Таким образом, на основании собственного опыта мы можем утверждать, что при инфекциях нижних дыхательных путей использование спирамицина в комбинированной терапии и монотерапии обосновано с точки зрения клинической эффективности и безопасности, минимального риска диспепсических явлений и является адекватной альтернативой респираторным хинолонам.
Информация с rmj.ru
