Содержание статьи
Введение
Данные эпидемиологических исследований свидетельствуют о том, что остеоартритом (ОА) страдают более 300 млн человек во всем мире [1]. Ожидается существенное увеличение распространенности ОА в развитых странах с высоким уровнем старения населения к 2050 г. [2]. В исследовании [3] утверждается, что заболеваемость OA намного выше и оценивается примерно в 7% населения всего мира, что составляет более 500 млн человек.
Деградация и потеря суставного хряща (СХ) является главным отличительным признаком ОА, который лежит в основе сильной боли, потери функции сустава и снижения качества жизни пациента [4, 5].
Диагностика ОА различной локализации, стадии и функциональной недостаточности в реальной клинической практике предполагает применение клинико-анамнестических данных пациентов, функциональных, рентгенологических данных и результатов оценки артроскопических шкал [6]. Однако ОА — это гетерогенное заболевание, характеризующееся поражением одного или нескольких суставов, разнообразием клинических признаков, а также большой палитрой биохимических и молекулярных характеристик [7], что в совокупности предполагает существование множества фенотипов и эндотипов ОА. Сегодня ОА рассматривают как часть мультисистемного активного патологического процесса в организме человека, запускаемого группой системных (генетических, транскриптомных, метаболомных, протеомных, нейроиммуноэндокринных) и местных (биомеханических) факторов.
Поэтому необходимо сформулировать обновленное определение ОА, включающее эндотипы и фенотипы заболевания, которые предполагают всеобъемлющую клеточную таксономию болезни, выходящую за пределы биологии хондроцитов. Фенотипы ОА можно определить как подтипы ОА, в основе которых лежат патобиологические и болевые механизмы, а также их структурные и функциональные последствия. Молекулярные эндотипы ОА — это подтипы заболевания, которые определяются различными молекулярными механизмами и сигнальными путями развития.
В настоящее время для выявления пациентов с быстрым прогрессированием ОА применяют стратегию стратификации с выявлением клинико-патобиологических кластеров, описывающих молекулярные эндотипы, с помощью которых выполняют разработку биотаргетных лекарственных средств. Разные клинические фенотипы ОА могут состоять из перекрывающихся молекулярных эндотипов, которые идентифицируют по наличию специфических клеток или молекул биомаркеров в крови либо синовиальной жидкости. Выявление фенотипов и эндотипов ОА дает возможность разработать целенаправленное лечение для определенных подгрупп пациентов с применением нестероидных противовоспалительных препаратов (НПВП), хондропротекторов, биотаргетных и иммунобиологических препаратов [8].
Сегодня разрабатываются новые инструменты прогнозирования течения и фенотипирования ОА — шкалы для выявления пациентов с высоким риском формирования и прогрессирования ОА, создающиеся на основе применения мультидисциплинарных алгоритмов и базы данных открытого доступа для интеграции этой информации [9].
К.В. Корочина и соавт. [10] предложили следующие группы фенотипов ОА коленного сустава: этиопатогенетические, клинико-патогенетические, клинико-структурные, связанные с коморбидностью, психогенные болевые.
Наиболее интересной представляется следующая классификация фенотипов ОА и связанных с ними эндотипов:
фенотип, обусловленный травмой (эндотип с высоким распадом аггрекана);
метаболический фенотип (эндотип с высоким уровнем ацилкарнитинов и низким уровнем карнитина, эндотип с низким уровнем ацилкарнитинов и высоким уровнем карнитина);
фенотип, обусловленный клеточной активностью в хряще (эндотип с низким уровнем формирования СХ (PIIANP, PIIBNP); эндотип, включающий профиль с пролиферацией хондроцитов, прегипертрофическими хондроцитами, хондроцитами волокнистого хряща, эффекторными хондроцитами, регуляторными хондроцитами, гомеостатическими хондроцитами);
воспалительный фенотип (эндотип с высоким уровнем системного воспаления (CRPM, TNF-α, IL-6, IL-17 и др.); эндотип с высоким уровнем локального воспаления (C1M, С3М, гиалуронан, эндостатин и др.), эндотип с активацией макрофагов и нейтрофилов (VEGF, MMP-3, TIMP-1, sICAM-1, sVCAM-1, MCP-1));
фенотип, обусловленный процессами в субхондральной кости (эндотип с высокой костной резорбцией (альфа CTX-1));
фенотип, обусловленный старением (эндотип с высоким уровнем гликированных, окисленных и нитрированных аминокислот (глюкозепан, дитирозин)) [11].
Стратификация декомпенсированной формы ОА на основе фено- и эндотипирования представляется крайне важной при планировании эндопротезирования крупных суставов, так как в ходе него крайне редко применяются прогностические инструментальные и лабораторные маркеры, позволяющие формировать подгруппы больных с ожидаемыми субоптимальными результатами эндопротезирования суставов, способствующие разработке и внедрению эффективных и безопасных способов профилактики осложнений эндопротезирования и вспомогательной терапии на этапах реабилитации после операции [12].
Известны функциональные группы биомаркеров, характеризующих эндотипы ОА, необходимые для прогноза осложнений и характера течения этапа реабилитации после тотального эндопротезирования, оценки эффективности и безопасности новых режимов периоперационной терапии, которые применяются для предупреждения остеолиза с асептической нестабильностью, появления рефрактерной послеоперационной боли, воспаления: биомаркеры костного метаболизма, метаболизма в хрящевой ткани и коллагена II типа, синовиального и системного воспаления, системных эндокринных нарушений и связанных метаболических изменений в суставных тканях, старения и механического повреждения [13–15].
Сегодня крайне актуальными являются разработка, внедрение и оценка с позиций доказательной медицины эффективности и безопасности активных соединений, ключевым механизмом действия которых при ОА разной локализации выступает блокада структурных изменений в суставах с улучшением биологических, структурно-механических свойств и функций тканей сустава, лежащих в основе феноэндотипирования ОА. Данную группу активных соединений относят к категории средств, применяемых при ОА и модифицирующих заболевание (disease modifying anti-osteoarthritis drugs, DMOADs), которые также нередко называют хондропротекторами [16].
В качестве «золотого стандарта», предложенного регулирующими органами для квалификации агента как формирующего DMOAD-положительный эффект при ОА, рассматривается влияние активного соединения на рентгенологическое сужение суставной щели на стандартных сериях рентгенограмм. Однако данное требование не соответствует современным знаниям о существующих фенотипах и эндотипах ОА.
Новые фармакологические (болезньмодифицирующие препараты (DMOADs)) [17–19] и биологические вмешательства, тестируемые в настоящее время, требуют новых подходов к стандартизации, новых определений и классификаций, проведения клинических и обсервационных исследований, результаты которых могут быть одобрены регулирующими органами.
Считаем, что к препаратам DMOADs нового поколения можно отнести активные соединения, применяемые для профилактики и вспомогательной терапии ОА разной локализации, соответствующие следующим требованиям: параметрам фармацевтической стандартизации, имеющие улучшенные фармакокинетические параметры (раннее начало действия и высокий показатель биодоступности), экспериментальные и клинические доказательства болезньмодифицирующего эффекта с учетом параметров фенотипирования и эндотипирования ОА, высокий уровень безопасности, оптимальный коэффициент затраты/эффективность.
В выполненном ранее исследовании [12] мы показали, что применение парентеральной формы хондроитина сульфата (ХС) (препарат Хондрогард®) в установленном эффективном и безопасном режиме за 2 мес. до проведения ТЭКС целесообразно с целью улучшения ближайших и отдаленных функциональных результатов оперативного вмешательства, прежде всего в отношении контралатерального сустава, на основании доказанных признаков адаптивной перестройки во всех слоях гиалинового хряща и уменьшения выраженности воспаления в синовиальной оболочке, сопровождавшихся закономерной динамикой биомаркеров прогрессирования ОА в крови.
Цель исследования: ретроспективный анализ динамики структурно-функциональных особенностей суставных тканей и биомаркеров в сыворотке крови пациентов с ОА КС III стадии по Kellgren — Lawrence (K–L) и функциональной недостаточностью суставов 2-й степени с учетом выделенных фенотипов и эндотипов ОА КС на фоне приема высокоочищенного ХС в парентеральной форме (Хондрогард®).
Материал и методы
Проведен ретроспективный анализ результатов выполненного ранее этапа — открытого проспективного контролируемого рандомизированного исследования, в ходе которого операция ТЭКС была выполнена 67 пациентам. В зависимости от получаемой до операции терапии было сформировано 2 группы: контрольная группа (КГ, n=35), в которой пациенты получали только НПВП (целекоксиб, диклофенак, мелоксикам) в стандартной суточной дозе, и основная группа (ОГ, n=32), в которой пациенты в дополнение к НПВП получали курс парентеральной формы ХС (Хондрогард®) за 2 мес. до проведения ТЭКС [12].
С учетом анализа представленных в научной медицинской литературе классификаций фенотипов ОА [11] в ретроспективном исследовании выделили пациентов с тремя фенотипами заболевания: воспалительным, обусловленным синовитом (КГ: n=13; ОГ: n=11); связанным с травмой (наличие предшествующей травмы сустава) (КГ: n=10; ОГ: n=10), эндокринным (индекс массы тела более 30 кг/м2, наличие метаболического синдрома, сахарного диабета 2 типа) (КГ: n=12; ОГ: n=11). C целью формирования однородных подгрупп пациентов с ОА, относящихся к определенному фенотипу, на этапе отбора пациентов для открытого проспективного клинического исследования исключали пациентов с профессиональными факторами риска ОА и регулярными занятиями спортом в анам-незе.
Средний возраст пациентов с различными фенотипами ОА КС в декомпенсированной форме составил 58±12 лет. Средняя клиническая длительность ОА КС 10±3 года, заболевание дебютировало в возрасте 52±5 лет.
Проведен анализ содержания следующих лабораторных показателей крови, полученных в рамках открытого проспективного контролируемого рандомизированного исследования методом иммуноферментного анализа на визитах 0, 1 и 2 в подгруппах выделенных фенотипов: гиалуроновой кислоты (ГК), ультрачувствительного С-реактивного белка (СРБ), ФНО-α, ИЛ-6, лептина, адипсина, N-концевого пропептида коллагена IIα (PIIANP), C-концевого телопептида коллагена I типа (CTX-1), остеокальцина, матриксных металлопротеиназ (ММП) 3 и 13, олигомерного матричного белка хряща (COMP), склеростина, 25-гидроксивитамина D (25(ОН)D3) в сыворотке и плазме крови [12].
Выполнена гистологическая оценка биообразцов СХ, полученных в ходе операции ТЭКС, с описанием морфологических фенотипов и их динамики при приеме ХС в подгруппах выделенных фенотипов. Методы гистологического исследования биообразцов СХ описаны в [12, 20].
Для определения тяжести ОА использовали Шкалу полуколичественной гистохимической оценки состояния хряща по H. Mankin (1971) в модификации V.B. Kraus et al. [21, 22], учитывающей структуру поверхности хряща (0–8 баллов), содержание протеогликанов в окраске толуилдиновым синим (0–6), плотность расположения хондроцитов и кластеризацию (0–3), целостность остеохондральной линии (0–1) и наличие остеофитов, а также Шкалу оценки гистопатологии хряща OARSI (2006) [23].
Статистическую обработку данных проводили в среде пакета статистических программ для биомедицинских исследований Statistica 10.0 (StatSoft, Inc., CША), XLSTAT version 2019.3.2 (Addinsoft, США). Формирование подгрупп пациентов проводили на основе текущего файла данных пациентов с применением стратифицирующих переменных и выделением клинического фенотипа [12]. Оценку нормальности распределения количественных данных морфологического и лабораторного тестирования проводили с применением теста Колмогорова — Смирнова. Данные представлены как медиана и квартили Mе (Q1; Q3), среднее и стандартное отклонение (M±SD). Межгрупповые различия оценивали с помощью U-теста Манна — Уитни. Критерием статистически значимых различий результатов считали величину р<0,05.
Результаты исследования
Ранее нами было показано [12], что у пациентов КГ гистоархитектоника гиалинового хряща бедренной и большеберцовой костей, полученного в момент выполнения ТЭКС, характеризовалась значительными участками деструкции, преимущественно в поверхностной и глубокой зонах, деформированными остеонами в промежуточной зоне, участками с дистрофическими изменениями в виде запустевших лакун на границе с костью в глубокой зоне хряща, участками гомогенного и равномерно окрашенного основного вещества, и участками с частично нарушенными тинкториальными свойствами в межклеточном матриксе, значительным количеством капиллярных петель, проникающих в хрящевую ткань со стороны субхондральной кости.
Подробный гистологический анализ СХ пациентов КГ с различными клинико-патогенетическими фенотипами выявил характерные различия в гистоархитектонике СХ.
При посттравматическом фенотипе ОА КС отмечены существенные изменения зонального строения СХ со значительным уменьшением его общей толщины, с глубокими трещинами по краю хряща с проникновением в промежуточную зону, определялись мелкие, расположенные неравномерно и кластерами хондроциты во всех зонах СХ с единичными хондроцитами в фазе гибели, негомогенный экстрацеллюлярный матрикс (ЭЦМ) с очаговым или распространенным разволокнением, отсутствие базофильной линии, формирование сосудистых каналов с проникновением в СХ, наличие у части пациентов синовиального паннуса на поверхности хряща (рис. 1). Оценка выраженности синовита по шкале GSS составила 4,4±0,6 балла и соответствовала среднеуровневому синовиту 2-й степени.
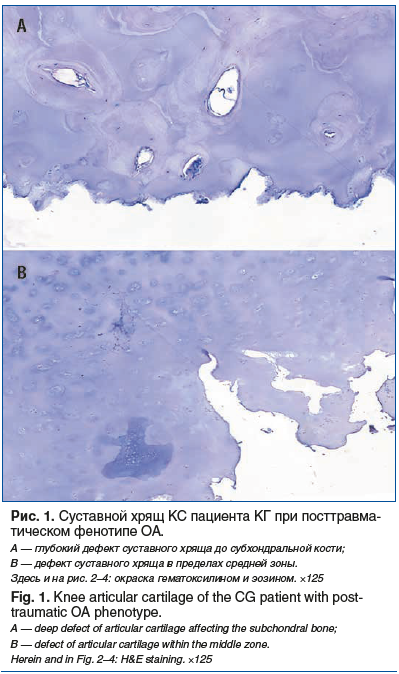
У пациентов КГ с эндокринным фенотипом ОА КС отмечено менее выраженное, в сравнении с посттравматическим фенотипом ОА, нарушение зонального строения СХ, выявлены поверхностные хондроциты, представлена структура промежуточной и глубокой зон СХ, кальцификация хряща, неровная суставная поверхность с неглубокими трещинами, в составе изогенных групп регистрировали по 2–5 хондроцитов, отделенных друг от друга ЭЦМ с умеренно выраженным разволокнением, интенсивная васкуляризация хрящевой ткани, образование новой костной ткани вокруг сосудистых каналов и разрушение хряща в области субхондральной кости, базофильная линия либо отсутствовала, либо имела неровные контуры с нарушением целостности, проникновение изогенных групп хондроцитов и сосудов из субхондральной кости (рис. 2). Оценка выраженности синовита по шкале GSS составила 4,4±0,5 балла и соответствовала низкоуровневому синовиту 2-й степени.

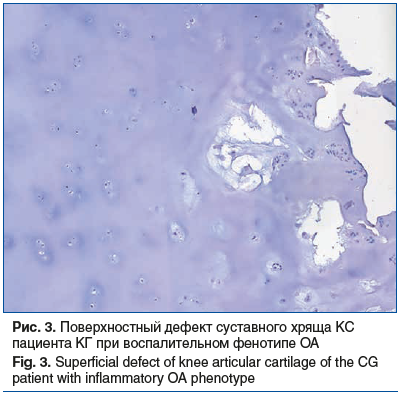
У пациентов КГ с воспалительным фенотипом ОА КС выявлены: нарушение зональности СХ при наличии его поверхностной зоны, комбинация от незначительных по краю хряща до глубоких трещин с распространением в кальцифицированный хрящ, кластеры (15–30 клеток) гипертрофированных клеток в глубокой зоне СХ с большими участками ЭЦМ, редкие группы хондроцитов (6–7 клеток), расположенные равномерно по всему хрящу, потеря структуры и разволокнение ЭЦМ, замещение гиалинового хряща волокнистым, прерывистая базофильная линия, интенсивное прорастание сосудистых каналов из субхондральной кости в хрящ с его разрушением и оссификацией (рис. 3). При анализе элементов синовиальной оболочки обнаружены признаки выраженного хронического экссудативного воспаления с полнокровием сосудов на уровне посткапилляров и венул с формированием участков склерозирования и рубцевания за счет аморфных коллагеновых фибрилл, характерных для рыхлой неоформленной соединительной ткани на различных этапах ее дифференцировки. Оценка выраженности синовита по шкале GSS составила 6,4±0,5 балла и соответствовала высокоуровневому синовиту 3-й степени.
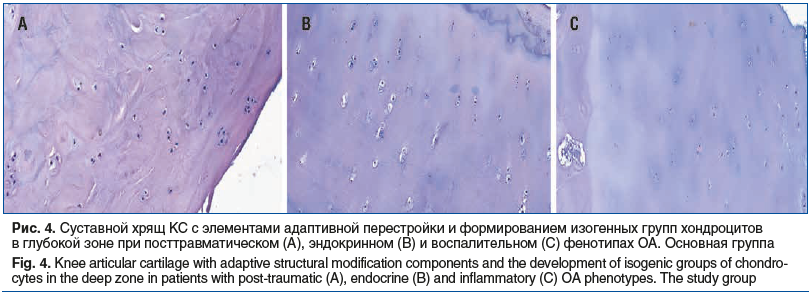
Суставной хрящ бедренной и большеберцовой костей пациентов ОГ находился в фазе адаптивной перестройки разной степени выраженности в ряду по нарастанию ее интенсивности: посттравматический фенотип — эндокринный фенотип — воспалительный фенотип (рис. 4). Фаза адаптивной перестройки СХ включала следующие процессы разной степени выраженности в зависимости от клинико-патогенетического фенотипа ОА: под поверхностным слоем регистрировали малодифференцированные хондроциты, в гомогенном матриксе встречались регенераты из малодифференцированных хондробластов, глубокая и промежуточная зоны СХ интенсивно воспринимали краситель, особенно вокруг изогенных групп хондроцитов, количество хондроцитов в лакунах составило 2 и более клеток с четко визуалируемыми базофильными ядрами, в регенератах и колонкообразных структурах интенсивная окраска свидетельствовала об активном синтезе гликозаминогликанов. Следовательно, морфологическая структура хряща в момент выполнения ТЭКС пациентам ОГ, принимавшим ХС, характеризовалась активными регенераторными процессами и наличием недифференцированных клеток.
Морфометрический анализ показал, что плотность изогенных групп хондроцитов в глубокой зоне хряща бедренной кости в подгруппах пациентов, принимавших ХС до ТЭКС, с учетом фенотипа составила в ряду по увеличению значения показателя: при посттравматическом фенотипе — 1579±46,5 единиц/мм2 (ОГ/КГ: р=0,0002), при эндокринном фенотипе — 1787±38,6 единиц/мм2 (ОГ/КГ: р=0,0001), при воспалительном фенотипе — 1888±37,3 единиц/мм2 (ОГ/КГ: р=0,0001), что в каждой из подгрупп пациентов было достоверно выше, чем в подгруппах пациентов, принимавших НПВП до ТЭКС, где с учетом фенотипа плотность составила в ряду увеличения показателя: при посттравматическом фенотипе — 1154±42,4 единиц/мм2, при эндокринном фенотипе — 1295±9,3 единиц/мм2, при воспалительном фенотипе — 1492±15,4 единиц/мм2.
Прием курса Хондрогарда до выполнения ТЭКС способствовал уменьшению выраженности морфологических проявлений синовита при ОА КС со снижением интенсивности этого процесса в ряду: воспалительный фенотип (GSS 2,5±0,5 балла; ОГ/КГ: р=0,0001) — эндокринный фенотип (GSS 1,5±0,5 балла; ОГ/КГ: р=0,0001) — посттравматический фенотип (GSS 1,4±0,5 балла; ОГ/КГ: р=0,0001), что в каждой из подгрупп пациентов было достоверно ниже, чем в подгруппах пациентов КГ.
При сравнительном полуколичественном анализе морфологии СХ пациентов с воспалительным, посттравматическим и эндокринным фенотипами ОА КС в КГ выявлена выраженная структурно-функциональная трансформация СХ (табл. 1): существенные различия между подгруппами пациентов отмечены по шкале Mankin — наихудшие показатели состояния хряща констатировали при посттравматическом фенотипе, наилучшие — при эндокринном фенотипе. Согласно оценке СХ с помощью шкалы OARSI минимальные значения были получены при эндокринном фенотипе. Статистически значимые различия между подгруппами посттравматического и воспалительного фенотипа отсутствовали.
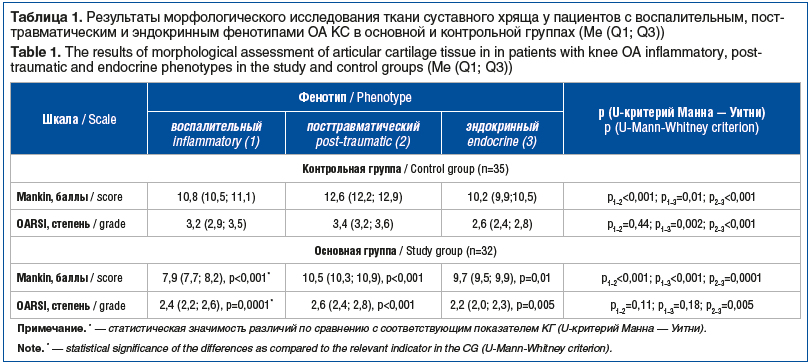
Прием Хондрогарда за 2 мес. до ТЭКС сопровождался значимым снижением баллов по шкале Mankin у пациентов всех фенотипов ОА КС с наименьшим количеством баллов у пациентов с воспалительным фенотипом, а также существенным снижением баллов по шкале OARSI у пациентов всех фенотипов с наименьшим уровнем баллов у пациентов с эндокринным фенотипом (см. табл. 1).
При включении в исследование (визит 0) статистически значимых различий ни по одному из лабораторных показателей в КГ и ОГ выявлено не было (табл. 2). Однако установлены существенные различия по показателям биомаркеров костного метаболизма, метаболизма в хрящевой ткани и коллагена II типа, синовиального и системного воспаления, гормоноподобных соединений в крови в зависимости от клинико-патогенетического фенотипа: у пациентов с воспалительным фенотипом ОА КС имели место самые высокие уровни ГК, СРБ, остеокальцина, ФНО-α и самые низкие уровни ММП-13, склеростина по сравнению с аналогичными показателями у пациентов с пост-травматическим и эндокринным фенотипами при более высоких концентрациях адипсина, лептина, 25(ОН)D3 и более низких показателях CTX-1 при сравнении с аналогичными показателями в условиях посттравматического фенотипа, при более низких концентрациях адипсина, лептина в крови и более высоких показателях ММП-3, COMP по сравнению с аналогичными показателями в условиях эндокринного фенотипа. Не получено статистически значимых различий по показателям концентрации PIIANP, CTX-1 в крови пациентов с воспалительным и эндокринным фенотипами, концентрации COMP при воспалительном и посттравматическом фенотипах, а также по содержанию 25(ОН)D3 в крови пациентов с воспалительным, посттравматическим фенотипами, с одной стороны, и эндокринным фенотипом — с другой (см. табл. 2).
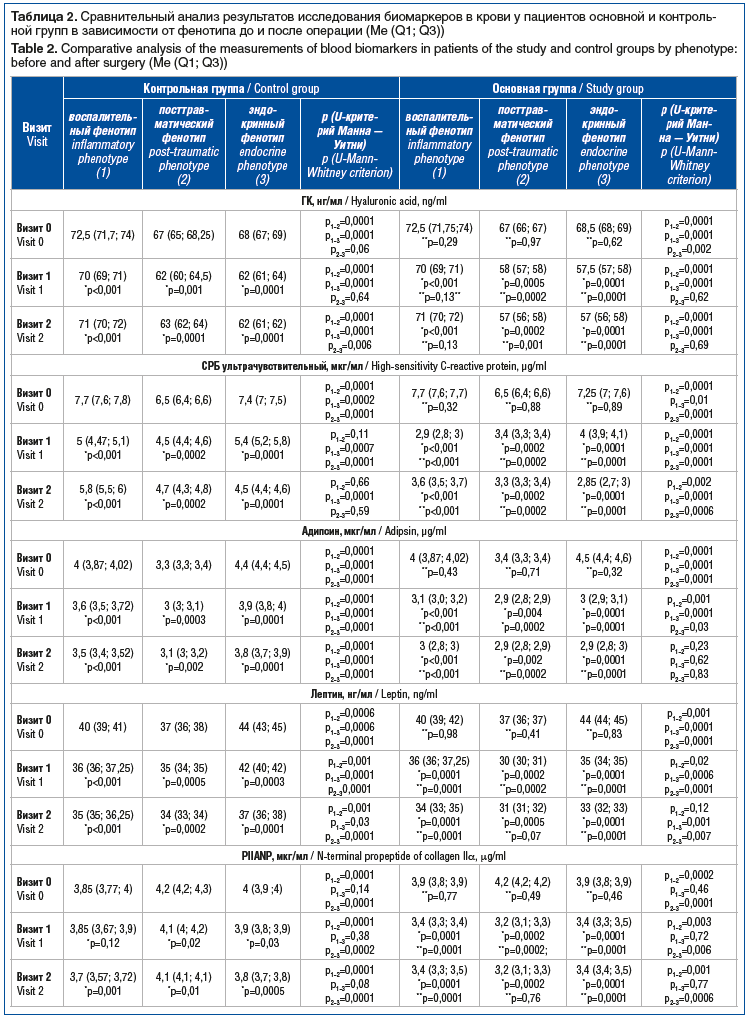
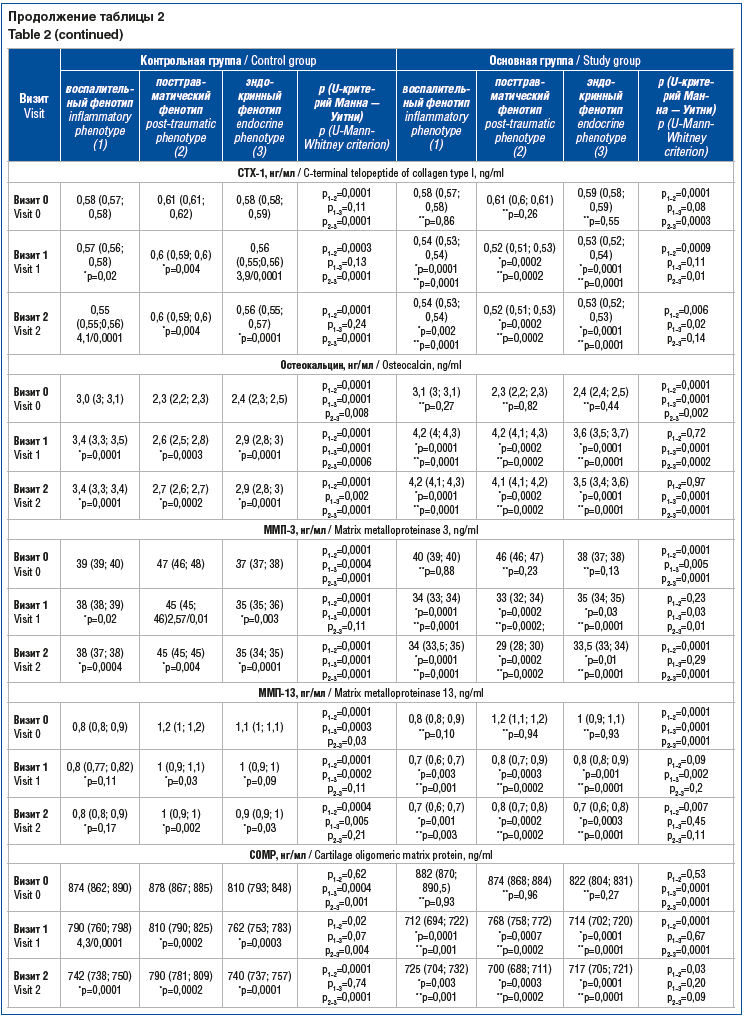
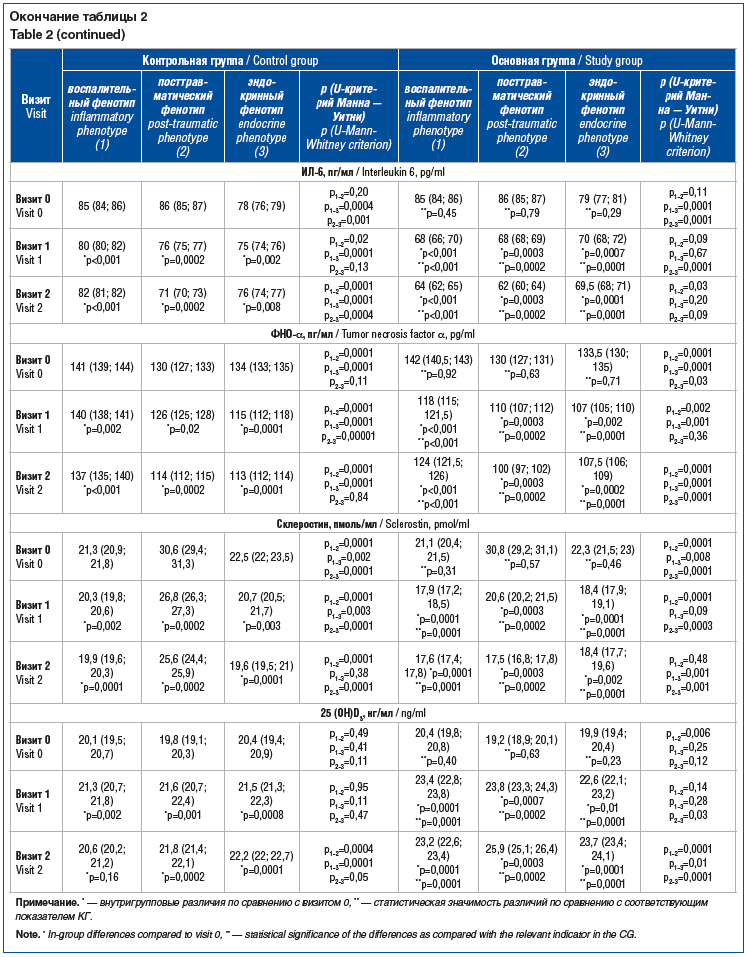
На визите 1 (при выписке из стационара) регистрировали более выраженное статистически значимое снижение значений всех лабораторных тестов при существенном увеличении уровня остеокальцина и 25(ОН)D3 в крови пациентов всех фенотипов в ОГ по сравнению с КГ, за исключением концентрации ГК в крови пациентов с воспалительным фенотипом, значения которой не отличались от значений пациентов КГ с воспалительным фенотипом (см. табл. 2).
Через 3 мес. после проведения ТЭКС (визит 2) у пациентов всех фенотипов в ОГ отмечено дальнейшее существенное снижение всех биомаркеров в крови при значимом увеличении уровней остеокальцина и 25(ОН)D3 по сравнению с КГ. Установлено, что на данном сроке наблюдения концентрация ГК у пациентов с воспалительным фенотипом в обеих группах, а также уровни лептина и PIIANP в крови пациентов с посттравматическим фенотипом обеих групп статистически значимо не различались (см. табл. 2).
Полученные результаты лабораторного тестирования крови позволили охарактеризовать на уровне эндотипов 3 клинико-патогенетических фенотипа ОА КС (воспалительный, посттравматический и эндокринный), а также детализировать механизмы противовоспалительного, обез-боливающего, метаболического и структурно/болезньмодифицирующего эффектов ХС (препарат Хондрогард®).
Обсуждение
Анализ данных морфологической оценки гистоархитектоники СХ и результатов лабораторного тестирования крови у пациентов с ОА КC III стадии по K–L, перенесших операцию ТЭКС, и ОА контралатерального КС II стадии по K–L с высоким уровнем нагрузки на него в период реабилитации после ТЭКС, позволил охарактеризовать 3 клинико-патогенетических фенотипа ОА КС (воспалительный, посттравматический и эндокринный) с учетом эндотипических особенностей, а также детально представить механизмы противовоспалительного, обезболивающего, метаболического и структурно-модифицирующего эффектов ХС в парентеральной форме (препарат Хондрогард®) и обосновать эффективность и безопасность методов предоперационной фармакотерапии ОА, оказывающей влияние на качество послеоперационного периода.
Результаты морфологического анализа СХ пациентов КГ свидетельствуют об увеличении количества дистрофически измененных хондроцитов (крупные пустоты в клетках, деструкция цитоплазмы, полное разрушение цитоплазмы и ядра клетки, лакунообразные пустоты вокруг клеток, рыхло расположенный зернистый компонент (протеогликаны), редкие отдельные тонкие коллагеновые фибриллы). Необходимо отметить, что самая высокая степень выраженности деструктивных процессов в СХ с нарушением зональности, дистрофических процессов в хондроцитах и нарушения метаболизма в ЭЦМ отмечена при посттравматическом фенотипе ОА КС.
Известно, что дегенеративный процесс, который мы наблюдали при всех фенотипах ОА, может привести к гипертрофии хондроцитов и их активации с аберрантной экспрессией провоспалительных и катаболических генов [24, 25]. Изменения в фенотипическом состоянии хондроцитов в поверхностной, промежуточной и глубокой зонах СХ при ОА КС сопровождаются нарушением синтеза коллагена II типа, а также коллагенов III, IX, XI и VI типов, регулирующих механотрансдукцию хондроцитов, опосредуя механические свойства перицеллюлярного матрикса [26]. Считают, что потеря коллагена II типа ускоряет гипертрофию хондроцитов через костный морфогенетический белок посредством сигнального пути SMAD1 [27].
Отмеченное выше нарушение структуры ЭЦМ, в КГ в наибольшей степени выраженное при посттравматическом фенотипе ОА, вероятно, отражает изменение метаболической активности и функции протеогликанов, имеющих одну или несколько цепей гликозаминогликанов, представленных аггреканом, являющимся самым большим из них, образующим мультимолекулярный комплекс с ГК, где гликозаминогликаны кератан-сульфат и ХС должны присоединяться и стабилизироваться связующими белками [28]. Этот процесс, вероятно, существенно нарушен при посттравматическом фенотипе ОА.
Обнаруженные нами морфологические признаки хронического экссудативного воспаления высокого уровня в синовиальной оболочке КС пациентов КГ, несмотря на прием НПВП до операции ТЭКС, в наибольшей степени выражены в подгруппе пациентов с воспалительным фенотипом ОА КС. Прием НПВП до операции ТЭКС позволил, вероятно, устранить в ближнесрочной перспективе острую фазу воспаления в клетках суставных тканей, однако не оказывал влияния на долгосрочные процессы, связанные с нарушением гомеостаза клеток суставных тканей, включая фенотипические изменения синовиоцитов и хондроцитов, активацию ферментов, разрушающих матрикс с одновременным дисбалансом экспрессии поверхностных рецепторов к различным цитокинам и ростовым факторам [29].
Прием НПВП до ТЭКС пациентами с эндокринным фенотипом ОА КС сопровождался менее выраженным в сравнении с посттравматическим фенотипом ОА нарушением зонального строения СХ, однако отмечена интенсификация патологических процессов СХ со стороны субхондральной кости (разрушение хряща в области субхондральной кости, отсутствие либо неровные контуры базофильной линии, проникновение сосудов из субхондральной кости), что свидетельствует о необходимости оптимизации предоперационной терапии с включением лекарственных средств, в механизме действия которых присутствует влияние на процессы ремоделирования в субхондральной кости и костный метаболизм, т. е. обладающих структурно/болезньмодифицирующим эффектом. Хроническое экссудативное воспаление средней степени выраженности в синовиальной оболочке КС у этой подгруппы пациентов, сохраняющееся после проведения стандартного предоперационного курса НПВП, доказывает необходимость включения в предоперационную подготовку лекарственных средств, в спектре фармакологических эффектов которых присутствует как противовоспалительный, так и иммуномодулирующий эффект в отношении активности клеток врожденного и приобретенного иммунитета, широко представленных в суставных тканях и играющих ключевую роль в том числе в поддержании хронического экссудативного воспаления в синовиальной оболочке при эндокринном фенотипе ОА КС в неблагоприятных условиях нарушенного функционирования иммуноэндокринных сетевых взаимодействий.
Морфологические проявления механизма действия высокоочищенного ХС в парентеральной форме включали снижение интенсивности экссудативного воспаления и дегенеративной атрофии в синовиальной оболочке, наиболее выраженные в условиях посттравматического фенотипа ОА КС, признаки адаптивной перестройки СХ, наиболее выраженные при воспалительном фенотипе ОА КС: малодифференцированные хондроциты в поверхностном слое, регенераты из малодифференцированных хондробластов в гомогенном матриксе, увеличение плотности изогенных групп хондроцитов и количества хондроцитов с четко визуализируемыми базофильными ядрами, активный синтез гликозаминогликанов.
Морфологические проявления механизма противовоспалительного, обезболивающего, метаболического и структурно-модифицирующего эффектов ХС в парентеральной форме на уровне СХ и синовиальной оболочки и их выраженность в условиях трех клинико-патогенетических фенотипов ОА КС в декомпенсированной форме обусловлены специфической динамикой биомаркеров костного метаболизма, метаболизма хрящевой ткани и коллагена II типа, синовиального и системного воспаления, системных эндокринных нарушений и связанных метаболических изменений в СХ и синовиальной оболочке сустава, механического повреждения суставных тканей в крови.
Обнаруженное нами более выраженное, по сравнению с КГ, снижение уровня таких лабораторных показателей крови, как СРБ, ФНО-α и ИЛ-6, лептин, адипсин, PIIANP, CTX-1, ММП-3 и ММП-13, COMP, склеростин при существенном увеличении уровня остеокальцина и 25(ОН) D3 в крови пациентов всех фенотипов ОА КС в ОГ свидетельствует об интенсификации следующих молекулярных процессов в клетках суставных тканей: устранение тормозящего влияния склеростина на Wnt/β-катенин-сигнальную систему со снижением концентрации β-катенина в цитоплазме и ядре остеобласта и усилением пролиферации и дифференцировки остеобластов [30], стабилизация процессов костного ремоделирования с предотвращением дестабилизации хрящевой ткани со стороны субхондральной кости (СТХ-1, PIIANP, остеокальцин) [31], увеличение обмена коллагена I типа в костной ткани с активацией механизмов ремоделирования костной ткани у больных ОА в оперированном и контралатеральном КС [32–34], увеличение уровня синтеза коллагена II типа в хряще при ОА контралатерального КС (PIIANP), что соответствует данным других авторов [35], снижение степени системного и локального воспаления (синовит), ограничение деградации ЭЦМ и стабилизация уровня катаболических факторов в хрящевой ткани (СРБ, ГК, лептин, адипсин, ФНО-α, ММП-3) с замедлением темпов деградации хрящевой ткани в контралатеральном суставе [36–38], ограничение патологического распада коллагена II типа и аггрекана в хрящевой ткани контралатерального сустава, а также процессов дегенерации в субхондральной кости в обоих КС (ММП-13) [39, 40], уменьшение выраженности болевого синдрома (ИЛ-6, COMP) [41]. Выраженность динамики содержания биомаркеров ключевых патологических процессов и регулируемых ими патобиохимических процессов различалась в подгруппах пациентов с разными фенотипами ОА КС, принимавших ХС в парентеральной форме до ТЭКС в предоперационном периоде: наиболее выраженное снижение уровня СРБ, ФНО-α, ИЛ-6, COMP (противовоспалительный и обезболивающий эффекты ХС) отмечено у пациентов с воспалительным фенотипом, уровня адипсина и лептина (противовоспалительный и метаболический эффекты ХС) — у пациентов с эндокринным фенотипом, концентрации ММП-13 — у пациентов с эндокринным и посттравматическим фенотипами (структурно/болезньмодифицирующий эффект), концентрации склеростина, СТХ-1, PIIANP, ММП-3 при более значимом увеличении уровня остеокальцина (структурно/болезньмодифицирующий эффект) — у пациентов с посттравматическим фенотипом; различия в увеличении уровня 25(ОН)D3 (структурно/болезньмодифицирующий эффект) получены в подгруппах посттравматического и эндокринного фенотипов ОА КС.
Следовательно, высокоочищенный ХС (препарат Хондрогард®), применявшийся в составе предоперационной подготовки к проведению ТЭКС у пациентов с ОА КС, продемонстрировал плейотропное фармакологическое действие, включавшее противовоспалительный, обезболивающий, метаболический структурно/болезньмодифицирующий эффекты, выраженность которых отличалась в условиях воспалительного, посттравматического и эндокринного фенотипов ОА КС.
Интересным представляется тот факт, что, несмотря на статистически значимое снижение уровня ГК в крови пациентов с воспалительным фенотипом в КГ и ОГ, отсутствовали статистически значимые различия в показателях ее концентрации в крови в обеих группах на визитах 1 и 2, а также существенные различия в уровнях лептина и PIIANP в крови пациентов с посттравматическим фенотипом в ОГ и КГ через 3 мес. после проведения ТЭКС. Полученные данные требуют проведения дополнительных исследований механизма формирования описанных эффектов ХС в отношении биомолекул — ГК и PIIANP с выполнением предварительного биоинформационного анализа межмолекулярных взаимодействий и их динамики при приеме парентеральной формы ХС (препарат Хондрогард®).
Заключение
В настоящем исследовании у пациентов были выявлены различия в интенсификации процессов адаптивной перестройки во всех слоях СХ и выраженности ограничения воспаления в синовиальной оболочке КС, а также явлений деградации в области субхондральной кости после двухмесячного дооперационного курса терапии парентеральной формой ХС. Данные различия объясняются наличием у каждого конкретного пациента определенного клинико-патогенетического фенотипа ОА КС декомпенсированной формы (воспалительного, посттравматического, эндокринного) с особенностями исходной патоморфологической перестройки СХ. Лабораторное тестирование при прогрессирующей форме ОА КС продемонстрировало, что применение предоперационного курса терапии парентеральной формой ХС (Хондрогард®) восстанавливает баланс содержания биомаркеров, относящихся к следующим кластерам: костного метаболизма (эффект наиболее выражен при посттравматическом фенотипе), метаболизма в хрящевой ткани и коллагена II типа (эффект наиболее выражен при посттравматическом и эндокринном фенотипах), синовиального и системного воспаления (эффект наиболее выражен при воспалительном фенотипе), механического повреждения (эффект наиболее выражен при посттравматическом фенотипе). Выраженность противовоспалительного, обезболивающего, метаболического и структурно/болезньмодифицирующего эффектов высокоочищенного ХС в парентеральной форме определяется эндотипом ОА, т. е. набором преобладающих биомаркеров (костного метаболизма, метаболизма в хряще и коллагена II типа, синовиального и системного воспаления, механического повреждения или их сочетания) в кластере с высокой экспрессией при конкретном фенотипе ОА. Полученные данные могут служить основанием для разработки персонализированных режимов терапии парентеральной формой ХС ОА разных локализаций, стадии и степени нарушения функции с учетом отнесения пациента к тому или иному фено- и эндотипу ОА.
Таким образом, проведенное исследование позволяет рекомендовать применение препарата Хондрогард® курсом 25 инъекций за 2 мес. до проведения ТЭКС с целью улучшения как непосредственных, так и отдаленных функциональных результатов оперативного вмешательства, а также проведение дополнительных исследований механизма действия ХС в отношении биомолекул ГК и PIIANP.
Сведения об авторах:
Минасов Тимур Булатович — д.м.н., профессор, профессор кафедры травматологии и ортопедии с курсом ИДПО ФГБОУ ВО БГМУ Минздрава России; 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0003-1916-3830.
Лила Александр Михайлович — д.м.н., член-корр. РАН, директор ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское ш., д. 34А; заведующий кафедрой ревматологии ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-6068-3080.
Назаренко Антон Герасимович — д.м.н., профессор РАН, директор ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России; 127299, Россия, г. Москва, ул. Приорова, д. 10; ORCID iD 0000-0003-1314-2887.
Сарвилина Ирина Владиславовна — д.м.н., клинический фармаколог, генеральный директор ООО «МЦ «Новомедицина»; 344002, Россия, г. Ростов-на-Дону, ул. Социалистическая, д. 74; ORCID iD 0000-0002-5933-5732.
Загородний Николай Васильевич — д.м.н., член-корр. РАН, профессор кафедры травматологии и ортопедии, руководитель клиники эндопротезирования суставов ФГБУ «НМИЦ ТО им. Н.Н. Приорова» Минздрава России; 127299, Россия, г. Москва, ул. Приорова, д. 10; заведующий кафедрой травматологии и ортопедии медицинского факультета ФГАОУ ВО РУДН; 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 6; ORCID iD 0000-0002-6736-9772.
Контактная информация: Сарвилина Ирина Владиславовна, e-mail: isarvilina@mail.ru.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 16.01.2023.
Поступила после рецензирования 08.02.2023.
Принята в печать 07.03.2023.
About the authors:
Timur B. Minasov — Dr. Sc. (Med.), Professor, Professor of the Department of Traumatology and Orthopedics, Bashkir State Medical University; 3, Lenin str., Ufa, 450008, Russian Federation; ORCID iD 0000-0003-1916-3830.
Aleksandr M. Lila — Dr. Sc. (Med.), Corresponding Member of RAS, Director of V.A. Nasonova Research Institute of Rheumatology; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; Head of the Rheumatology Department, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 123995, Russian Federation; ORCID iD 0000-0002-6068-3080.
Anton G. Nazarenko — Dr. Sc. (Med.), Professor of RAS, Director of N.N. Priorov National Medical Research Center for Traumatology and Orthopedics; 10, Priorov str., Moscow, 127299, Russian Federation; ORCID iD 0000-0003-1314-2887.
Irina V. Sarvilina — Dr. Sc. (Med.), clinical pharmacologist, Director General of LLC Medical Center «Novomeditsina»; 74, Sotsialisticheskaya str., Rostov-on-Don, 344002, Russian Federation; ORCID iD 0000-0002-5933-5732.
Nikolay V. Zagorodniy — Dr. Sc. (Med.), Corresponding Member of RAS, Professor of the Department of Traumatology and Orthopedics, Head of the Arthroplasty Clinic, N.N. Priorov National Medical Research Center for Traumatology and Orthopedics; 10, Priorov str., Moscow, 127299, Russian Federation; Head of the Department of Traumatology and Orthopedics of the Medical Faculty, Russian University of Peoples’ Friendship; 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation; ORCID iD 0000-0002-6736-9772.
Contact information: Irina V. Sarvilina, e-mail: isarvilina@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 16.01.2023.
Revised 08.02.2023.
Accepted 07.03.2023.
Информация с rmj.ru
