Обзор посвящен анализу режима гипофракционирования при лечении рака предстательной железы.
До сих пор ведется дискуссия между историками о том, кто впервые использовал ионизирующее излучение для лечения онкологических заболеваний из множества претендентов на эту роль по обе стороны Атлантики. В то же время существует общее мнение, что радиотерапевтическая практика в течение первых двух десятилетий ХХ в. принадлежала немецкой школе в Эрлангене, ученики которой были сторонниками использования единственной, «кастрирующей» дозы рентгеновского излучения [1]. Учитывая относительно примитивное оборудование того времени, неудивительно, что клинические результаты были неудовлетворительными. Уже в 1930 г. эксперименты над животными в Институте Кюри в Париже показали, что растягивание дозы на период в несколько недель может улучшить контроль над опухолью при сопоставимой токсичности для окружающих тканей. Затем последовали исследования по изучению эффектов, зависящих от длительности лечения, и, как итог, публикации Coutard [2], показавшие результаты лечения опухолей головы и шеи, которые явно превосходили немецкие данные. Это определило основную тенденцию в радиотерапии на большей части земного шара на протяжении практически 50 лет, с общепринятыми 20–40 фракциями в течение 3–6 нед. Суть фракционирования в лучевой терапии можно пояснить следующим образом. Деление дозы на несколько фракций помогает сохранить нормальные ткани благодаря их способности восстанавливать сублетальные повреждения между отдельными фракциями, а также способности к репопуляции, если общее время облучения достаточно длительное. Вместе с тем деление дозы на несколько фракций увеличивает повреждение опухоли благодаря реоксигенации и перераспределению клеток в радиочувствительные фазы клеточного деления между фракциями. Преимуществами длительного лечения являются отсрочка развития ранних лучевых реакций и возможность адекватной реоксигенации опухоли. Однако чрезмерно пролонгированное лечение позволяет выжившим опухолевым клеткам делиться во время лечения.
Знаковым достижением в радиобиологии в 1980-х гг. было принятие систематических различий между острыми и поздними реакциями нормальных тканей в зависимости от типа фракционирования [3]. Поздние реакции более зависимы от величины дозы за фракцию, чем острые реакции. С точки зрения линейно-квадратичной модели взаимосвязи между дозой и эффектом ранние эффекты соответствуют большему отношению α/β, поздние эффекты — меньшему отношению α/β. Отношение α/β показывает ту дозу, при которой клеточная гибель, определяемая линейным компонентом α, равна клеточной гибели, определяемой квадратичным компонентом β. Это проиллюстрировано на рисунке 1. Для ранних эффектов отношение α/β высокое; как следствие, α доминирует при низких дозах, так что кривая доза-ответ имеет выраженный начальный наклон и не сгибается до высоких доз. Линейный и квадратичный компоненты клеточной гибели не равны вплоть до дозы 10 Гр. Как следствие, фракционирование дозы приводит к умеренному уменьшению биологического эффекта. Напротив, для поздних эффектов отношение α/β маленькое, так что β изменяется уже при низких дозах, отсюда кривая доза-объем сгибается уже при низких дозах и выглядит более согнутой; линейный и квадратичный компоненты клеточной гибели уравниваются примерно при 2 Гр. Таким образом, фракционирование дозы приводит к значительному снижению биологического эффекта. Разница между ранними и поздними тканевыми реакциями отображена на рисунке 2.
Когда отношение α/β большое, т. е. доза, при которой линейный и квадратичный компоненты уравниваются, является высокой, фракционирование приводит к незначительным изменениям биологического эффекта. Это характерно для большинства злокачественных опухолей, так же как и для рано реагирующих нормальных тканей (рис. 2а). В случае если отношение α/β маленькое, например для поздно реагирующих нормальных тканей, фракционирование ведет к большим изменениям биологического эффекта (рис. 2б). Как уже было сказано, большинство опухолей простаты обладают очень медленным ростом и, таким образом, могут реагировать на изменения фракционирования так же, как поздно реагирующие нормальные ткани.
Подобное понимание разницы между рано реагирующими (большинство опухолей) и поздно реагирующими тканями в 1980–1990-х гг. породило тенденцию увеличивать количество фракций в целях увеличения разницы между реакцией поздно реагирующих тканей и реакцией опухоли, т. е. улучшения контроля над опухолью при меньшей токсичности для нормальных тканей. Были проведены клинические исследования с большим количеством фракций вплоть до 70, с возможностью подведения двух фракций за день с интервалом в 6 ч [4]. Клинические исследования показали превосходство гиперфракционирования для некоторых локализаций опухолей, подтверждая достоверность радиобиологических доказательств. Между тем гиперфракционирование никогда не являлось основным типом лечения из-за сложности планирования времени лечения в течение рабочего дня вследствие занятости радиотерапевта.
Содержание статьи
Гипофракционирование при лечении рака простаты
В 1999 г. Brenner и Hall предположили [5], что общепринятый аргумент о том, что множественные фракции могли бы уменьшить токсичность поздно реагирующих тканей при определенном уровне контроля над опухолью, необязательно подходит применительно к раку простаты, возможно, потому, что эта опухоль обладает медленным ростом. Они предложили метод для вычисления отношения α/β для рака простаты путем сравнения опубликованных данных дистанционной лучевой терапии с данными брахитерапии и определили отношение α/β для рака простаты, примерно равное 1,5 Гр (0,8–2,2), сравнимое с таковым для поздно реагирующих тканей и гораздо меньшее, чем для большинства других опухолей [5]. Хотя причина различий отношения α/β для рано и поздно реагирующих тканей никогда не была окончательно доказана, существует вероятная гипотеза, что отношение α/β определено пропорцией делящихся и неделящихся клеток. Ввиду того, что большинство опухолей простаты обладают медленным ростом, не существует большой разницы с точки зрения темпов клеточного деления между типичным раком простаты и окружающими, поздно реагирующими нормальными тканями. Эта находка сглаживает преимущества множественных фракций и позволяет предположить, что «если чувствительность к фракционированию для опухоли и для окружающих, поздно реагирующих нормальных тканей одинакова, гораздо меньшее количество фракций (с подходяще уменьшенной суммарной дозой) было бы ожидаемо эффективнее, кроме того, логистически и финансово выгоднее» [5]. Такая техника использования меньшего количества фракций с увеличенной разовой дозой стала известна как гипофракционирование при раке простаты.
Тогда же Duchesne и Peters независимо друг от друга затронули вопрос величины отношения α/β для рака простаты и пришли к выводу, что существует обстоятельное доказательство того, что отношение α/β при раке простаты схоже с таковым у поздно реагирующих тканей, а «использование гипофракционной брахитерапии может быть выгодным, а не просто целесообразным и может увеличить терапевтическое преимущество при лечении локализованного рака простаты» [6].
С тех пор, как эти два утверждения были опубликованы в 1999 г., произошли два значительных события.
Первое. Было предпринято несколько независимых попыток определить ценность отношения α/β для рака простаты из клинических данных. Эти показатели были суммированы в таблице 1 [7–15]. Полученные результаты, несмотря на определенный лимит доверия, оказались в основном гораздо ниже, чем обычные показатели [16] для других типов опухолей, поддержав оригинальную гипотезу [5], что рак простаты реагирует на фракционирование таким же образом, как поздно реагирующие нормальные ткани, а не рано реагирующие. Но тем не менее не существует точного свидетельства, подтверждающего это, кроме упоминания в докладах Valdagni et al. [17] и Pollack et al. [18, 19]. Вполне вероятно, что прогрессирующий агрессивный рак простаты может не иметь низкого отношения α/β,
и в таком случае гипофракционирование может не подходить как режим лечения.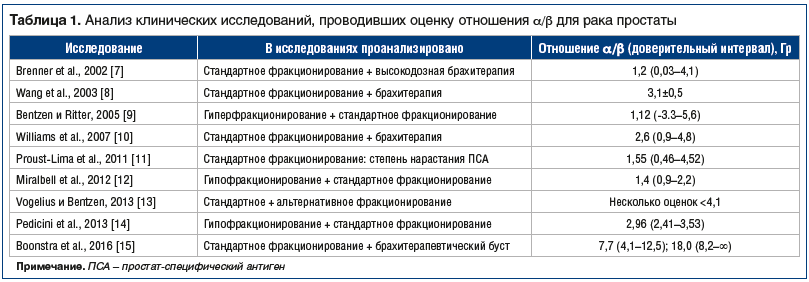
Второе. Исследователи по всему миру стремятся провести проспективные исследования с целью проверки гипотезы гипофракционирования при раке простаты. Первоначально были опубликованы нерандомизированные, а относительно недавно рандомизированные исследования [19–28], некоторые из них включали около
100 пациентов, однако затем появились исследования, включающие от 1000 до 3000 пациентов. Некоторые запланированы с целью показать, что гипофракционирование дает результаты такие же хорошие, как стандартная терапия, т. е. показать, что гипофракционирование не уступает обычному режиму.
В таблице 2 суммируются результаты 8 рандомизированных клинических исследований [19–28], представляющих умеренно гипофракционированное лучевое лечение рака простаты. «Умеренно гипофракционированное» означает использование разовой дозы в пределах 2,5–3,5 Гр за фракцию. Исследования значительно различаются по масштабам, одни включают несколько сотен пациентов, другие — тысячи. Исследования также значительно расходятся по суммарным гипофракционным дозам и дозам, использованным за фракцию.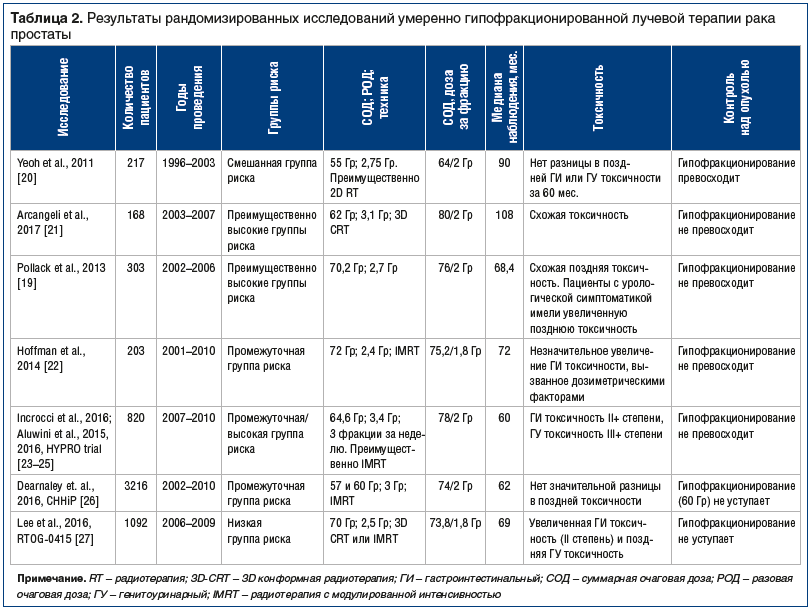
В рандомизированных исследованиях PROFIT [28] и CHHiP [26] использовали 3 Гр за фракцию. В исследовании CHHiP использовали суммарную дозу 57–60 Гр, а в PROFIT — 60 Гр с медианой наблюдения в 5 и 6 лет соответственно. Оба эти исследования показали, что гипофракционирование не уступало по контролю над опухолью, кроме того, не отмечено значительной разницы при оценке поздних токсических реакций. В исследовании RTOG 0415 [27] использовали низкие дозы за фракцию (2,5 Гр), но большие суммарные дозы (70 Гр) при медиане наблюдения в 69 мес. Что касается исследований PROFIT и CHHiP, то в RTOG 0415 продемонстрированы результаты, не уступающие первым двум в отношении контроля над опухолью при гипофракционном режиме, однако с увеличением поздней гастроинтестинальной и генитоуринарной токсичности. В еще одном исследовании, HYPRO [23–25], применялись значительно более высокие разовые дозы — 3,4 Гр и суммарная доза 64,6 Гр по сравнению с PROFIT и CHHiP; HYPRO показало отсутствие превосходства с точки зрения контроля над опухолью, а также увеличенную гастроинтестинальную острую токсичность (Grade 2+) и высокую генитоуринарную токсичность (Grade 3+). Данные токсические реакции могут быть связаны с более высокими разовой и суммарной дозами в исследовании HYPRO.
Отметим два специфических наблюдения: 1) 4 больших исследования, и только одно с целью демонстрации увеличенной токсичности нормальных тканей при использовании больших разовых доз; 2) единственное исследование [20] показало значительное преимущество гипофракционирования с точки зрения контроля над опухолью. Между тем оно имеет некоторые особенности: во-первых, это сравнительно небольшое исследование с 217 пациентами; во-вторых, возможность сравнения с точки зрения уровней рисков между гипофракционированным и стандартным режимами может породить вопросы [20]. В общем, в то время как преимущество гипофракционирования в контроле над опухолью, как кажется, было установлено, стало очевидно, что «исследования превосходства», основанные на гипотезе о том, что умеренное гипофракционирование может увеличить эффективность контроля над опухолью по сравнению со стандартным фракционированием, показали отрицательные результаты, хотя это ожидалось с тех пор, как в ретроспективе переоценивалось потенциальное преимущество гипофракционирования над стандартным режимом фракционирования. Цитата из оригинального документа: «Оптимально спланированный гипофракционный режим ожидаемо приведет к контролю над опухолью и ожидаемым поздним последствиям, а также облегчит течение острых реакций, вместе с логистическими и финансовыми преимуществами меньшего количества фракций». С возможным уменьшением острой токсичности, которая, кажется, остается на прежнем уровне, эти прогнозы в 1999 г. появились благодаря последовательным рандомизированным клиническим исследованиям. В самом деле, сейчас это возможно — утвердить основанное на доказательстве руководство по умеренно гипофракционированным режимам [29].
Экстремальное гипофракционирование рака простаты
Все дискуссии, изложенные выше, относились к так называемому умеренному гипофракционированию, которое обычно предусматривает разовые дозы в 2,5–3,5 Гр и количество фракций по меньшей мере 15. Также было отмечено некоторое количество исследований, в которых использовалось меньшее количество фракций (4–12) с большими разовыми дозами 4–10 Гр — так называемое экстремальное гипофракционирование. Такие исследования были инициированы благодаря использованию преимуществ дозного распределения стереотаксического облучения, роботизированной радиохирургии или протонной терапии. Ранние клинические результаты экстремального фракционирования на сегодняшний день пересмотрены Hocht et al. [30]. В итоге оказалось, что наряду с достигнутым контролем над опухолью отмечаются токсические явления (от умеренных до тяжелых острых реакций), распространенность которых достаточно высока — от 10 до 20%. Большинство исследований экстремального гипофракционирования еще недостаточно изучены для того, чтобы судить о поздних нежелательных реакциях [31].
Также важно отметить, что использование экстремального гипофракционирования основано не только на низком отношении α/β для рака простаты. Такая методика лечения создана, возможно, благодаря технологическим преимуществам в дозном распределении, которые позволяют подводить большие разовые дозы к опухоли с сокращенными отступами и высоким градиентом дозы по мере отдаления от объема облучения. Как следствие, объем нормальных тканей, подверженных высоким дозам облучения, значительно снижен. Такие высококонформные методики уже продемонстрировали впечатляющие результаты при лечении опухолей легких и головного мозга и считаются особенно подходящими для лечения небольших опухолей, окруженных нормальными тканями, в которых функциональные субъединицы располагаются в непосредственной близости [32]. Между тем при лучевой терапии простаты реагируют и прямая кишка, и мочевой пузырь, по крайней мере их большая часть, ввиду последовательной организации их функциональных субъединиц [33, 34].
Большинство исследований экстремального гипофракционирования при раке простаты, опубликованных к настоящему времени, не были рандомизированными [30]. Ранние результаты рандомизированных исследований 2-й фазы были представлены Lukka et al. [35], результаты 3-й фазы опубликованы Widmark et al. [36]. Эти рандомизированные и многие другие нерандомизированные исследования экстремального гипофракционирования остаются многообещающими, однако еще предстоит оценить контроль над опухолью и токсичность для нормальных тканей. В этой связи проводится несколько исследований 3-й фазы для определения эффективности экстремального гиперфракционирования при применении 5 фракций. Дозы за фракцию варьируют от 7,25 [37] до 7,6 Гр [38] и вплоть до 8 Гр [39]. В этих исследованиях доставка дозы является высококонформной, с применением стереотаксической лучевой [37, 39] или протонной [38] терапии. Две проблемы ждут своего решения в этих исследованиях. Первая — достижение контроля над опухолью, в особенности важен вопрос, будет ли достаточно 5 фракций для преодоления опухолевой гипоксии [40]. Вторая — каковы будут поздние последствия, которые должны определить, достаточно ли дозное распределение, используемое в этих исследованиях, для уменьшения токсичности довольно агрессивной с биологической точки зрения эффективной дозы [29]. Главный вопрос исследований — это целесообразность потенциального использования экстремального гипофракционирования при лечении рака простаты.
Заключение
Гипофракционирование при раке простаты представляет собой замечательный пример успешного трансляционного исследования рака. Начальные предположения по поводу умеренного гипофракционирования при лечении рака простаты выросли из с трудом завоеванного механистического понимания фундаментальной основы фракционирования лучевой терапии [3] и развились после многочисленных дебатов в литературе, обсуждений нерандомизированных и рандомизированных клинических исследований. Умеренное гипофракционирование в наши дни, вероятно, становится стандартом при лучевой терапии рака простаты. Перспективы использования экстремального гипофракционирования пока что не ясны.
Информация с rmj.ru

