«Золотой стандарт» лечения НИРМП — трансуретральная резекция (ТУР), однако частота возникновения рецидивов после ТУР крайне высока. Значительный прогресс в диагностике и лечении НИРМП многие авторы связывают с использованием фотодинамической терапии (ФДТ).
Цель исследования: оценить эффективность применения фотодинамической диагностики (ФДД) ФДТ с использованием отечественной видеосистемы и ТУР при лечении больных НИРМП.
Материал и методы: в качестве флуоресцентной видеосистемы использовали отечественный аппарат. В исследовании участвовали 32 пациента в возрасте 60±5 лет с НИРМП (в стадии Та-Т1-Тis): 14 женщин и 18 мужчин.
Из 32 больных, включенных в группу исследования, у 22 было выявлено в общей сложности 52 участка слизистой, флуоресцирующих при ФДД и неизмененных в белом свете. Далее выполняли ТУР в сочетании с ФДТ. Пациентам после операции каждые 3 мес. в течение года проводили цистоскопию и ультразвуковое исследование мочевого пузыря для оценки эффективности лечения и выявления рецидивов РМП.
Результаты исследования: при ФДД с использованием отечественной флуоресцентной видеосистемы в 12 (23%) участках, пропущенных при стандартной цистоскопии в белом свете, был верифицирован рак. У 3 (9,4%) больных из 32 находившихся под наблюдением рецидивы РМП были выявлены при контрольных обследованиях на сроках 9 и 12 мес. после операции. Рецидив опухолевого процесса после комбинированного лечения ФДТ+ТУР отмечен у пациентов с изначально множественными очагами опухоли.
Заключение: рецидив опухоли в течение года после проведенного лечения отмечен только у 3 (9,4%) больных, что расценено как положительный результат.
Ключевые слова: неинвазивный рак мочевого пузыря, отечественная флуоресцентная видеосистема, фотосенсибилизатор, фотодинамическая терапия.
Для цитирования: Бабаев А.Б., Лоран О.Б., Серегин А.В., Дадашев Э.О., Лощенов В.Б. Опыт применения фотодинамической терапии с использованием отечественной флуоресцентной видеосистемы в лечении неинвазивного рака мочевого пузыря // РМЖ. Медицинское обозрение. 2018. №12. С. 48-51
A.B. Babaev1, O.B. Loran1, A.V. Seregin1,2, E.O. Dadashev2, V.B. Loschenov3
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Botkin City Clinical Hospital, Moscow
3 Prokhorov General Physics Institute of the Russian Academy of Sciences, Moscow
Among the malignant tumors of the urinary tract, the rate of bladder cancer (BC) in Russia is 70%, an increase in the incidence rate of 11.76% in 10 years from 2006 to 2016 was observed. Non-invasive bladder cancer (NIBC) is characterized by a continuously progressive course and frequent relapse.
The “golden standard” for treating NIBC is transurethral resection (TUR), but the incidence of relapses after TUR is extremely high. Significant progress in the diagnosis and treatment of NIBC is attributed by many authors to the use of photodynamic therapy (PDT).
Aim: to evaluate the effectiveness of the use of photodynamic diagnostics (PDD) and therapy with the domestic video system together with TUR in the treatment of patients with NIBC.
Patients and Methods: a domestic device was used as a fluorescent video system. The study involved 32 patients aged 60±5 years with NIBC (at the stage of Ta-T1-Tis): 14 women and 18 men. Of the 32 patients included in the study group, in 22, a total of 52 mucous membrane areas were revealed, fluorescent in PDD and unchanged in white light.
Next, TUR+PDT was performed. Patients after surgery underwent cystoscopy and ultrasound of the bladder every 3 months during the year to evaluate the effectiveness of treatment and to detect BC relapses.
Results: during PDD with the domestic fluorescent video system in 12 (23%) areas that were missed with standard white light cystoscopy, cancer was verified. In 3 (9.4%) patients out of 32 patients under observation, BC relapses were detected during follow-up examinations at 9 and 12 months after the operation. The recurrence of the tumor process after the comprehensive treatment of PDT+TUR was observed in patients with initially multiple tumor foci.
Conclusion: tumor recurrence within a year after treatment was observed only in 3 (9.4%) patients, which was regarded as a positive result.
Key words: non-invasive bladder cancer, domestic fluorescent video system, photosensitizer, photodynamic therapy.
For citation: Babaev A.B., Loran O.B., Seregin A.V. et al. Experience of photodynamic therapy application by the domestic fluorescent video system in the treatment of non-invasive bladder cancer // RMJ. Medical Review. 2018. № 12. P. 48–51.
В статье описан опыт применения фотодинамической терапии с использованием отечественной флуоресцентной видеосистемы в лечении неинвазивного рака мочевого пузыря.
Содержание статьи
Введение
В настоящее время проблема лечения онкологических заболеваний не теряет своей актуальности. Рак мочевого пузыря (РМП) занимает 7-е место по распространенности у мужчин и 11-е — у лиц обоих полов. По всему миру стандартизированная по возрасту частота заболевания составляет 9,0 случая на 100 000 для мужчин и 2,2 случая на 100 000 для женщин. В 2012 г. стандартизированная по возрасту смертность во всем мире от РМП на 100 000 человек составила 3,2 случая у мужчин и 0,9 у женщин [1].
Среди злокачественных опухолей мочевого тракта доля
РМП в России составляет 70%, отмечен прирост заболеваемости на 11,76% за 10 лет, с 2006 по 2016 г. [2]. Папиллярная опухоль, ограниченная слизистой и подслизистой оболочкой, относится к стадии Та и T1 соответственно, плоские, ограниченные слизистой оболочкой опухоли высокой степени злокачественности классифицируют как карциному in situ (СIS), они объединены под общим названием «неинвазивный рак мочевого пузыря» (НИРМП).
НИРМП характеризуется непрерывно прогрессирующим течением и частым рецидивированием [3]. «Золотой стандарт» лечения НИРМП — трансуретральная резекция (ТУР), однако частота возникновения рецидивов после ТУР крайне высока (50–90%, в среднем 80%). Рецидивы связаны с множественностью опухолевых зачатков, не выявляемых очагов carcinoma in situ, недостаточным объемом хирургического пособия и возможностью имплантации опухолевых клеток во время операции [4]. Таким образом, неверная оценка опухолевого поражения мочевого пузыря приводит к частым рецидивам после ТУР, что, в свою очередь, ведет к прогрессированию опухолевого процесса, исключающему органосохраняющие методы лечения [5, 6]. Стандартная цистоскопия и ТУР проводятся при обычном (белом) освещении, использование такого освещения приводит к тому, что некоторые образования остаются невидимыми, в связи с чем важное значение приобретают мероприятия, направленные на дополнительные методы диагностики, лечения и профилактики рецидивов РМП.
В настоящее время уделяется большое внимание лечению онкологических заболеваний с применением различных методов биомедицинской физики. Один из них — фотодинамическая диагностика (ФДД) и терапия (ФДТ) отечественной флуоресцентной видеосистемой. Применение ФДТ стало возможным благодаря совершенствованию лазерных и эндоскопических технологий, разработке малотоксичных фотосенсибилизаторов (ФС). Использование ФС в клинической практике основано на их уникальном свойстве избирательно накапливаться в определенных тканях, в частности в опухолевой. В нашей работе использовали отечественный ФС — аминолевулиновую кислоту.
ФДТ применяют для лечения и профилактики рецидивов НИРМП, метод позволяет уменьшить вероятность рецидивирования РМП в среднем на 20%, как показали клинические исследования многих авторов [7, 8]. Принцип ФДТ основан на деструкции злокачественных новообразований вследствие особых фотохимических реакций, при которых образуются синглетный кислород, а также большое количество высокоактивных радикалов. Синглетный кислород и радикалы вызывают в клетках опухоли некроз и апоптоз (два варианта гибели клеток), развивающиеся при взаимодействии светового излучения определенных длин волн и ФС [8, 9].
Применение ФДТ в онкоурологии началось в 1976 г. с публикации Kelly, в которой отмечалось, что после внутривенного введения ФС гематопорфирина яркая красная флуоресценция детектировалась в CIS, дисплазиях и экзофитных опухолях мочевого пузыря и не детектировалась в нормальной слизистой и аваскулярных опухолях после лучевой терапии. В ходе исследования выявлено, что при размере опухоли до 1,5 см ее полная деструкция происходит в 66,7–74% случаев. Ученые показали возможность применения этого метода лечения и связь его результатов с величиной опухолевого очага [10].
ФДТ в комбинации с традиционными методами лечения применяют в качестве первичного противорецидивного лечения. ФДТ выполняется в специализированной операционной, оснащенной необходимым набором инструментов и оборудования, включая управляемый операционный стол, эндоскопическую стойку, стандартный цистоскоп с прямым рабочим каналом, лазерный аппарат, интегральный измеритель мощности, спектрально-флуоресцентное диагностическое устройство, световое волокно с прямым отражением света и фиброоптическое волокно с цилиндрическим диффузором.
Целью исследования явилась оценка эффективности ФДТ отечественной флуоресцентной видеосистемой в сочетании с ТУР при лечении больных НИРМП.
Материал и методы
Пациентам проводилось стандартное урологическое обследование: сбор анамнеза, физикальное обследование, лабораторные исследования, цитологический анализ мочи, цистоскопия, ультразвуковое исследование, экскреторная урография, КТ или МРТ. Диагноз РМП верифицировали гистологически.
Для ФДТ применяли аминолевулиновую кислоту, которую вводили пациентам в виде 3% раствора однократной внутрипузырной инстилляцией в объеме 50 мл, с продолжительностью экспозиции 1,5–2,0 ч (до проведения ТУР). Аминолевулиновая кислота — синтетический ФС, применяемый для ФДТ и флуоресцентной диагностики злокачественных опухолей, в виде порошка для приготовления раствора для приема внутрь и инстилляций, 1,5 г.
При ФДТ была использована отечественная флуоресцентная видеосистема производства ИОФ РАН (Москва), которая включает в себя: светодиодное видеофлуоресцентное устройство для проведения диагностики и ФДТ опухолей, лазерно-электронно-спектральную установку для флуоресцентной диагностики опухолей и контроля ФДТ и монитор.
Методика проведения исследования
На первом этапе проводили рутинное цистоскопическое исследование в белом свете. Оценивали состояние уротелия, выявляли наличие патологических участков и подозрительных на рак очагов. Затем проводили ФДД отечественной флуоресцентной видеосистемой, осуществляя поиск очагов зеленой флуоресценции.
На втором этапе исследования интраоперационно, без потери времени, измерялась интенсивность флуоресцентно-положительных (накопления ФС) областей (рис. 1). При этом оказалось, что флуоресценция злокачественных образований в среднем в 4 и более раз выше, чем флуоресцентно положительные доброкачественные изменения. Далее выполняли ТУР опухоли мочевого пузыря до глубокого мышечного слоя, а затем под визуальным контролем проводили локальное облучение зоны резекции и окружающих тканей лазером. Доза световой энергии составляла от 380 до 460 Дж/см2, мощность излучения — от 1 до 2 Вт, продолжительность облучения была от 15 до 32 мин и находилась в прямой зависимости от площади облучаемой поверхности, что, в свою очередь, определялось размером опухоли.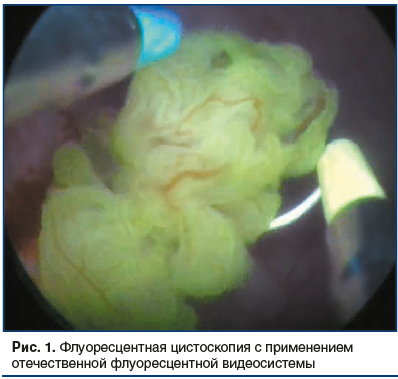
Контрольное обследование при НИРМП основано на регулярной цистоскопии, больным после операции каждые 3 мес. в течение года выполняли цистоскопию и ультразвуковое исследование мочевого пузыря для оценки эффективности лечения и выявления рецидивов РМП.
Результаты и обсуждение
Из 32 пациентов, включенных в группу исследования, у 22 пациентов всего было выявлено 52 участка слизистой, флуоресцирующих при ФДД и неизмененных в белом свете. Выполнена ТУР стенки мочевого пузыря всех выявленных участков, гистологическое заключение: воспалительные изменения уротелия — 32 (61,5%); переходно-клеточный рак — 11 (21,2%); CIS — 1 (1,9%); переходно-клеточная папиллома — 3 (5,8%); дисплазия уротелия — 2 (3,8%); неизмененная слизистая — 2 (3,8%); лейкоплакия — 1 (1,9%) участок.
Как следует из представленных данных, полученных при ФДД с использованием отечественной флуоресцентной видеосистемы, в 12 (23%) участках, пропущенных при стандартной цистоскопии в белом свете, было верифицировано 11 участков переходно-клеточного рака, и у одного пациента выявлена CIS. Таким образом, установлено, что метод ФДД с применением отечественной флуоресцентной видеосистемы обладает диагностической точностью на 23% большей, чем стандартная цистоскопия в белом свете.
При оценке метода ФДД критерием эффективности можно считать не только диагностическую чувствительность, отражающую количество дополнительно выявленных участков с гистологически подтвержденным РМП. Не менее важным критерием является количество больных, у которых дополнительно выявлен хотя бы один такой участок и, таким образом, предотвращено развитие рецидива [11]. Важно подчеркнуть, что у одного пациента рак был обнаружен только с помощью ФДД с применением отечественной флуоресцентной видеосистемы. Следовательно, данный метод обладает ценностью не только для определения патологических участков слизистой, подлежащих резекции, но и для диагностирования заболевания как такового. Проявлений системной токсичности ФДТ и ФС не отмечено. Пациенты, получившие комбинированное лечение ФДТ+ТУР, находились под наблюдением в течение года.
У 3 (9,4%) больных из 32 находившихся под наблюдением рецидивы РМП были выявлены при контрольных обследованиях на сроках 9 и 12 мес. после операции. Рецидивы опухолевого процесса после комбинированного лечения ФДТ+ТУР отмечены у пациентов с изначально множественными очагами опухоли.
Заключение
Исследование показало значительную разницу между радикальностью ТУР в сочетании с интраоперационной ФДТ и стандартной ТУР мочевого пузыря, которая говорит о целесообразности ФДТ, выполняемой с применением флуоресцентной видеосистемы вместе с ТУР при комбинированном лечении НИРМП. В течение 12 мес. после операции у 90,6% пациентов не выявлено рецидивов опухолевого процесса.
Таким образом, представленные результаты убедительно показывают большой потенциал флуоресцентных методов в диагностике и лечении НИРМП. C учетом малой выборки, с целью адекватной оценки методики ФДТ, возможностей отечественной флуоресцентной видеосистемы, клинико-экономических особенностей требуется продолжение исследований с привлечением большего числа пациентов для решения вопроса о внедрении метода в повседневную клиническую практику.
Литература
1. Ferlay J., Soerjomataram I., Ervik M. et al. Globocan 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. [Электронный ресурс]. URL: http://publications.iarc.fr/Databases/Iarc-Cancerbases/GLOBOCAN-2012-Estimated-Cancer-Incidence-Mortality-And-Prevalence-Worldwide-In-2012-V1.0–2012 (дата обращения: 09.10.2018).
2. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИРЦ» Минздрава России, 2017. 250 с. [Kaprin A.D., Starinskij V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2015 godu (zabolevaemost’ i smertnost’). M.: MNIOI im. P.A. Gercena — filial FGBU «NMIRC» Minzdrava Rossii, 2017. 250 s. (in Russian)].
3. Матвеев Б.П., Фигурин К.М., Карякин О.Б. Рак мочевого пузыря. М., 2001. 254 с. [Matveev B.P., Figurin K.M., Karyakin O.B. Rak mochevogo puzyrya. M., 2001. 254 s. (in Russian)].
4. Аль-Шукри С.Х., Кузьмин И.В., Слесаревская М.Н., Соколов А.В. Фотодинамическая тераностика: новый подход к диагностике и лечению поверхностного рака мочевого пузыря // Урологические ведомости. 2017. № 7 (1S). С.9–10 [Al’-SHukri S.H., Kuz’min I.V., Slesarevskaya M.N., Sokolov A.V. Fotodinamicheskaya teranostika: novyj podhod k diagnostike i lecheniyu poverhnostnogo raka mochevogo puzyrya // Urologicheskie vedomosti. 2017. № 7 (1S). S.9–10 (in Russian)].
5. Лоран О.Б., Велиев Е.И., Лукьянов И.В., Серегин А.В. Рак мочевого пузыря. Медфорум. 2017. 260 с. [Loran O.B., Veliev E.I., Luk’yanov I.V., Seregin A.V. Rak mochevogo puzyrya. Medforum. 2017. 260 s. (in Russian)].
6. Schubert T., Rausch S., Fahmy O. et al. Optical improvements in the diagnosis of bladder cancer: implications for clinical practice // Ther. adv. urol. 2017. Vol. 9(11). P.251–260.
7. Русаков И.Г., Быстров A.A. Хирургическое лечение, химио- и иммунотерапия больных поверхностным раком мочевого пузыря // Практическая онкология. 2003. № 4. С.214–224 [Rusakov I.G., Bystrov A.A. Hirurgicheskoe lechenie, himio- i immunoterapiya bol’nyh poverhnostnym rakom mochevogo puzyrya // Prakticheskaya onkologiya. 2003. № 4. S.214–224 (in Russian)].
8. Dougherty T.J., Gomer C., Henderson B. et al. Photodynamic therapy [Review] // J. Natl. Cancer Inst. 1998. Vol. 90(12). P.889–905.
9. Henderson B.W., Dougherty T.J. How does photodynam ic therapy work? // Photochem. Photobiol. 1992. Vol. 55. P.145–157.
10. Kelly J.F., Snell M.E., Berenbaum M.C. Photodynamic de struction of human bladder carcinoma // Br. J. Cancer. 1975. Vol. 31. P.237.
11. Чиссов В.И., Соколов В.В., Булгакова Н.Н. и др. Исследование лазер-индуцированной аутофлуоресценции нормального и неоплазированного уротелия in vivo // Российский онкологический журнал. 2007. № 6. С.18–24 [Chissov V.I., Sokolov V.V., Bulgakova N.N. i dr. Issledovanie lazer-inducirovannoj autofluorescencii normal’nogo i neoplazirovannogo uroteliya in vivo // Rossijskij onkologicheskij zhurnal. 2007. № 6. S.18–24 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru
