Содержание статьи
Введение
Нейрональные цероидные липофусцинозы (НЦЛ) представляют собой группу генетически детерминированных прогрессирующих нейродегенеративных заболеваний с преимущественно аутосомно-рецессивным типом наследования, обусловленных аномальным накоплением липофусцин-подобных веществ в клетках. НЦЛ характеризуются возраст-зависимым дебютом, преимущественным поражением ЦНС с развитием прогрессирующей миоклонус-эпилепсии, интеллектуальных и двигательных расстройств, а также поражением органа зрения. Липофусцин представляет собой зернистый желто-бурый аутофлуоресцентный пигмент, гликолипопротеид, состоящий из продуктов окисления полиненасыщенных жирных кислот, углеводной и белковой части и, как правило, содержащий металлы (ртуть, алюминий, медь, цинк). По современным представлениям, липофусцин — продукт лизосомальной дегенерации митохондрий и в норме постепенно накапливается в цитоплазме клетки в виде гранул, сконцентрированных вокруг ядра. Содержание липофусцина обычно выше в неделящихся или редко делящихся клетках (в нейронах, клетках сетчатки, ганглиоцитах, в сердечной и скелетной мышечной ткани, в меньшей степени в клетках печени, почек и сетчатой зоны коры надпочечников).
Классификация НЦЛ [1–5]
Существуют клиническая (фенотипическая) и генотипическая классификации НЦЛ.
Вначале появилась клиническая классификация, основанная на возрасте дебюта и связанных с ним особенностях течения заболевания:
Инфантильный фенотип (возраст дебюта 6–24 мес.).
Поздний инфантильный фенотип (возраст дебюта 2–3 года).
Ювенильный фенотип (возраст дебюта 5–7 лет).
Взрослый фенотип.
В настоящее время наиболее актуальна генетическая классификация. На сегодняшний день описано 14 генетических типов НЦЛ:
1-й тип («инфантильный» тип, болезнь Хагберга — Сантавуори);
2-й тип («поздний инфантильный» тип);
3-й тип («ювенильный классический» тип, болезнь Баттена, болезнь Шпильмейера — Фогта);
4-й тип («взрослый» тип, болезнь Куфса):
подтип А;
подтип В;
5-й тип («финский» вариант «позднего инфантильного» типа);
6-й тип («индийский»/«цыганский» вариант «позднего инфантильного» типа);
7-й тип («турецкий» вариант «позднего инфантильного» типа);
8-й тип («северная эпилепсия», прогрессирующая эпилепсия с умственной отсталостью);
9-й тип («ювенильная форма», выявлена в Германии и Сербии);
10-й тип («врожденный», катепсин-Д-дефицитный тип, тип Нормана — Вуда);
11-й тип («взрослый»);
12-й тип («ювенильная форма», синдром Куфор — Ракеб);
13-й тип («взрослый» тип, вариант болезни Куфса);
14-й тип («инфантильная прогрессирующая миоклоническая эпилепсия 3-го типа»).
Эпидемиология
Распространенность НЦЛ в мире составляет около 1:25 000. В европейской и североамериканской популяциях патология встречается с частотой 1:12 500.
Патогенез
Патогенез НЦЛ в большинстве случаев не вполне ясен. Известно, что при некоторых формах заболевания дефицит ферментов лизосом приводит к накоплению аутофлуоресцентного материала в тканях нервной системы и последующей гибели нейронов (именно поэтому НЦЛ можно рассматривать как лизосомальные заболевания), однако аномалии структурных белков с неизвестными функциями также участвуют в патогенезе. Кроме того, по-видимому, в патогенезе НЦЛ участвует нейроиммунное воспаление, связанное с поражением глии и дисфункцией микроглии [6, 7]. Основные неврологические проявления — эпилепсия, миоклонус и когнитивная деградация — отражают преимущественное поражение серого вещества головного мозга.
Клиническая картина
Для всех форм НЦЛ характерно неуклонно прогрессирующее течение с развитием деменции, утратой приобретенных навыков и прогрессирующей миоклонус-эпилепсией. Согласно клинической классификации для классической формы НЦЛ инфантильного типа характерен ранний дебют заболевания — в конце первого года жизни. Первыми симптомами заболевания являются задержка психомоторного развития ребенка и атаксия. В течение второго года жизни происходит быстрая утрата ранее приобретенных навыков, отмечаются миоклонические подергивания. На начальных этапах заболевания развивается диффузная мышечная гипотония, затем нарастает спастичность. Постепенно формируется аутистическое поведение в сочетании с аномальными стереотипными движениями кистей («движения вязальщицы»). К возрасту 24–36 мес. развивается грубая деменция, спастический тетрапарез. Летальный исход наступает через несколько лет от появления первых симптомов болезни.
Поздний инфантильный тип НЦЛ дебютирует чаще на третьем году жизни и характеризуется развитием прогрессирующей фармакорезистентной миоклонус-эпилепсии с потерей двигательных навыков и нарушением когнитивных функций, утратой зрения и ранней смертью (средняя продолжительность жизни 10–15 лет).
Ювенильный тип НЦЛ обычно дебютирует в возрасте 4–10 лет. Наиболее часто данная форма заболевания начинается с прогрессирующего ухудшения зрения, начинающегося с гемералопии и приводящего к резкому снижению остроты зрения вплоть до полной слепоты в течение 2–4 лет от начала заболевания. Изначально на первый план выступают нарушения поведения, что может привести к ошибочному установлению психиатрического диагноза. Через 2–3 года от начала заболевания присоединяются эпилептические приступы, наиболее часто — миоклонические. Особый тип дизартрии (подкорковая дизартрия) формируется к 10–15 годам. Паркинсоноподобные симптомы возникают на втором десятилетии жизни. Пирамидная и мозжечковая симптоматика выражена слабо и прогрессирует медленно. Течение заболевания прогрессирующее, продолжительность жизни 20–30 лет.
Диагностика
Нейрофизиологическое обследование
Нейрофизиологическое обследование включает электроэнцефалографию (ЭЭГ), электроретинографию (ЭРГ), а также исследование зрительных (ЗВП) и соматосенсорных вызванных потенциалов (ССВП).
Раннее изменение на ЭЭГ при НЦЛ 1-го типа — снижение реакции основного ритма на открывание-закрывание глаз, а также исчезновение сонных веретен при ночном мониторинге. В последующем постепенно нарастает депрессия основного ритма, вплоть до формирования изоэлектрической кривой на третьем году жизни. Для «поздних инфантильных форм» НЦЛ характерно появление спайков по задним отведениям в ответ на низкочастотную фотостимуляцию.
Дегенерация сетчатки приводит к снижению амплитуды ЭРГ при всех «детских» формах НЦЛ. При НЦЛ 1-го типа ЭРГ перестает регистрироваться на 1–4-м году жизни, ЗВП исчезают с 2–5 лет. Для НЦЛ 2-го типа характерно раннее затухание ЭРГ, однако гигантские ЗВП в ответ на стимуляцию вспышками света продолжают регистрироваться вплоть до терминальных стадий заболевания.
Нейровизуализация
Для НЦЛ характерны 4 основных признака по данным магнитно-резонансной томографии (МРТ): церебральная и церебеллярная атрофия; умеренная гиперинтенсивность белого вещества головного мозга и гипоинтенсивность таламусов на Т2-взвешенном изображении; истончение коры головного мозга. Однако нормальная картина МРТ не исключает НЦЛ [8].
Гистологическое и электронно-микроскопическое исследование
Указанные исследования используют, главным образом, для дифференциальной диагностики НЦЛ с другими нейродегенеративными заболеваниями. Материалом может служить биоптат кожи и/или конъюнктивы (или культура фибробластов), лимфоциты, мочевой осадок. При световой микроскопии лимфоцитов отличительной особенностью НЦЛ 3-го типа служит вакуолизация их цитоплазмы. Отсутствие этого признака, даже при типичной клинической картине НЦЛ «ювенильного» типа, требует исключения других типов заболеания (прежде всего, атипичного течения НЦЛ 1-го и 2-го типов). В то же время обнаружение вакуолизации цитоплазмы лимфоцитов позволяет сразу, без дополнительных методов обследования, переходить к прицельному молекулярно-генетическому исследованию на мутации в CLN3. При электронной микроскопии в цитоплазме клеток при всех типах НЦЛ обнаруживают специфические депозиты — цитосомы, представляющие собой скопления цероида.
Лечение [9–11]
На сегодняшний день применяют препараты, замедляющие дегенерацию нервных клеток и улучшающие течение НЦЛ. Выделяют пять основных терапевтических направлений:
субстрат-редуцирующая терапия;
антиапоптотическая терапия;
ферментзаместительная терапия;
генотерапия;
блокада нейроиммунного воспаления.
К препаратам для субстрат-редуцирующей терапии относят цистеамина битартрат (препарат не зарегистрирован в РФ) [12]. Этот препарат изначально применяли для лечения цистиноза, однако с 2001 г. известно его протективное действие при НЦЛ 1-го типа, в основе патогенеза которого лежит патологическое накопление цистеина в лизосомах вследствие дефицита фермента пальмитоил-протеинтиоэстеразы 1 (PPT1). Лучшие результаты были получены при комбинировании цистеамина битартрата с ацетилцистеином.
Флупиртин [13] — ненаркотический анальгетик центрального действия, оказывает антиапоптотическое, а также нейропротективное (за счет снижения синтеза церамидов) действие на клетки, в первую очередь при НЦЛ 3-го типа, в меньшей степени — при других типах НЦЛ [14].
Наиболее перспективно использование препаратов третьей и четвертой групп. В 2017 г. Управлением по контролю качества пищевых продуктов и лекарственных средств США был одобрен первый препарат для специ-фического лечения НЦЛ — церлипоназа альфа (препарат не зарегистрирован в РФ). Этот рекомбинантный ферментозаместительный препарат для лечения НЦЛ 2-го типа является проферментом. Препарат вводят интравентрикулярно через резервуар Оммайя в дозе 300 мг крайне медленно, каждые 2 нед. пожизненно. Среди побочных эффектов наиболее распространены лихорадка, нарушения сердечного ритма, рвота, судороги, головная боль, раздражительность. В связи с высоким риском аллергических реакций перед введением препарата рекомендовано применение антигистаминных средств (а по показаниям — и антипиретиков) либо глюкокортикостероидов за 30–60 мин до каждого введения препарата.
На сегодняшний день разрабатываются таргетные геномодифицирующие препараты на основе аденовируса человека 2-го и 5-го типов [14–16]. Кроме того, имеются данные об эффективности иммунодепрессанта микофенолата мофетила, клиническое испытание которого у пациентов с НЦЛ 3-го типа в настоящее время проводится в Университете Рочестера [11]. Предполагается, что его нейропротективное действие обусловлено блокированием иммунного поражения нервных клеток, которое отмечалось в патогенезе НЦЛ 3-го типа на моделях животных.
Неоднократные попытки терапии НЦЛ стволовыми клетками не увенчались успехом [8, 14].
Клиническое наблюдение
Пациент Г., 15 лет, поступил в стационар в связи с эпилептическим статусом. Из анамнеза известно: ребенок рожден от близкородственного брака. Родители и две сестры пациента здоровы. Родился в срок. Масса тела 3250 г, рост 52 см. Оценка по шкале Апгар 8/9 баллов. Выписан из роддома на 5-е сутки. До дебюта заболевания рос и развивался по возрасту. В возрасте 4 года 8 мес. во время ночного сна впервые в жизни возник судорожный приступ в виде адверсии головы и глаз вправо с отсутствием реакции на внешние раздражители, продолжительностью около 1 мин. Ребенок обследован в стационаре: при клиническом обследовании очаговая неврологическая симптоматика не выявлена, ЭЭГ без патологии. Выписан без противосудорожной терапии. В 5 лет во время бодрствования возник эпизод генерализованных тонико-клонических судорог с адверсией головы и глаз вправо. Повторно госпитализирован. При осмотре контактен, владеет навыками самообслуживания, поведение адекватное, речь не нарушена. Отмечается очаговая неврологическая симптоматика: ограничение отведения левого глазного яблока кнаружи, мышечный гипертонус и гиперрефлексия в правых конечностях, положительный симптом Бабинского с двух сторон. Глазное дно без патологии. Данные МРТ головного мозга: атрофические изменения коры больших полушарий, преимущественно в лобных областях, умеренно выраженная наружная гидроцефалия заместительного характера. Расширение большой цистерны мозга, сообщающейся с расширенным IV желудочком. Вариант аномалии Денди — Уокера. По данным ЭЭГ — задержка формирования корковой ритмики, очаг пароксизмальной активности (пики, комплексы «пик — медленная волна» 2,5–3 в 1 с) в проекции теменно-затылочной области левого полушария, с тенденцией к генерализации. Начата антиэпилептическая терапия вальпроевой кислотой из расчета 30 мг/кг/сут.
В течение последующих 3 мес., на фоне приема вальпроевой кислоты, судорожных приступов не отмечалось. Однако появились и стали доминировать речевые, когнитивные нарушения, вялость, заторможенность. По данным ЭЭГ — отрицательная динамика в виде преобладания пароксизмальной активности генерализованного характера (атипичные комплексы «пик — медленная волна» 2,5–3 в 1 с), с максимальной выраженностью в проекции теменно-затылочных областей; в некоторых записях обнаружен очаг в лобных отделах правого полушария со вторичной генерализацией. Пациент переведен на комбинированную терапию вальпроевой кислотой 30 мг/кг/сут и топираматом 5 мг/кг/сут.
Данные МРТ головного мозга в 5 лет: отмечается отрицательная динамика по сравнению с предыдущим исследованием в виде прогрессирования атрофических изменений коры головного мозга. Картина лейкоэнцефалопатии.
В возрасте 5 лет 9 мес. мальчик перестал говорить, усилилась атаксия, отмечено нарушение тазовых функций. Появились миоклонические приступы. Консультирован в медико-генетическом центре Санкт-Петербурга — характер генетической патологии не установлен. В 6 лет 2 мес. ребенок вновь находился на обследовании в стационаре: выявлены высокие глубокие рефлексы, клонусы стоп, интенционный тремор, шаткая походка, атетоидные движения в руках, миоклонии. Офтальмологом впервые диагностирована частичная атрофия дисков зрительных нервов. По данным ЭЭГ выявлены билатеральные очаги эпилептиформной активности в лобных отделах. Данные МРТ головного мозга без существенной динамики.
В возрасте 6,5 года был госпитализирован в стационар в связи с ухудшением состояния. Появились выраженная вялость, заторможенность, гиперсомния (сон по 15–16 ч в сутки), ухудшилась речь (дизартрия), возникли поперхивания пищей, ребенок перестал жевать. Стал плохо понимать обращенную к нему речь. Самостоятельно не ходил, только с поддержкой, наблюдались выраженная диффузная мышечная гипотония, атаксия. Перестал контролировать тазовые функции. По данным ЭЭГ — грубые диффузные изменения преимущественно в передних отведениях, мультифокальная эпилептиформная активность с вторичной билатеральной синхронизацией (с индексом >80%). Отмечена высокая фотосенситивность при стимуляции низкими частотами (до 12 Гц). Заподозрено нейродегенеративное заболевание. На протяжении последующих 4 лет обследование ребенка было направлено на поиск наследственных болезней обмена веществ: данных за наследственные аминоацидопатии, органические ацидурии и дефекты митохондриального β-окисления не выявлено. Трижды определяли содержание лактата в крови — уровень был нормальный или умеренно повышенный, а также креатинфосфокиназы и белка S-100 — содержание в пределах допустимых значений. При этом по данным электронейромиографии зарегистрирован миопатический паттерн. Исключены наиболее частые митохондриальные заболевания — синдромы MELAS, MERRF и NARP: отклонений от нормы при исследовании митохондриальной ДНК не обнаружено. В 7 лет проведено обследование для исключения болезни Унферрихта — Лундборга: экспансия повторов в гене CSTB не выявлена. Однако полностью диагноз не исключили в связи с вероятными точечными мутациями в гене CSTB. Ген EPM2A проанализирован методом прямого секвенирования в 1, 2, 3, 4 экзонах — патогенных мутаций не выявлено, что исключило болезнь Лафоры. Проведена энзимодиагностика на предмет Gm2-ганглиозидозов: патология не выявлена. При исследовании скелетной мышцы для исключения митохондриальной патологии и болезни Лафоры типичные маркеры предполагаемых заболеваний не были обнаружены, однако в биоптате отмечены включения, похожие на липофусцин. Проведено обследование на НЦЛ. Вакуолизация лимфоцитов в мазке крови не выявлена. Уровень ферментов РРТ1 и трипептидилпептидазы 1 (ТРР1) не снижен, частые мутации гена CLN2/TPP1 не выявлены. Было проведено полное секвенирование гена CLN5, диагноз «НЦЛ 5-го типа» не подтвержден. При электронной микроскопии биоптата кожи обнаружены специфические изменения, характерные для НЦЛ 6-го и 7-го типов, однако с помощью стандартных панелей ответственный ген так и не был установлен.
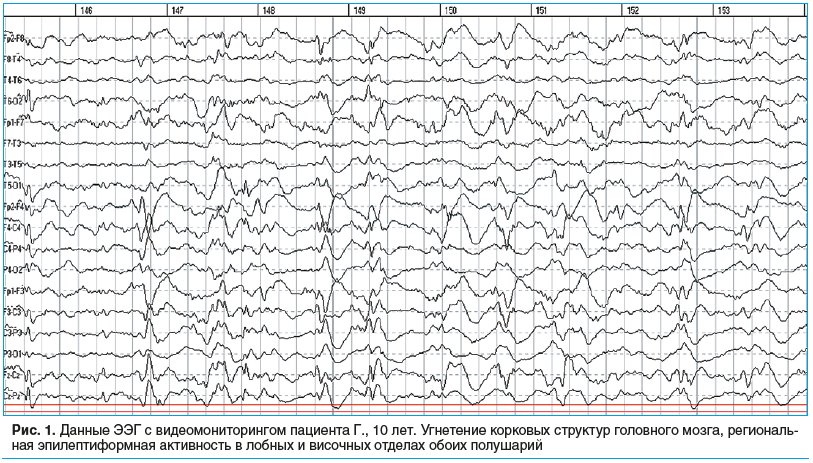
В динамике отмечалось прогрессирующее ухудшение состояния пациента. Ребенок полностью потерял зрение, перестал сидеть и ходить, себя не обслуживал. Сохранялись резистентные тонико-клонические и миоклонические судорожные приступы. По данным ЭЭГ, в динамике отмечалось прогрессирующее угнетение корковых структур головного мозга, на фоне чего постепенно снижался индекс патологической активности, с сохранением регионарной эпилептиформной активности в лобных и височных отделах обоих полушарий (рис. 1).
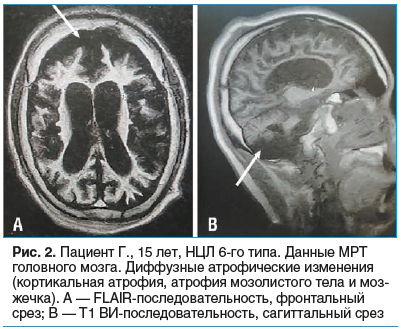
Пациент впервые поступил в наш стационар в возрасте 15 лет. Общее состояние тяжелое. Продуктивному контакту не доступен. Положение глазных яблок с фиксацией вверх. Взгляд не фиксирует. На лица и голос не реагирует. Зрачки D=S, фотореакция положительная с двух сторон. Лицо гипомимично. Псевдобульбарный синдром. Получает питание через гастростому. Дышит через трахеостому. Полный регресс навыков: не стоит, не сидит, не говорит, обращенную к нему речь не понимает. Постоянные миоклонические подергивания мыщц лица, конечностей, усиливающиеся при пассивных движениях. Спастический тетрапарез, грубее в нижних конечностях. Выраженный кифосколиоз. Контрактуры сгибательно-приводящего типа в конечностях. Спонтанные клонусы стоп. Тазовые функции не контролирует. По результатам офтальмологического осмотра — полная атрофия зрительных нервов. По данным МРТ головного мозга — диффузное нарастание атрофических изменений (кортикальная атрофия, атрофия мозжечка, мозолистого тела) (рис. 2).
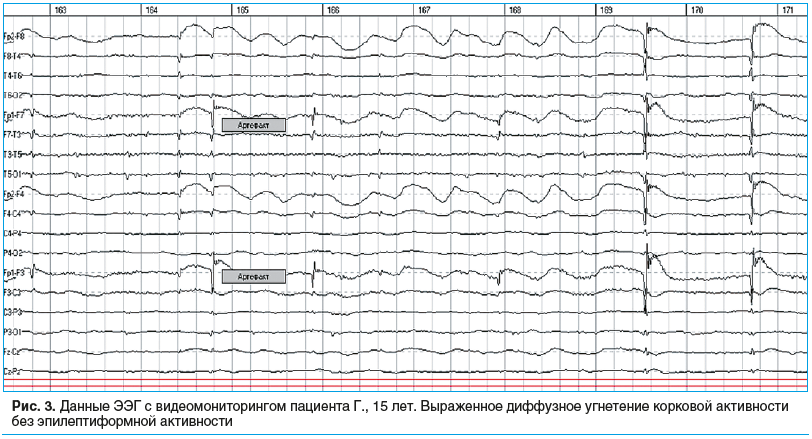
По данным ЭЭГ — выраженное диффузное угнетение корковой активности без эпилептиформной активности (рис. 3).
Повторно проведена мышечная биопсия: выявлены признаки лизосомной болезни накопления (гликогеноз?). С целью поиска нозологической формы проведено полноэкзомное секвенирование на секвенаторе нового поколения HiSeq (Illumina, США) методом парно-концевых чтений (2×150 п.о.) со средним покрытием целевых регионов 70×. Выявлены мутации в генах PGAM2, CLN6 , SEMA6B, PHKA2, KIF5A с неизвестным клиническим значением. Ген PGAM2 (MIM612931) (гетерозиготная мутация) кодирует фосфоглицерат мутазу 2 [17]. Мутация этого гена клинически проявляется болями и судорогами в мышцах, повышением уровня креатининфосфокиназы, манифестирует у взрослых. При отсутствии клинических признаков этот вариант является бессимптомным носительством. Ген PHKA2 (MIM300798) (гемизиготная мутация) кодирует α-субъединицу киназы фосфорилазы [17, 18]. Мутация клинически проявляется гепатомегалией, задержкой роста, гипогликемией, дисфункцией печени. Ген SEMA6B (MIM608873) (гетерозиготная мутация) кодирует sema-домен, трансмембранный домен и цитоплазматический домен (семафорин) 6B [18, 19]. Изменения этого гена ассоциированы с развитием прогрессирующей миоклонической эпилепсии 11-го типа (MIM618876) с аутосомно-доминантным типом наследования, а выявленный вариант c.2638delG по совокупности сведений следует расценивать как вероятно патогенный. Для повреждения этого гена характерна манифестация заболевания в 2 года после периода нормального развития, прогредиентное течение, множественные изменения по данным ЭЭГ, спастичность, пирамидные/экстрапирамидные нарушения, тремор, атаксия, тонико-клонические судороги. Требуется молекулярно-генетическое обследование семьи с целью определения наследования выявленного варианта. Ген KIF5A (MIM602821) (гетерозиготная мутация) кодирует белок семейства кинезинов [18, 19]. Клиническая картина при его мутации варьирует в зависимости от возраста манифестации: от миоклоний, прогрессирующей лейкоэнцефалопатии, апноэ после рождения, спастической параплегии, напоминающей течение болезни Шарко — Мари — Тута 2-го типа в старшем возрасте, до прогрессирующей мышечной слабости с нарушением функции дыхания у взрослых. Ген CLN6 (MIM606725) (гомозиготная мутация) кодирует бета-уреидопропионазу, которая катализирует последнюю стадию пути деградации пиримидина [17, 18]. Изменения в данном гене ассоциированы с цероидным липофусцинозом (MIM601780, 204300) с аутосомно-рецессивным типом наследования. Выявленный вариант c.666-1G>C по совокупности сведений следует расценивать как вероятно патогенный. Клинически характерна манифестация в возрасте 5 лет, атаксия, миоклонии, снижение когнитивных функций, аномальные движения глаз, судороги, ухудшение зрения, атрофия зрительного нерва, атрофические изменения головного мозга, пирамидные/экстрапирамидные нарушения.
С учетом клинико-анамнестических данных, а также результатов проведенной ранее электронной микроскопии биоптата кожи у пациента диагностирован НЦЛ 6-го типа.
Заключение
С учетом разработки таргетной терапии НЦЛ своевременная и точная диагностика генетического типа заболевания с выявлением мутации «ответственного» гена на сегодняшний день приобретает не только научное, но и клиническое значение. На наш взгляд, наиболее целесо-образно при подозрении на НЦЛ проведение полноэкзомного секвенирования, минуя стадию использования панелей наиболее частых мутаций. В противном случае можно легко пропустить значительное количество редких мутаций, что приведет не только к удорожанию обследования, но и к поздней диагностике заболевания, как было в представленном клиническом наблюдении. Кроме того, следует отметить, что в связи с ежегодным обновлением базы данных необходимо возвращаться к обследованию пациентов с неуточненными состояниями и продолжать поиск причины заболевания.
Информация с rmj.ru
