Урология
Материал и методы: в рамках пилотного исследования проведен сравнительный анализ патоморфологических изменений в препаратах удаленных предстательных желез больных раком предстательной железы. Больным основной группы (n=18) проводили сеансы неинвазивного электрохимического лизиса, в последующем выполняли радикальную простатэктомию. Больным контрольной группы (n=18) была выполнена радикальная простатэктомия. Сеансы электрохимического лизиса больным основной группы проводили на терапевтической установке BET-7 с помощью накожных пластинчатых электродов. Было проведено от 3-х до 5 сеансов электрохимического лизиса, длительностью не более 180 мин. Сила тока не превышала 40 мА, его напряжение составляло 5‒20 В.
Результаты: при макроскопической оценке удаленных предстательных желез у 27,8% больных основной группы выявлены очаговые кровоизлияния, у 61,1% больных – зоны размягчения. В контрольной группе макроскопические изменения представлены очаговыми кровоизлияниями у 11,1% больных (p
Выводы: метод электрохимического лизиса оказывает избирательное повреждение раковой опухоли предстательной железы.
Ключевые слова: рак предстательной железы, электрохимический лизис, морфологическое исследование, деструкция опухолевой ткани, дистрофия, склероз.
Для цитирования: Вельшер Л.З., Пушкарь Д.Ю., Стаханов М.Л., Горчак Ю.Ю., Аниканова Е.В., Андреева О.В., Фирсов К.А., Ишевский Г.Б. Морфологические результаты применения метода электрохимического лизиса у больных раком предстательной железы // РМЖ. 2017. №27. С. 2026-2031
Velsher L.Z.1 , Pushkar D.Yu.1, Stakhanov M.L.1,2, Gorchak Yu.Yu.1, Anikanova E.V.1, Andreeva O.V.3, Firsov K.A.1, Ishevskiy G.B.1,2
1 Moscow State Medical Stomatological University named after A.I.Evdokimov
2 Cancer Center at the Central clinical hospital No. 2 named after N.A. Semashko of Russian Railways, Moscow
3 Smolensk Regional Institute of Pathology
The aim of the study was to evaluate the pathomorphological changes in the prostate tissues and the tumor tissue contained in it, resulting from electrochemical lysis.
Patients and methods. A pilot study was carried out to compare the pathomorphological changes in preparations of the removed prostate glands of patients with prostate cancer. Patients of the main group (n = 18) received non-invasive electrochemical lysis sessions, followed by radical prostatectomy. Patients of the control group (n = 18) underwent radical prostatectomy. Sessions of electrochemical lysis for the patients of the main group were performed using a device BET-7 with cutaneous plate electrodes. Patients received 3-5 sessions of electrochemical lysis, lasting for less than 180 minutes. The current strength was not more than 40 mA, the voltage was 5–20 V.
Results. The macroscopic examination of the removed prostate glands revealed focal hemorrhages in 27.8% of the patients and softening regions in 61.1% of patients in the main group. In the control group 11.1% of the patients had focal hemorrhages at macroscopic examination (р<0,05). 38.9% of patients of the first group had areas of total destruction of the tumor, 72,2% of the patients had degenerative changes in the stroma of the tumor, 61.1% of patients had degenerative changes in the parenchyma of the tumor, 50% of the patients had focal proliferation of connective tissue. 33.4% of patients had similar changes in regional lymph nodes. Morphological changes were focal and were not detected in prostate tissue outside the tumor growth. The morphological changes described were not found in patients of the control group, with the exception of connective tissue proliferation in the tumor in 11.3% of patients (p <0.05).
Conclusions. Method of electrochemical lysis causes selective damage to prostate cancer.
Key words: prostate cancer, electrochemical lysis, morphological study, destruction of tumor tissue, dystrophy, sclerosis.
For citation: Velsher L.Z., Pushkar D.Yu., Stakhanov M.L. et al. Morphological results of electrochemical lysis in patients with prostate cancer. // RMJ. 2017. № 27. P.2026 –2031.
В статье представлены морфологические результаты применения метода электрохимического лизиса у больных раком предстательной железы. Показано, что метод электрохимического лизиса оказывает избирательное повреждение раковой опухоли предстательной железы
Введение
В последние десятилетия в онкоурологической практике большое внимание уделяют разработке и внедрению альтернативных методов лечения больных, основанных на применении различных физических факторов. К таким методам относят криотерапию, радиочастотную и ультразвуковую абляцию, лазерную интерстициальную и фотодинамическую терапию. К их числу по праву можно отнести и метод электрохимического лизиса, в основе действия которого лежит повреждение клеток опухоли вследствие химических реакций, возникающих в процессе локального воздействия электрического тока низкой интенсивности [1].
На текущий период времени в отечественной и зарубежной медицинской литературе представлено значительное количество исследований, посвященных экспериментальному и клиническому применению метода электрохимического лизиса в лечении больных доброкачественными и злокачественными новообразованиями различных локализаций [2–9]. Результаты всех исследований, включая наше собственное [10], убедительно демонстрируют клиническую эффективность метода. Морфологические же изменения, возникающие в тканях в результате электрохимического воздействия, описаны лишь на примере узлового коллоидного зоба щитовидной железы, метастазов колоректального рака, доброкачественных образований молочных желез и представлены в единичных работах [11–13]. Изучив литературу, посвященную применению метода электрохимического лизиса, мы не встретили работ, описывающих морфологические изменения в тканях предстательной железы, подвергнутых электрохимическому воздействию.
Цель работы: в ходе клинико-морфологического исследования определить характер и выраженность морфологических изменений ткани предстательной железы и содержащейся в ней опухолевой ткани, возникающих вследствие электрохимического воздействия.
Материал и методы
Проведение настоящего пилотного исследования было одобрено Межвузовским комитетом по этике МГМСУ им. А.И. Евдокимова. Работа выполнена на базе отделений онкоурологии и патоморфологии Онкологического центра ОАО РЖД НУЗ «ЦКБ № 2 им. Н.А. Семашко», а также Смоленского областного института патологии.
Основную группу составили больные (n=18) с морфологически верифицированным локализованным раком предстательной железы (РПЖ), которым перед радикальной простатэктомией проводили сеансы неинвазивного электрохимического лизиса. Обострение сопутствующей патологии, потребовавшее коррекции, не позволило провести этим больным хирургическое лечение сразу после установления диагноза злокачественного новообразования. На время коррекции сопутствующей патологии в качестве дополнительного лечения им были проведены сеансы неинвазивного электрохимического лизиса. Контрольную группу составили больные (n=18) РПЖ, которым была проведена только открытая позадилонная радикальная простатэктомия.
Основная и контрольная группы больных статистически значимо не отличались по всем исследуемым характеристикам (табл. 1).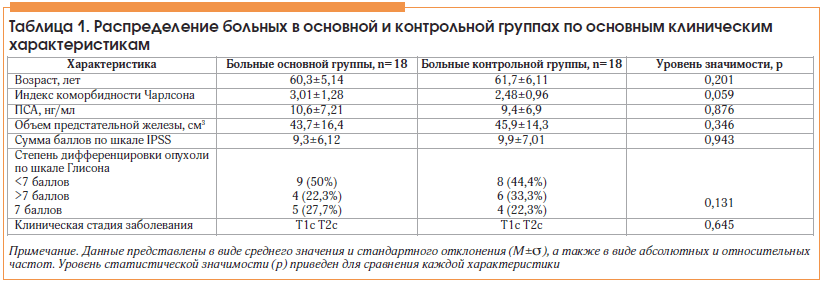
Сеансы электрохимического лизиса проводили на терапевтической установке BET-7 (Horst Poduchka, Германия) (рис. 1) с помощью накожных пластинчатых электродов. Длительность воздействия за 1 сеанс составляла 120–180 мин. Напряжение электрического тока в течение сеанса варьировало от 5 до 20 В, а сила тока не превышала 40 мА, что соответствовало рекомендациям компании-производителя. Каждому больному проведено от 1 до 3-х лечебных сеансов в зависимости от индивидуальных показаний. Интервал между лечебными сеансами составлял от 2-х до 4-х нед. После нормализации соматического статуса больным основной группы была выполнена открытая позадилонная радикальная простатэктомия в сроки от 5 дней до 3-х нед. после последнего сеанса лечения. 
Операционный материал без предварительной фиксации доставляли в патоморфологическое отделение в течение 1–2 часов с момента удаления. После его макроскопической оценки проводили унифицированный забор фрагментов операционного материала для гистологического исследования: по два фрагмента опухоли объемом около 125 мм2 и не пораженных опухолью участков предстательной железы. Отобранные фрагменты фиксировали в 10% растворе нейтрального формалина и подвергали стандартной гистологической проводке и заливке в парафин. Из полученных парафиновых блоков приготавливали срезы толщиной 5–7 мкм и окрашивали их гематоксилином и эозином. Микроскопическое исследование проводили световым бинокулярным микроскопом при общем увеличении ×100, ×200, ×400.
Статистический анализ полученных результатов проводили с помощью пакета прикладных статистических программ Statistica V.6.0 и 7.0 (StatSof, USA). Для представления данных в настоящем исследовании мы применяли абсолютные и относительные частоты. Для исследования значимости взаимосвязи между признаками применяли точный критерий Фишера для таблиц сопряженности 2×2 для бинарных признаков. Уровень значимости полагали равным 0,05.
Результаты исследования
Результаты макроскопического исследования удаленных предстательных желез больных основной и контрольной групп представлены в таблице 2. 
При макроскопическом исследовании предстательных желез больных, подвергнутых электрохимическому воздействию, в 5 (27,8%) наблюдениях из 18 в опухолевой ткани были выявлены очаги кровоизлияний, в то время как в контрольной группе очаговые кровоизлияния в опухолевой ткани простаты были обнаружены в 2-х (11,1%) наблюдениях из 18 (p
Патоморфологические изменения опухолевой ткани простаты после электрохимического воздействия на светооптическом уровне носили очаговый характер и в целом были однотипны, имели разную степень выраженности того или иного признака. Описания выявленных при микроскопическом исследовании патоморфологических изменений опухолевой ткани простаты приведены в таблице 3.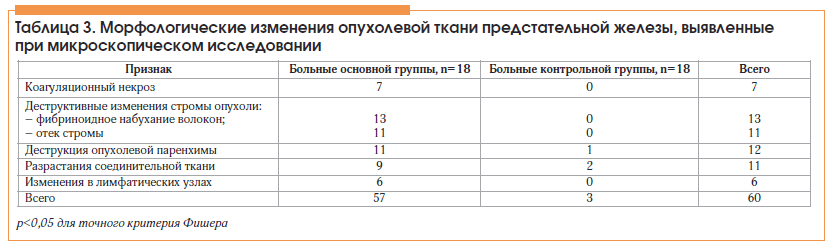
В группе больных, получавших сеансы неинвазивного электрохимического лизиса, в 7 (38,9%) наблюдениях из 18 были обнаружены зоны тотальной деструкции опухолевой ткани, представленные бесструктурными, эозинофильно окрашенными массами, среди которых местами были видны вытянутые клеточные фрагменты. Выявленные изменения соответствовали коагуляционному некрозу. Некроз, как правило, был очаговым в виде небольших полей или микрофокусов (рис. 2). Признаки воспаления на границе очагов некроза и неизмененных тканей не были выраженными. Ни в одном из изученных препаратов удаленных предстательных желез больных контрольной группы подобных изменений нами не обнаружено (р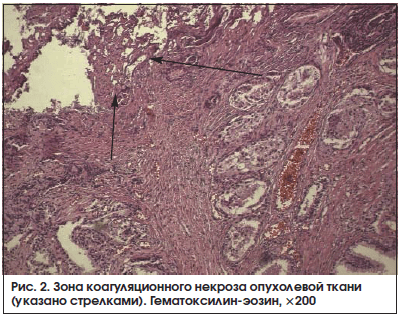
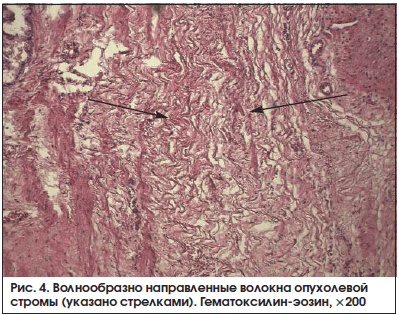
В 13 (72,2%) из 18 образцов, принадлежащих больным основной группы, мы зарегистрировали участки повреждения соединительной ткани в опухоли по типу фибриноидного набухания волокон стромы и стенки сосудов (рис. 3). Пучки соединительной ткани в данных полях зрения были неравномерно эозинофильно прокрашены, клетки стромы либо не определялись, либо были представлены в виде «теней». Нередко, в 11 (61,1%) наблюдениях из 18, выявлен отек стромы, островки ее разрыхления, местами с формированием оптически пустых пространств между волокнами. Также обнаружены волнообразно ориентированные пучки опухолевой стромы (рис. 4). Ни в одном из исследуемых морфологических препаратов железы больных контрольной группы описанные морфологические изменения опухолевой стромы не были выявлены (р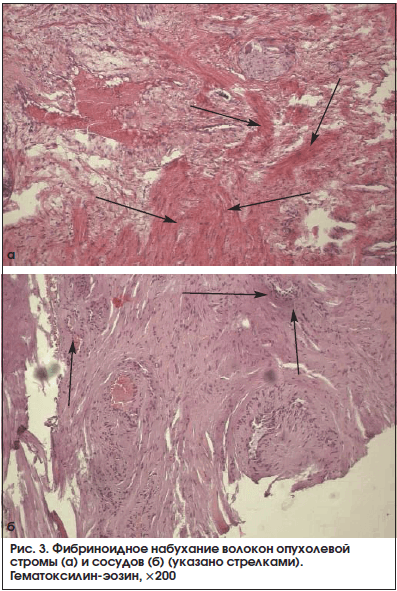
При обзорной микроскопии в 11 (61,1%) наблюдениях из 18 были зарегистрированы изменения паренхимы опухоли. Они были локализованы в зонах выраженной стромальной деструкции. Эпителиальная выстилка опухолевых желез была представлена вытянутыми клетками, сохраняющими гиперхромность ядер (рис. 5). В других полях зрения опухолевые клетки были набухшие, без четких границ, с более светлыми ядрами. Нередко измененные клетки опухоли имели вид «голых ядер». Также мы выявляли участки, где описанные выше варианты деструктивных изменений опухолевых клеток сочетались и дополнялись явлениями их десквамации разной степени выраженности. Следует отметить, что описанные повреждения мы регистрировали именно в опухолевой ткани и не обнаруживали вне зон опухолевого роста. В одном (5,6%) наблюдении из 18 в исследованных препаратах желез больных контрольной группы были представлены изменения паренхимы опухоли в виде десквамации отдельных визуально неизмененных опухолевых клеток. Отличия между группами больных по частоте встречаемости признака были статистически значимыми (р
Очаговые разрастания соединительной ткани, разделяющей опухолевые железы на островки разных размеров, были обнаружены нами в 9 (50%) наблюдениях из 18 в основной группе больных. Соединительную ткань разной степени зрелости чаще всего мы определяли по периферии зон коагуляционного некроза и выраженных дистрофических изменений (рис. 6). Иногда среди фиброзной ткани мы обнаруживали разрозненные мелкие опухолевые железы с дистрофией и десквамацией выстилающих их атипичных клеток. Лишь в 2-х (11,3%) из 18 препаратов желез больных контрольной группы мы обнаружили единичные небольшие, хаотично расположенные островки склероза раковой опухоли. При этом число наблюдений данного признака у больных основной и контрольной групп различалось статистически значимо (р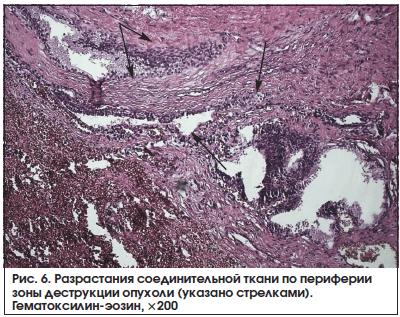
У 6 (33,4%) из 18 больных основной группы при исследовании операционного материала были обнаружены однотипные изменения в регионарных лимфатических узлах, где на фоне атрофии лимфоидной ткани отмечено фибриноидное набухание соединительной ткани системы трабекул (рис. 7). Подобные морфологические изменения регионарных лимфатических узлов у больных контрольной группы не обнаружены.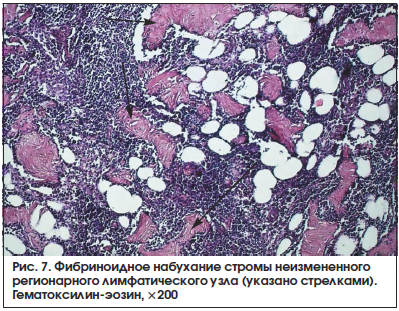
На основании статистического анализа мы с уверенностью можем утверждать, что выявленные в нашем исследовании патоморфологические изменения паренхимы и стромы опухолевой ткани простаты, а также регионарных лимфатических узлов были вызваны электрохимическим воздействием.
Обсуждение
Описанные в работах патоморфологические изменения опухолевых тканей, подвергнутых электрохимическому воздействию, как правило, представлены различной степени выраженности дистрофическими изменениями паренхимы и стромы опухоли. Другие описанные изменения, специфичные для электрохимического воздействия, представлены участками колликвационного и коагуляционного некрозов.
Так, в своем исследовании А.В. Борсуков и соавт. [11] описали развитие некротических изменений в метастатических узлах печени, возникшие в результате электрохимического воздействия в течение 20–45 мин. Несколькими годами позднее, А.В. Борсуков и соавт. [14] представили результаты экспериментального исследования, в котором вызывали некротические изменения тканей гепатоцеллюлярного рака крыс. По результатам морфологического исследования опухолевой ткани, выполненного через месяц после электрохимического воздействия, в участках ранее определявшихся очагов некроза было обнаружено разрастание соединительной ткани с элементами лимфоцитарной инфильтрации.
С.Н. Щаева и соавт. [12] в своем исследовании описали морфологические изменения тканей удаленных доброкачественных опухолей молочных желез женщин, подвергнутых электрохимическому воздействию ex vivo. Для оценки патоморфологических изменений тканей авторы применяли гистологическую классификацию выраженности лечебного патоморфоза опухоли, предложенную Е.Ф. Лушниковым. Согласно представленным результатам, к патоморфозу I степени авторы относили умеренно выраженные очаговые дистрофические изменения опухолевой стромы. При II степени патоморфоза отмечали нарастание дистрофических изменений в виде образования гигантских клеток, вакуолизации ядер и цитоплазмы. Морфологические изменения, представленные глубокими дистрофиями в паренхиме и строме, а также определявшиеся очаговые некрозы авторы относили к патоморфозу опухолевой ткани III степени. Обширные участки некроза с отсутствием клеток опухоли были отнесены к IV степени патоморфоза опухолевой ткани.
В своем исследовании Ю.В. Иванов и соавт. [13] проводили морфологическое изучение тканей узлового коллоидного зоба щитовидной железы животных и установили, что в результате электрохимического воздействия в тканях коллоидного зоба происходит развитие некротических изменений, имеющих четкую границу с неизмененными тканями щитовидной железы. В последующем авторы наблюдали развитие демаркационного воспаления вокруг участков некроза, которое завершалось формированием зрелой соединительной ткани. Аналогичные результаты получены А.В. Борсуковым и соавт. [15, 16]. При этом авторы описали два альтернативных пути гибели клеток вследствие электрохимического лизиса: непосредственное некротическое поражение и отсроченную апоптозную гибель.
Выявленные в нашем исследовании патоморфологические изменения опухолевой ткани простаты в целом аналогичны изменениям, описанным в других работах. Патоморфологические изменения были представлены дистрофическими и склеротическими изменениями паренхимы и стромы опухоли различной степени выраженности. Важным характерным признаком электрохимического воздействия являются так называемые «электрометки», представленные волнообразно направленными волокнами стромы, зонами коагуляционного некроза с фрагментами своеобразно вытянутых клеток, а также вытянутыми и вертикально ориентированными атипичными клетками, выстилающими опухолевые железы. Другой характерный признак воздействия электрического тока – зоны колликвации в виде отека и разволокнения стромы, набухания атипичных клеток. В целом выявленные нами изменения свидетельствуют об умеренной и глубокой деструкции опухоли, закономерным исходом которой является разрастание соединительной ткани с последующим формированием соединительнотканного рубца.
Важное отличие нашего исследования от других работ в том, что электрохимическое воздействие мы проводили с помощью накожных, а не игольчатых электродов, которые имплантируют непосредственно в ткани органа или опухолевый узел. Применяя накожные пластинчатые электроды, мы получили аналогичные патоморфологические изменения при использовании неинвазивной и безопасной методики.
Таким образом, в результате проведенного исследования нам удалось выявить патоморфологические изменения опухолевой ткани простаты, возникающие вследствие электрохимического воздействия, и установить их очаговый характер. При этом мы не выявили каких-либо патологических изменений ткани предстательной железы вне зон опухолевого роста, что свидетельствует об избирательном воздействии слабого постоянного тока на ткани опухоли простаты без заметного повреждающего воздействия на ткани других участков предстательной железы.
Выводы
Согласно результатам патоморфологического исследования применение неинвазивного электрохимического лизиса оказывает избирательное повреждение раковой опухоли предстательной железы.
Литература
1. Nordenstrom B.E.W. Electrochemical treatment of cancer // Ann Radiology. 1985. Vol. 28. P. 128–129.
2. Xin Y. Advances in the treatment of malignant tumors by electrochemical therapy (ECT) // Eur J Surg Suppl. 1994. Vol. 574. P. 31–35.
3. Teague B., Wemyss-Holden A., Fosh B. et al. Electrolysis and other local ablative treatments for non-resectable colorectal liver metastases // ANZ J Surg. 2002. Vol. 72(2). P. 137–141.
4. Tang B., Li L., Jiang Z. et al. Characterization of the mechanisms of electrochemotherapy in an in vitro model for human cervical cancer // Int. J. Oncol. 2005. Vol. 26. P. 703–711.
5. Матвеев Н., Сергеева О., Вередченко А. и др. Электрохимический лизис в эксперименте и в сравнении с радиочастотной абляцией при лечении злокачественных новообразований в печени // Эндоскопическая хирургия. 2009. № 15(2). С.19–27 [Matveev N., Sergeeva O., Veredchenko A. i dr. Jelektrohimicheskij lizis v jeksperimente i v sravnenii s radiochastotnoj abljaciej pri lechenii zlokachestvennyh novoobrazovanij v pecheni // Jendoskopicheskaja hirurgija. 2009. №15(2). S.19–27 (in Russian)].
6. Жуковец А. Электрохимический лизис опухолей // Онкологический журнал. 2011. №5(3). С.97–98 [Zhukovec A. Jelektrohimicheskij lizis opuholej // Onkologicheskij zhurnal. 2011. №5(3). S.97–98 (in Russian)].
7. Топольницкий О., Гришин А., Трофимов А. Особенности технологии электрохимического лизиса в комплексном лечении венозных и артерио-венозных мальформаций челюстно-лицевой области у детей // Креативная онкология и хирургия. 2011. URL: http://eoncosurg.com (23.12.2016) [Topol’nickij O., Grishin A., Trofimov A. Osobennosti tehnologii jelektrohimicheskogo lizisa v kompleksnom lechenii venoznyh i arterio-venznyh mal’formacij cheljustno-licevoj oblasti u detej // Kreativnaja onkologija i hirurgija. 2011. URL: http://eoncosurg.com (23.12.2016) (in Russian)].
8. Belyy Y., Tereshchenko A., Shatskih A. Clinical procedure for intraocular electrochemical lysis during endoresection // Ecancermedicalscience. 2013. Vol. 20 (7). P. 326–330.
9. Михайловская А., Каплан М. Сочетанный метод фотодинамической терапии и электрохимического лизиса // Радиация и риск. 2014. №23 (2). С.28–36 [Mihajlovskaja A., Kaplan M. Sochetannyj metod fotodinamicheskoj terapii i jelektrohimicheskogo lizisa // Radiacija i risk. 2014. №23(2). S.28–36 (in Russian)].
10. Вельшер Л., Стаханов М., Калинин М. и др. Электрохимический лизис в лечении больных раком предстательной железы // Онкология. Журнал им. П.А. Герцена. 2016. №3. C.33–38 [Vel’sher L., Stahanov M., Kalinin M., i dr. Jelektrohimicheskij lizis v lechenii bol’nyh rakom predstatel’noj zhelezy // Onkologija. Zhurnal im. P.A. Gercena. 2016. №3. C.33–38 (in Russian)].
11. Борсуков А., Бельков А., Власов А. и др. Электрохимический лизис единичных метастазов в печени: результаты двухлетнего клинического наблюдения // Анналы хирургической гепатологии. 2005. № 10(2). С.21–29 [Borsukov A., Bel’kov A., Vlasov A., i dr. Jelektrohimicheskij lizis edinichnyh metastazov v pecheni: rezul’taty dvuhletnego klinicheskogo nabljudenija // Annaly hirurgicheskoj gepatologii. 2005. №10(2). S.21–29 (in Russian)].
12. Щаева С., Соловьев В., Борсуков А. Электрохимический лизис очаговых доброкачественных опухолей молочной железы: возможности малоинвазивного локального лечения // Паллиативная медицина и реабилитация. 2006. №4. С.12–18 [Shhaeva S., Solov’ev V., Borsukov A. Jelektrohimicheskij lizis ochagovyh dobrokachestvennyh opuholej molochnoj zhelezy: vozmozhnosti maloinvazivnogo lokal’nogo lechenija // Palliativnaja medicina i reabilitacija. 2006. №4. S.12–18 (in Russian)].
13. Иванов Ю., Попов Д., Соловьев Н., Злобин А. Первые результаты применения в эксперименте методики электрохимического лизиса в хирургической эндокринологии // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. 2010. №5(2). C.18–23 [Ivanov Ju., Popov D., Solov’ev N., Zlobin A. Pervye rezul’taty primenenija v jeksperimente metodiki jelektrohimicheskogo lizisa v hirurgicheskoj jendokrinologii // Vestnik Nacional’nogo mediko-hirurgicheskogo centra im. N.I. Pirogova. 2010. №5(2). C.18–23 (in Russian)].
14. Борсуков А., Коваленко Е., Евдокимов А. и др. Электрохимический лизис как метод локальной деструкции первичного рака печени под контролем ультразвукового исследования (в эксперименте) // Медицинская визуализация. 2007. №2. C.64–69 [Borsukov A., Kovalenko E., Evdokimov A. i dr. Jelektrohimicheskij lizis kak metod lokal’noj destrukcii pervichnogo raka pecheni pod kontrolem ul’trazvukovogo issledovanija (v jeksperimente) // Medicinskaja vizualizacija. 2007. №2. C.64–69 (in Russian)].
15. Борсуков А., Андреева О. Морфологические критерии эффективности малоинвазивного электрохимического лизиса узлового коллоидного зоба // Ученые записки Орловского государственного университета. 2011. №3. C.211–218 [Borsukov A., Andreeva O. Morfologicheskie kriterii jeffektivnosti maloinvazivnogo jelektrohimicheskogo lizisa uzlovogo kolloidnogo zoba // Uchenye zapiski Orlovskogo gosudarstvennogo universiteta. 2011. №3. C.211–218 (in Russian)].
16. Борсуков А., Косова А., Иванов Ю. и др. Локальное лечение узлового зоба малоинвазивным электрохимическим лизисом: пилотные результаты // Клиническая и экспериментальная тиреоидология. 2010. №6(1). C.46–53 [Borsukov A., Kosova A., Ivanov Ju. i dr. Lokal’noe lechenie uzlovogo zoba maloinvazivnym jelektrohimicheskim lizisom: pilotnye rezul’taty // Klinicheskaja i jeksperimental’naja tireodologija. 2010. №6(1). C.46–53 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
