Введение
Рак предстательной железы (РПЖ) является одним из наиболее распространенных онкологических заболеваний среди мужчин. По данным Международного агентства по изучению рака на 2022 г., распространенность РПЖ составляет 14,2%, уступая только раку легких, при ежегодном выявлении почти 1,5 млн новых случаев[1].
Рак предстательной железы считается полиэтиологичным заболеванием, факторами риска которого являются возраст от 45 лет, отягощенный наследственный анамнез, поведенческие факторы и факторы окружающей среды, особенности питания пациентов. Канцерогенез РПЖ, как и других новообразований, связан с нарушением нормальной регуляции клеточной дифференцировки, пролиферации и апоптоза, которые являются следствием нарушения метаболизма клеток, зависимых от андрогенов и сигналинга андрогеновых рецепторов (AR) [1]. При этом отмечается, что единственного влияния AR, как правило, недостаточно для опухолевой трансформации, в которую вовлечены многие другие генетические нарушения, которые, с одной стороны, могут быть связаны с метаболизмом андрогенов, а с другой — влиять на опухолевую трансформацию посредством других механизмов. Среди них сигналинг эстрогенов, гормонов щитовидной железы, витамина D, прогестерона. Помимо этого, активация транскрипции, опосредованная AR, зависит от обширной сети генетических и эпигенетических регуляторов [2].
Наиболее многообещающим подходом для реализации стратегий персонализированной медицины, в том числе в аспекте РПЖ, является изучение генетических полиморфизмов, которые могут быть ассоциированы как с предрасположенностью к заболеванию, так и с исходом лечения [3, 4]. Генетические полиморфизмы способны вызывать различные фенотипические изменения экспрессии и/или активности генов и кодируемых ими молекул. В рамках крупных биомедицинских полногеномных исследований, посвященных предрасположенности к РПЖ, выявляются сотни однонуклеотидных полиморфизмов, вовлеченных в патогенез заболевания [5–7]. Так, согласно данным D.K. Price et al. [8], полиморфизм rs472402 в гене SRD5A1, кодирующем 5α-редуктазу 1-го типа, ассоциирован с повышением риска РПЖ в 1,7 раза, в то время как полиморфизм rs2300700 в гене SRD5A2, кодирующем 5α-редуктазу 2-го типа, — в 1,9 раза. Часть изучаемых однонуклеотидных полиморфизмов в данных генах, а также в генах, кодирующих цитохром Р450, приводила к изменению сывороточной концентрации секс-стероид-связывающего глобулина (SHBG), а также половых гормонов, напрямую вовлеченных в патогенез РПЖ.
Таким образом, в патогенез РПЖ вовлечено большое количество молекулярно-генетических факторов, действующих как самостоятельно, так и посредством регуляции рецепторной активности андрогенов, что требует углубленного изучения механизмов гормональной регуляции и молекулярных основ заболевания. В настоящий момент использование генетических маркеров в качестве диагностики предрасположенности к развитию РПЖ не имеет места в рутинном обследовании пациентов ввиду неоднозначности данных о роли конкретных генов.
Цель исследования: изучить особенности экспрессии и активности ряда специфических генов у пациентов с РПЖ в возрасте до 55 лет, продукты которых, согласно данным литературы, ассоциированы с канцерогенезом.
Содержание статьи
Материал и методы
Характеристика выборки пациентов. В исследование было включено 45 пациентов в возрасте 55 лет и моложе с РПЖ, которым на базе ФГБУ «РНЦРР» Минздрава России выполнялась высокодозная брахитерапия (иридий-192). Медиана возраста пациентов составила 53 года (межквартильный интервал 51–55 лет), минимальный и максимальный возраст — 44 года и 55 лет соответственно. На момент выполнения брахитерапии медиана уровня простатспецифического антигена (ПСА) составила 8,6 нг/мл (межквартильный интервал 6–11 нг/мл), минимальный и максимальный уровень ПСА в общей выборке — 0,44 и 58,00 нг/мл соответственно.
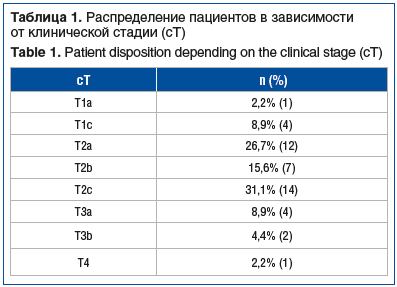
У большей части пациентов отмечались клинические стадии T2c и Т2а, реже всего — стадии Т1а и Т4 (табл. 1). У 1 (2,2%) пациента отмечалось метастатическое поражение регионарных лимфатических узлов (сN1). Отдаленных метастазов не отмечено ни у одного пациента.
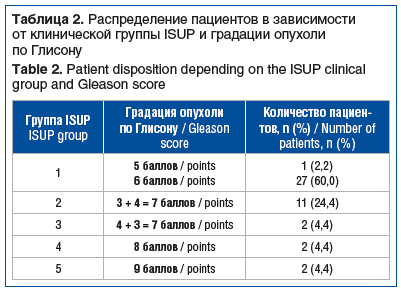
У подавляющего большинства (62,2%) пациентов исследуемой выборки сумма баллов по Глисону не превышала 6, т. е. пациенты относились к клинической группе ISUP 1 (табл. 2).
Молекулярно-генетическое исследование. Всем пациентам выполнялось молекулярно-генетическое исследование буккального эпителия с целью выявления полиморфизмов, ассоциированных с изменением экспрессии/активности/чувствительности генов, кодирующих ряд гормонов, рецепторов, ферментов и других белков, вовлеченных в онкогенез РПЖ. В качестве таргетных генов были выбраны следующие: AR, SHBG, SRD5A2, CYP19A1, ESR1α, ESR2β, COMT, PGR, FADS2, PPARG, CYP27B1, VDR.
В молекулярной биологии и генетике важными аспектами являются оценки чувствительности, активности и экспрессии генов. Эти термины относятся к разным аспектам функционирования генов и их влияния на клеточные процессы.
Экспрессия генов — это процесс, в ходе которого информация из ДНК используется для синтеза мРНК, а затем белков. Оценка экспрессии генов позволяет исследовать, какие гены активны в определенных условиях и как их уровень выраженности меняется в ответ на различные факторы (гены ESR1α, ESR2β).
Активность гена относится к его способности к транскрипции и трансляции, т. е. к тому, насколько активно ген участвует в производстве белка. Это понятие охватывает не только уровень экспрессии, но и регуляцию, которая может влиять на то, как и когда гены активируются (гены PPARG, CYP27B1, FADS2, SRD5A2, CYP19A1).
Чувствительность генов характеризует их реакцию на различные внешние и внутренние факторы, такие как стрессовые условия, изменения температуры и воздействие лекарственных средств. Оценка чувствительности помогает понять, как гены влияют на физиологические реакции клеток и организма в целом (гены PGR, VDR, AR).
Забор материала для молекулярно-генетического исследования проводили на базе ФГБУ «РНЦРР» Минздрава России. Был использован неинвазивный отбор образцов. Непосредственно перед забором биологического материала, а именно буккального эпителия, пациентам было рекомендовано выполнить гигиену полости рта. Далее с помощью зонда осуществляли забор материала с внутренней поверхности слизистой щеки посредством 10–20 круговых движений на внутренней поверхности обеих щек. Затем зонд упаковывали в бумажный конверт и маркировали.
ДНК выделяли из клеток буккального (защечного) эпителия с использованием набора для очистки ДНК, полученного от лаборатории «Аллель» (ООО «Аллель», Россия). Методика выделения ДНК основана на осаждении с использованием Spin-колонок, что позволяет получить наиболее высокую концентрацию и чистоту. Концентрацию ДНК оценивали спектрофотометрически по соотношению длин волн 260 и 280 нм.
Статистический анализ данных. Статистический анализ данных проводили при помощи программного обеспечения Orange (версия 3.37.0). Для описания распределения чувствительности различных генов к определенным гормонам/веществам использовали частотные характеристики (%) и абсолютные значения (n). Данные были представлены в виде таблиц и графиков. Для сравнения категориальных переменных с бинарными исходами использовали критерии χ2, χ2 с поправкой Йейтса или точный критерий Фишера (в зависимости от показателей ожидаемых частот). Для сравнения категориальных переменных с несколькими исходами использовали критерий χ2. В ходе каждого сравнения различия считали статистически значимыми при p<0,05.
Результаты исследования
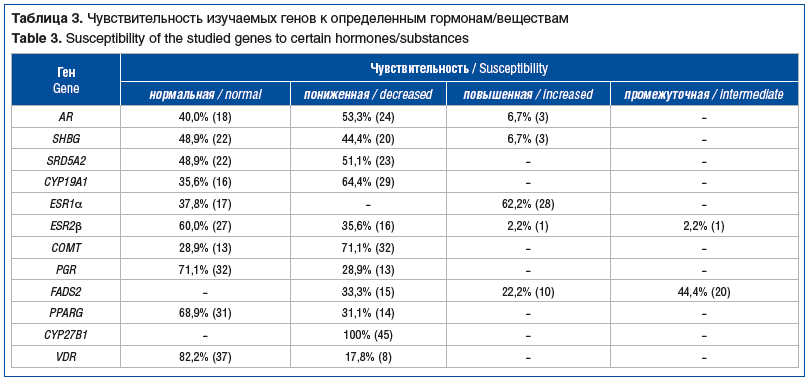
В ходе оценки чувствительности изучаемых генов к определенным гормонам/веществам, а также активности и экспрессии кодируемых ими белков у пациентов с РПЖ, выявленным в возрасте до 55 лет включительно, было отмечено, что нормальная чувствительность/активность/экспрессия чаще всего была характерна для VDR (82,2% случаев), PGR (71,1%), PPARG (68,9%). Реже всего нормальная чувствительность/активность/экспрессия отмечалась для генов COMT (28,9%), CYP19A1 (35,6%), ESR1α (37,8%). Пониженная чувствительность/активность/экспрессия чаще была характерна для генов CYP27B1 (100%), COMT (71,1%), CYP19A1 (64,4%), реже всего — для генов VDR (17,8%), PGR (28,9%), PPARG (31,1%). Повышенная чувствительность/активность/экспрессия чаще отмечалась для генов ESR1α (62,2%) и FADS2 (22,2%), реже — для ESR2β (2,2%). Промежуточная чувствительность отмечалась только для двух генов — ESR2β и FADS2 (2,2 и 44,4% соответственно) (табл. 3).
Дополнительно мы изучили распределение чувствительности/активности/экспрессии изучаемых генов к гормонам/веществам в зависимости от возраста пациентов. Для этого все пациенты были разделены на 2 группы по медиане возраста для данной выборки, которая составила 53 года. Группу пациентов в возрасте до 53 лет составили 22 человека, группу пациентов в возрасте 53 года и старше — 23 человека. В ходе сравнительного анализа статистически значимых различий между группами выявлено не было.
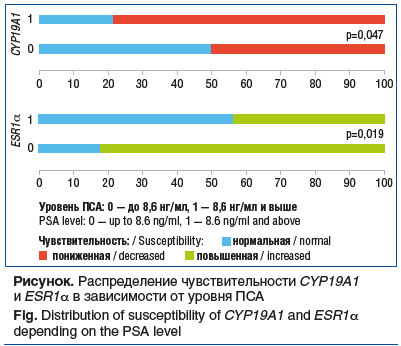
На следующем этапе мы изучили распределение чувствительности/активности/экспрессии изучаемых генов в зависимости от уровня ПСА. Для этого все пациенты были разделены на 2 группы по медиане уровня ПСА для данной выборки, которая составила 8,6 нг/мл. Группу пациентов с ПСА до 8,6 нг/мл составили 22 человека, группу пациентов с ПСА 8,6 нг/мл и выше — 23 человека. В ходе сравнительного анализа было показано, что активность и экспрессия CYP19A1 и ESR1α соответственно статистически значимо отличались между пациентами с более низким и высоким уровнем ПСА. Так, у пациентов с ПСА до 8,6 нг/мл чаще отмечалась нормальная активность CYP19A1, чем у пациентов с ПСА 8,6 нг/мл и выше: 50,0 и 21,7% соответственно (р=0,047). Для пациентов с ПСА 8,6 нг/мл и выше чаще отмечалась пониженная активность CYP19A1. В отношении гена ESR1α было показано, что для пациентов с ПСА 8,6 нг/мл и выше была характерна нормальная экспрессия гена, в то время как для пациентов с ПСА до 8,6 нг/мл — повышенная экспрессия (см. рисунок). Статистически значимых различий распределения чувствительности/активности/экспрессии других генов выявлено не было.
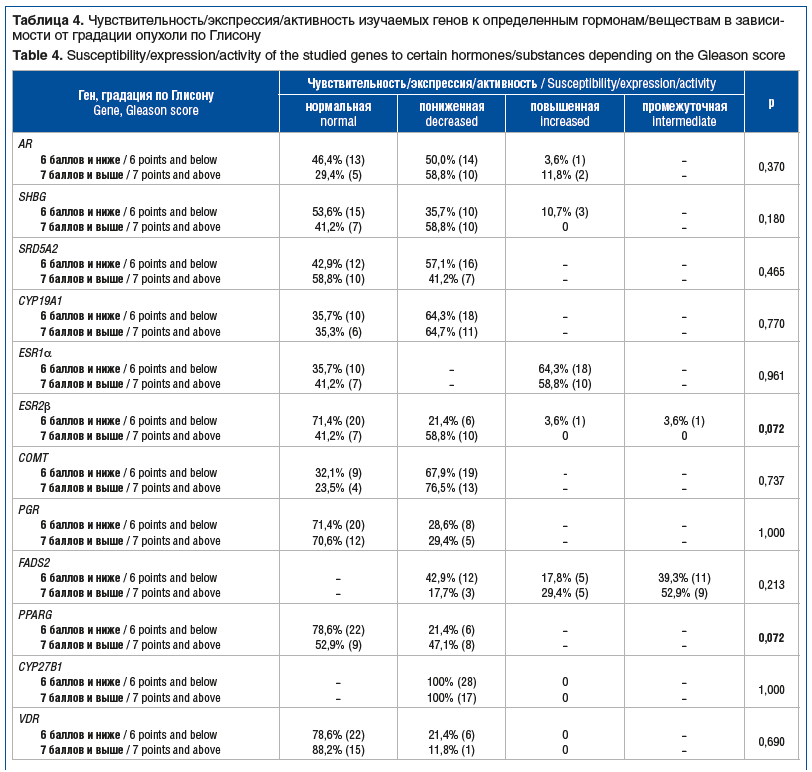
На следующем этапе мы изучили распределение чувствительности/активности/экспрессии изучаемых генов в зависимости от градации опухоли по Глисону. Для этого все пациенты были разделены на 2 группы: группу с градацией опухоли по Глисону 6 баллов и ниже (n=28) и группу с градацией опухоли по Глисону 7 баллов и выше (n=17). В ходе сравнительного анализа статистически значимых различий выявлено не было, однако для двух генов, ESR2β и PPARG, отмечался пограничный уровень значимости. Так, для пациентов с градацией РПЖ по Глисону 6 баллов и ниже нормальная экспрессия ESR2β отмечалась в 71,4% случаев, в то время как для пациентов с градацией РПЖ по Глисону 7 баллов и выше — в 41,2% случаев (р=0,072). Аналогичная закономерность наблюдалась и для гена PPARG: нормальная активность в указанных группах встречалась в 78,6 и 52,9% случаев соответственно (р=0,072) (табл. 4).
Обсуждение
В рамках настоящей работы мы изучили особенности экспрессии и активности ряда специфических генов у пациентов с РПЖ в возрасте до 55 лет. Продукты изученных нами генов, согласно описанным в литературе данным, вовлечены в патогенез РПЖ. Важнейшую роль в развитии и прогрессии РПЖ играют андрогены, действие которых опосредовано AR. Люминальные клетки ацинусов предстательной железы являются наиболее частым типом клеток, из которых развивается РПЖ, а ацинарная аденокарцинома в 95% случаев экспрессирует AR [9]. По данным M. Stanbrough et al. [11], у 45% мышей с гиперэкспрессией AR отмечается возникновение диспластических поражений простаты и простатической интраэпителиальной неоплазии, однако ни в одном случае не развивается РПЖ [10]. При этом, как показали G. Han et al. [11], на фоне постоянной активации AR, вызванной мутацией E231G, у мышей отмечается возникновение и метастазирование ацинарной аденокарциномы. Тем не менее роль AR неоднозначна. Как оказалось, активация AR может приводить как к индукции, так и к супрессии опухолевого роста посредством различных молекулярных механизмов [12], а физиологические концентрации андрогенов приводят к ингибированию пролиферативной активности опухолевых клеток [13]. Такая двойственная роль AR нашла отражение и в полученных нами результатах, согласно которым у 53,3% пациентов с РПЖ отмечалась пониженная чувствительность AR к андрогенам, у 40,0% — нормальная, а у 6,7% — повышенная. Однако для интерпретации данных результатов целесо-образно учитывать концентрацию андрогенов и влияющие на нее факторы.
Одним из ключевых белков, обеспечивающих транспортировку и биодоступность половых гормонов, является SHBG, контролирующий уровень свободных андрогенов, помогая тем самым регулировать андроген-зависимые процессы в организме [14]. Связывая андрогены, SHBG препятствует их взаимодействию с AR в клетках простаты. Помимо этого, описано, что SHBG может напрямую взаимодействовать с простатическими клетками за счет взаимодействия со специфическими рецепторами на их поверхности [14]. По данным крупного исследования B. Wan et al. [15], включающего почти 80 тыс. мужчин с РПЖ, повышенный уровень SHBG ассоциирован со снижением риска РПЖ и сниженной концентрацией биоактивного тестостерона, указывая тем самым на потенциальную защитную функцию SHBG. Похожие данные были получены O.A. Bamodu et al. [16], где повышение экспрессии SHBG снижало вероятность отдаленного метастазирования и биохимического рецидива РПЖ, повышая общую 5-летнюю выживаемость пациентов, а индукция SHBG, по мнению исследователей, представлялась перспективной терапевтической стратегией при РПЖ. В рамках настоящей работы повышенная активность SHBG и, соответственно, повышенная биодоступность половых гормонов отмечались только у 6,7% пациентов с РПЖ, чаще всего оставаясь нормальными (48,9%) или пониженными (44,4%), указывая тем самым на отсутствие выраженного защитного влияния SHBG у подавляющего большинства обследуемых.
Метаболизм андрогенов, в частности переход тестостерона в его активную форму, дигидротестостерон, регулируется ферментом 5α-редуктазой, 2 изоформы которой кодируются одноименными генами SRD5A1 и SRD5A2. Усиленная продукция андрогенов стимулирует рост нормальной ткани предстательной железы и андроген-зависимых опухолевых клеток простаты. Однако по мере онкогенеза клетки РПЖ теряют зависимость от андрогенов, в результате чего экспрессия SRD5A2 снижается, а функциональная роль фермента изменяется [17]. Так, в исследовании J. Meng et al. [18] было показано, что экспрессия SRD5A2 в ткани предстательной железы у пациентов с более высокой стадией РПЖ и более высокой градацией опухоли по Глисону значительно ниже, чем у пациентов с более благоприятной клинико-морфологической картиной. После нокдауна SRD5A2 отмечалось выраженное усиление клеточной пролиферации, т. е. более низкий уровень SRD5A2 оказался ассоциирован с неблагоприятным прогнозом РПЖ, подтверждая опухоль-ингибирующую функцию SRD5A2 [18]. Возможное объяснение выявленной взаимосвязи было дано в работе S. Aggarwal et al. [19], согласно которому SRD5A2 может ингибировать миграцию и инвазию клеточных линий РПЖ за счет реорганизации цитоскелета и ингибирования MEK1- и pERK1/2-сигналинга. Полученные нами результаты согласуются с имеющимися в литературе данными. Нами показано, что у пациентов с РПЖ в 51,1% случаев отмечается пониженная активность SRD5A2, т. е. для части пациентов онкогенез происходит уже независимо от уровня андрогенов. При этом ни в одном случае активность SRD5A2 не была повышена.
Одним из драйверов онкогенеза является оксидативный стресс, способный вызывать повреждения ДНК и, как следствие, нарушение нормального клеточного сигналинга. Эндогенными антиоксидантами являются представители суперсемейства цитохрома Р450, обладающие оксидоредуктазной и монооксигеназной активностью и способностью метаболизировать широкий спектр химических соединений, в том числе стероидные гормоны [20]. Одним из представителей суперсемейства является CYP19A1, известный как ароматаза и кодируемый одноименным геном. CYP19A1 конвертирует андростендион в эстрон, 16-гидрокситестостерон в эстриол и тестостерон в 17β-эстрадиол [20]. По данным X. Chen et al. [21], экспрессия CYP19A1 в клеточных линиях РПЖ значительно ниже, чем в образцах нормальной ткани предстательной железы, причем такая тенденция сохранялась и для кастрационно-резистентного РПЖ. При гиперэкспрессии CYP19A1 в клетках кастрационно-резистентного РПЖ отмечалось снижение инвазивного и пролиферативного потенциала, в то время как при снижении экспрессии CYP19A1 — усиление онкогенных свойств, в результате чего исследователи сделали вывод о возможной терапевтической роли CYP19A1 для предотвращения кастрационно-резистентного РПЖ. Помимо этого, на животной модели исследователи показали, что на фоне снижения экспрессии CYP19A1 повышается экспрессия AR, что может способствовать развитию РПЖ [21]. В рамках настоящего исследования установлено, что у 64,4% пациентов с РПЖ отмечалась пониженная активность ароматазы, у 35,6% — нормальная, в то время как повышенная активность не отмечалась ни у одного человека. Тем самым наши данные косвенно указывали на возможную защитную функцию данного фермента, снижение уровня которого ассоциировано с повышением концентрации AR и андрогенов, способствующих канцерогенезу. Дополнительно нами было показано, что у пациентов с более высоким уровнем ПСА (8,6 нг/мл и выше) чаще отмечалась пониженная экспрессия CYP19A1 по сравнению с пациентами с более низким уровнем ПСА (до 8,6 нг/мл): 78,3 и 50,0% соответственно (р=0,047). Это также свидетельствует о возможной неблагоприятной роли сниженной активности ароматазы. Несмотря на полученные нами данные, некоторые исследователи придерживаются противоположного мнения относительно функции CYP19A1. Так, Zh. Liang et al. [22] показали, что нокдаун CYP19A1 в клеточных линиях РПЖ ассоциирован со снижением инвазивного потенциала клеток и уменьшением экспрессии генов, опосредующих метастазирование. Исследователи показали, что индуцированное ароматазой повышение уровня эстрогенов стимулирует активацию ESR1α, который в свою очередь активирует матриксную металлопротеиназу 12-го типа и опосредующую инвазивный потенциал опухолевых клеток [22].
Такие противоречивые данные относительно функции ароматазы при РПЖ могут быть связаны с разнонаправленным действием различных подтипов эстрогеновых рецепторов. Как известно, эстрогены играют центральную роль в развитии и прогрессии гормон-чувствительных опухолей. Эффекты эстрогенов опосредованы двумя эстрогеновыми рецепторами — ESR1α и ESR2β, кодируемыми генами ESR1α и ESR2β соответственно [23]. Оба типа рецепторов в норме обнаруживаются в структуре предстательной железы. ESR1 экспрессируется в строме и в небольшом количестве в базальных эпителиальных клетках, в то время как ESR2 преимущественно в эпителиальных клетках [24]. Исследования in vitro и in vivo показали, что активация ESR1α обладает онкогенным влиянием, усиливая пролиферацию опухолевых клеток [25–27]. Так, I. Takizawa et al. [25] показали, что у мышей с более агрессивными формами РПЖ и повышенной пролиферативной активностью отмечается высокая экспрессия ESR1α, нокдаун которого приводит к снижению клеточной пролиферации. Считается, что в отличие от ESR1α ESR2β выступает в роли супрессора опухолевого роста. Рядом работ показано, что потеря ESR2β стимулирует онкогенез РПЖ, увеличивает экспрессию AR, снижает активность антиоксидантных механизмов [28, 29]. S.J. McPherson et al. [30] показали, что ESR2β-сигналинг активирует апоптоз опухолевых клеток простаты в условиях как in vıtro, так и in vivo преимущественно за счет повышения активности фактора некроза опухолей α (TNFα). Отмечается, что в ходе опухолевой прогрессии РПЖ экспрессия ESR1α остается повышенной, в то время как экспрессия ESR2β — пониженной [31], что еще раз подтверждает разнонаправленную роль данных рецепторов в онкогенезе. Похожие результаты были получены и нами в ходе оценки экспрессии рецепторов эстрогенов при анализе полиморфизмов кодирующих их генов. Нами показано, что у пациентов с РПЖ в 62,2% случаев отмечается повышенная экспрессия ESR1α, обладающего проонкогенными свойствами, в то время как нормальная экспрессия была характерна для 37,8% пациентов, а пониженная экспрессия не встречалась ни у одного из обследуемых. Другая тенденция отмечалась для ESR2β, экспрессия которого была повышена только у 1 (2,2%) пациента, в то время как у остальных 97,8% была нормальной или пониженной. Полученные нами результаты согласуются с описанными в литературе и указывают на возможное проонкогенное и антионкогенное влияние ESR1α и ESR2β соответственно.
Метаболизм эстрогенов сопряжен с образованием ряда промежуточных соединений, которые могут выступать как в качестве стимуляторов, так и в качестве ингибиторов канцерогенеза. Так, представитель катехолэстрогенов, 4-гидроксиэстрадиол, стимулирует клеточную пролиферацию, в то время как 2-метоксиэстрадиол обладает противоопухолевой активностью. Главным ферментом, ответственным за метилирование и детоксикацию канцерогенного метаболита, является катехол-О-метилтрансфераза (COMT), способствующая образованию защитного метаболита, 2-метоксиэстрадиола [32, 33]. По данным M.F. Tolba et al. [34], нокдаун COMT стимулирует пролиферацию ESRα позитивной клеточной линии РПЖ, не влияя при этом на ESRα негативные клетки. Тем самым COMT выступает в роли супрессора опухолевого роста. В работе Y. Hashimoto et al. [35] в ходе анализа собственных клинических данных и данных атласа ракового генома при РПЖ отмечалась сниженная экспрессия COMT. Усиление экспрессии COMT приводило к подавлению миграционной способности клеток и стимуляции апоптоза, а при дополнительном введении 4-гидроксиэстрадиола — к ингибированию клеточной пролиферации за счет превращения данного канцерогенного метаболита под действием COMT в 2-метоксиэстрадиол с противоопухолевой активностью. В рамках настоящего исследования, как и в работе [15], нами была отмечена пониженная активность фермента COMT у большинства пациентов с РПЖ (71,1%), в то время как у 28,9% активность оставалась нормальной. Повышенной активности данного фермента не выявлено ни у одного пациента, что еще раз может указывать на ингибирующую роль данного фермента, активность которого при развитии РПЖ остается низкой, поддерживая онкогенез.
Одним из промежуточных продуктов синтеза стероидных гормонов является прогестерон, который играет важную роль в развитии и поддержании репродуктивной функции женщин, а также задействован в канцерогенезе молочной железы, матки, яичников, ободочной кишки и, как показывают последние работы, вовлечен в патогенез РПЖ [36]. Однако роль прогестерона и его рецептора, PGR, при РПЖ неоднозначна. С одной стороны, рядом исследователей показано, что прогестерон обладает онкогенным эффектом, а повышение его уровня ассоциировано с неблагоприятным прогнозом [37, 38]. С другой стороны, последние исследования указывают на выраженный супрессивный эффект прогестерона на клеточную пролиферацию при РПЖ. Так, согласно T. Seki et al. [39], нагруженные прогестероном липосомы угнетают пролиферацию опухолевых клеток простаты. По данным метаанализа Wen-Fa Zhang et al. [40], у пациентов с первичным и метастатическим РПЖ отмечается сниженная экспрессия PGR, что, по мнению исследователей, ослабляет ингибирующий эффект PGR на пролиферацию опухолевых клеток РПЖ. В рамках настоящего исследования ни у одного из пациентов с РПЖ не наблюдалась повышенная чувствительность рецепторов к прогестерону. У 71,1% пациентов чувствительность PGR оставалась нормальной, в то время как у 28,9% — пониженной, что могло указывать на защитный эффект PGR и отсутствие выраженного ингибирующего эффекта прогестерона на пролиферацию опухолевых клеток, способствуя развитию РПЖ.
Обсервационные исследования показывают наличие взаимосвязи РПЖ с нарушением метаболизма жирных кислот [41]. В связи с этим одним из изученных нами генов при РПЖ стал ген FADS2, кодирующий десатуразу жирных кислот 2. Последняя участвует в превращении насыщенных жирных кислот в ненасыщенные и полиненасыщенные жирные кислоты, а также связана с инсулинорезистентностью, снижением толерантности к глюкозе и повышенным риском развития сахарного диабета 2 типа. По данным K.S.D. Kothapalli et al. [42], для опухолевых клеток меланомы, рака печени, рака легких и РПЖ характерны повышенная активность FADS2 и повышенный биосинтез сапиеновой кислоты, являющейся основным компонентом кожного сала человека. M. Azrad et al. [41] показали, что некоторые однонуклеотидные полиморфизмы гена FADS2, в частности rs99780 и rs174545, ассоциированы с повышением пролиферативной активности РПЖ, в то время как другие (rs174572) — со снижением пролиферативной активности, указывая на возможную роль изменения активности данного гена и его продукта при РПЖ. В рамках настоящей работы показано, что у 33,3% пациентов отмечается пониженная активность FADS2, в то время как у 22,2% — повышенная, а у 44,4% — промежуточная. Такие результаты затрудняют интерпретацию роли десатуразы жирных кислот 2 при РПЖ для данной выборки и требуют дальнейшего сравнения с группой здоровых пациентов.
В последние годы в качестве возможного триггерного фактора и терапевтической мишени при РПЖ обсуждается рецептор, активируемый пролифераторами пероксисом, гамма (PPAR-γ), кодируемый геном PPARG [43]. PPAR-γ играет ключевую роль в дифференцировке адипоцитов и периферической утилизации глюкозы, а его антагонисты широко используются для лечения сахарного диабета 2 типа. Многие исследования показали, что PPAR-γ играет ключевую роль в онкогенезе как супрессор опухолевого роста, а его агонисты обладают антипролиферативным и проапоптотическим действием при многих онкологических заболеваниях. Так, показано, что PPAR-γ ингибирует пролиферацию опухолевых клеток рака ободочной кишки в условиях in vitro и in vivo [44]. Аналогичные данные были получены и для РПЖ. Было показано, что агонисты PPAR-γ индуцируют гибель опухолевых клеток РПЖ, снижают экспрессию и активность AR и ингибируют опухолевый рост [45, 46]. В нашем исследовании ни у одного из пациентов с РПЖ не отмечалось повышенной активности гена PPARG, что указывало на отсутствие защитного влияния PPAR-γ в отношении РПЖ. Помимо этого, нами было показано, что у пациентов с более агрессивными формами РПЖ (7 баллов по Глисону и выше) пониженная активность PPARG встречается чаще, чем у пациентов с более благоприятными формами РПЖ (6 баллов по Глисону и ниже): 41,1 и 21,4% соответственно (р=0,072), также указывая на возможную защитную функцию PPARG. Тем не менее последние исследования опровергают данную теорию, показывая, что PPAR-γ не только не выступает в качестве супрессора опухолевого роста, но, наоборот, может быть ассоциирован с РПЖ, а антагонисты PPAR-γ могут ингибировать рост РПЖ [43, 45]. Тем не менее точная роль гена PPARG и его продукта, PPAR-γ, учитывая противоречивые данные литературы, до конца непонятна [44].
Как оказалось, витамин D ассоциирован с развитием и прогрессированием РПЖ. Исследования показывают, что связывание лиганда с рецептором витамина D (VDR) приводит к остановке роста, дифференцировке и апоптозу клеток РПЖ [47]. Исследования на животных моделях показали, что метастазирование РПЖ чаще отмечается у мышей, находящихся на диете с дефицитом витамина D, что способствует усиленному эпителиально-мезенхимальному переходу [48]. Считается, что VDR и AR могут регулироваться по принципу отрицательной обратной связи. Так, на фоне повышения активности AR в клеточной линии андроген-зависимых клеток РПЖ отмечается снижение уровня VDR, а отмена андрогенов, наоборот, повышает чувствительность клеток к витамину D и, соответственно, уровень экспрессии VDR [47, 49, 50]. Соответственно, аналогичная взаимосвязь характерна и для гена CYP27B1, кодирующего фермент 1α-гидроксилазу, который способствует переводу витамина D в его активную форму [51, 52]. Нами показано, что для пациентов с РПЖ в 100% случаев отмечается пониженная активность 1α-гидроксилазы при нормальной или пониженной чувствительности VDR к витамину D также в 100% случаев, что могло быть ассоциировано с нивелированием протективного действия витамина D в отношении развития РПЖ.
Заключение
Рак предстательной железы является многофакторным заболеванием, обусловленным дисбалансом регуляторных систем организма. У пациентов с РПЖ отмечается изменение экспрессии ряда генов за счет нескольких полиморфизмов, обусловливающих различную активность рецепторов, ферментов и других белков, вовлеченных в онкогенез. Дальнейшее изучение модуляции активности данных субстанций может стать новой терапевтической стратегией, способствовать развитию персонализированного подхода в медицинской практике, особенно в области профилактики и ранней диагностики онкологических заболеваний.
СВЕДЕНИЯ ОБ АВТОРАХ:
Володина Ирина Викторовна — врач-аспирант отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-3327-6025
Павлов Андрей Юрьевич — д.м.н., профессор, заместитель директора ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-2905-7735
Дзидзария Александр Гудисович — д.м.н., заведующий отделением урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0001-5789-375X
Цыбульский Алексей Дмитриевич — д.м.н., старший научный сотрудник отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «РНЦРР» Минздрава России; 117997, Россия, г. Москва, ул. Профсоюзная, д. 86; ORCID iD 0000-0002-1647-6180
Контактная информация: Володина Ирина Викторовна, e-mail: 79102882190@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 06.02.2025.
Поступила после рецензирования 03.03.2025.
Принята в печать 26.03.2025.
ABOUT THE AUTHORS:
Irina V. Volodina — postgraduate student at the Department of Urology with Oncology Beds and Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-3327-6025
Andrey Yu. Pavlov — Dr. Sc. (Med.), Professor, Deputy Director for Scientific and Therapeutic Work, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2905-7735
Alexander V. Dzidzaria — Dr. Sc. (Med.), Deputy Director of the Department of Urology with Oncology Beds and Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5789-375X
Alexey D. Tsibulskii — Dr. Sc. (Med.), Senior Researcher at the Department of Urology with Oncology Beds and Shock Wave Lithotripsy Rooms, Russian Scientific Center of Roentgenology and Radiology; 86, Profsoyuznaya str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-1647-6180
Contact information: Irina V. Volodina, e-mail: 79102882190@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 06.02.2025.
Revised 03.03.2025.
Accepted 26.03.2025.
[1] Cancer Today. (Электронный ресурс.) URL: https://gco.iarc.fr/today/home (дата обращения: 15.01.2025).
Информация с rmj.ru
