Урология
Ключевые слова: рак предстательной железы, группы высокого риска прогрессирования, андрогендепривационная терапия, гормональная терапия, дистанционная лучевая терапия, радикальная простатэктомия.
Для цитирования: Солодкий В.А., Павлов А.Ю., Гафанов Р.А., Гармаш С.В., Кравцов И.Б., Фастовец С.В., Ивашин А.К. Местнораспространенный и локализованный рак предстательной железы группы высокого риска прогрессирования: стратегия лечения, обзор клинических исследований // РМЖ. 2017. №27. С. 2015-2018
Solodkiy V.A., Pavlov A.Yu., Gafanov R.A., Garmash S.V., Kravtsov I.B., Fastovets S.V., Ivashin A.K.
Russian scientific center of radiology and nuclear medicine, Moscow
Over the past few years, recommendations for treating patients with high-risk nonmetastatic prostate cancer have changed significantly. This publication reviews the clinical and pathological criteria needed to determine the optimal treatment for this group of patients. To determine the optimal method of treatment, mandatory examination is necessary in order to exclude the metastatic lesions. Magnetic resonance imaging (MRI) and osteoscintigraphy are among the recommended methods of examination. The determining factor in the choice of treatment is life expectancy, and concomitant diseases. High radiation doses are essential to achieve the therapeutic effect, while the addition of androgen deprivation therapy (ADT) statistically significantly improves the overall and cancer-specific survival. The long-term appointment of neo / adjuvant ADT (2-3 years) significantly improves survival compared with short-term ADT (4-6 months). Radical prostatectomy with extended pelvic lymph node dissection is considered an acceptable method of treatment, and ADT alone is an inappropriate treatment option for treating this group of patients.
Key words: prostate cancer, high-risk cancer groups, androgen deprivation therapy, hormonal therapy, remote radiation therapy, radical prostatectomy.
For citation: Solodkiy V.A., Pavlov A.Yu., Gafanov R.A. et al. Regional and localized prostate cancer in the high-risk group: treatment strategy, review of clinical trials // RMJ. 2017. № 27. P. 2015–2018.
Обзор посвящен стратегиям лечения местнораспространенного и локализованного рака предстательной железы группы высокого риска прогрессирования. Показано, что радикальная простатэктомия с расширенной лимфодиссекцией считается допустимым методом лечения, а андрогендепривационная терапия в монорежиме – неподходящим методом лечения.

Содержание статьи
Введение
Рак предстательной железы (РПЖ) является наиболее часто диагностируемым заболеванием и занимает второе место по смертности среди мужчин пожилого возраста [1]. Смертность в большинстве случаев связана с местнораспространенным или метастатическим РПЖ [2]. На данный момент точное определение местнораспространенного неметастатического РПЖ не выработано. Так, например, в рекомендациях Национальной сети онкологических центров (NCCN) к высокому риску относится клиническая стадия Т3, в то время как в рекомендациях Европейской ассоциации урологов (EAU) и Европейской ассоциации медицинских онкологов (ESMO) – клиническая стадия T2c [3–6].
К высокому риску неметастатического РПЖ относятся все случаи с начальным уровнем простатспецифического антигена (ПСА) более 20 нг/мл, или суммой индекса Глисона более 7, или стадией Т3 [5]. В эпоху ПСА-диагностики на долю местнораспространенного РПЖ приходилось около 10–20% вновь диагностированных случаев РПЖ [7], тогда как около 20% случаев локализованного РПЖ имеет высокий риск прогрессирования [8]. Выжидательная тактика, дистанционная лучевая терапия (ДЛТ), радикальная простатэктомия (РПЭ) с лимфаденэктомией, андрогендепривационной терапией или без таковых, а также любое их сочетание применяются для лечения неметастатического РПЖ высокого риска прогрессирования.
Цель нашей работы: обобщить доступную информацию относительно выбора метода лечения пациентов данной группы.
Для определения оптимального метода лечения необходимо обследование с целью исключения метастатического поражения [3, 5, 9–10]. Для этого рекомендуются магнитно-резонансная томография (МРТ) и остеосцинтиграфия. Новые технологические достижения в области метаболической визуализации и нано-МРТ позволяют выявить распространение РПЖ на ранних стадиях [11–13]. Определяющим фактором в выборе лечения является продолжительность жизни, а также сопутствующие заболевания [14]. К неблагоприятным прогностическим факторам неметастатического РПЖ высокого риска прогрессирования, которые диктуют выбор метода лечения, относятся высокий индекс Глисона, высокий уровень инициального ПСА, экстракапсулярное распространение и/или положительный хирургический край, инвазия в семенные пузырьки и пораженные лимфоузлы [15].
АДТ в сочетание с ДЛТ или РПЭ с расширенной тазовой лимфодиссекцией являются методами выбора в лечении неметастатического РПЖ высокого риска прогрессирования у пациентов с ожидаемой продолжительностью жизни более 5 лет [5]. Хотя стоит отметить, что вопрос влияния продолжительности ожидаемой жизни на выбор метода лечения на данный момент остается дискуссионным [16–18].
Дистанционная лучевая терапия и нео/адъювантная андрогендепривационная терапия
Доказательство о предпочтении лучевой терапии с АДТ основано на нескольких рандомизированных клинических исследованиях (табл. 1). Сочетание ДЛТ с АДТ по сравнению с ДЛТ без АДТ статистически значимо снижает риск биохимического рецидива, клинического прогрессирования, местного рецидива и отдаленных метастазов на 24%, 19%, 36% и 28% соответственно, без увеличения общих нежелательных явлений (относительный риск (ОР) 0,92; 95% доверительный интервал (ДИ) 0,87–1,11), генитоуринарной токсичности (ОР 0,66; 95% ДИ 0,36–1,22), желудочно-кишечной токсичности (ОР 0,69; 95% ДИ 0,46–1,03) и смертности от кардиоваскулярных осложнений (0,87 ОРА; 95% ДИ 0,70–1,09) [23]. В целом комбинация АДТ со стандартными дозами ДЛТ улучшают показатели общей и канцероспецифической выживаемости без существенного увеличения токсичности [24–27]. Следует отметить, что все эти исследования были проведены в эпоху субоптимальных доз ДЛТ, с самой высокой суммарной дозой 66 Гр, в то время как в современных условиях рекомендуемая суммарная доза составляет 76–78 Гр [4, 21]. В настоящее время нет никаких доказательств того, чтобы не использовать АДТ в сочетании с ДЛТ при лечении больных неметастатическим РПЖ высокого риска прогрессирования [28]. У пациентов с неметастатическим РПЖ высокого риска прогрессирования сочетание долгосрочной адъювантной АДТ и лучевой терапии показало статистически значимое увеличение общей выживаемости по сравнению с краткосрочной АДТ [28–29]. При этом стоит отметить, что применение краткосрочной АДТ в сочетании с ДЛТ не показало никакой эффективности у пациентов с низким риском прогрессирования, при этом отмечалось увеличение канцероспецифической и общей выживаемости у пациентов группы промежуточного риска прогрессирования. Что касается пациентов с высоким риском, сочетание долгосрочной АДТ и ДЛТ относится к стандартам лечения [21, 30].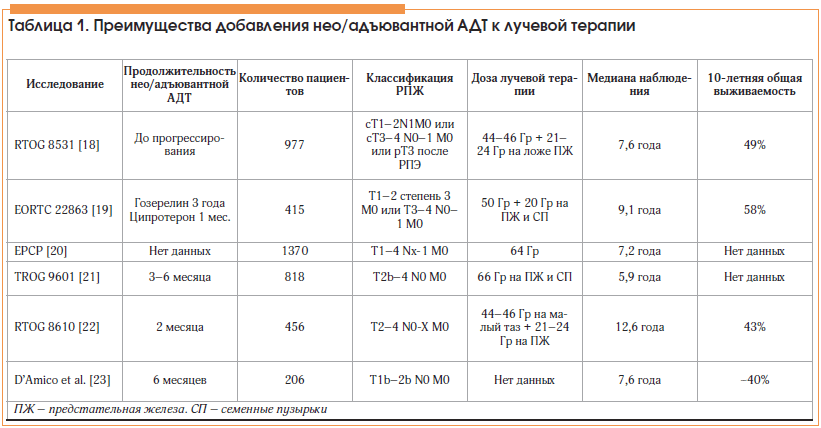
Радикальная простатэктомия с расширенной лимфаденэктомией
Доказательства в пользу хирургического метода лечения получены в нескольких крупных ретроспективных многоцентровых исследованиях. Потенциальное преимущество операции в качестве монотерапии или в качестве первого шага при мультимодальном подходе заключается в том, чтобы точно стадировать онкологический процесс, а также определить необходимость назначения адъювантной терапии. Расширенная тазовая лимфодиссекция, удаление семенных пузырьков, апикальная диссекция, удаление сосудисто-нервного пучка на участке, примыкающем непосредственно к опухоли, а также резекция шейки мочевого пузыря, когда опухоль находится у основания, являются обязательными мерами для достижения адекватного локального контроля [31].
Ретроспективные данные показывают хорошие онкологические результаты, при этом 10-летняя канцероспецифическая выживаемость у мужчин с высоким риском неметастатического РПЖ колеблется от 60% до 92% [21, 31–33]. В этих исследованиях была показана закономерность между канцероспецифической выживаемостью и количеством первоначальных неблагоприятных факторов (ПСА выше 20 нг/мл, индекс Глисона выше 8, клиническая стадия T3 и выше, инвазия в семенные пузырьки).
Отдаленные результаты рандомизированного исследования EORTC 229111 по изучению послеоперационной лучевой терапии после РПЭ продемонстрировали увеличение биохимической безрецидивной выживаемости в группе больных моложе 70 лет с положительным хирургическим краем. При этом у пациентов старше 70 лет послеоперационная адъювантная ДЛТ вызывала увеличение частоты генитоуринарных осложнений [34].
Улучшение биохимической безрецидивной выживаемости также было продемонстрировано в исследовании ARO 96-02, где оценивалась ранняя ДЛТ после РПЭ при стадии pT3 и с положительным хирургическим краем, по сравнению с наблюдением (56% против 35%; р
Недавно были опубликованы данные исследования RTOG 9601, которые показали, что добавление в течение 24 мес. бикалутамида 150 мг к спасительной лучевой терапии после РПЭ для пациентов с pT2N0 и pT3N0 снижает риск смерти на 23% по сравнению с монотерапией, не вызывая при этом чрезмерную токсичность, за исключением гинекомастии [20, 40].
Системная терапия для пациентов с неметастатическим раком предстательной железы группы высокого риска прогрессирования
АДТ в монорежиме является неподходящим вариантом лечения при высоком риске прогрессирования неметастатического РПЖ. В настоящее время нет убедительных данных, свидетельствующих о том, что АДТ непосредственно увеличивает общую выживаемость по сравнению с динамическим наблюдением [20, 41].
Скандинавское многоцентровое рандомизированное исследование (SPCG-7/SFUO-3) показало пользу добавления нео/адъювантной трехмерной конформной лучевой терапии к АДТ у больных РПЖ стадии T3N0M0. Авторы показали улучшение общей и канцероспецифической выживаемости, при этом было отмечено увеличение частоты генитоуринарных нежелательных реакций [42]. В многоцентровом рандомизированном исследовании (PR/PR07) получены данные об увеличении частоты поздних токсических осложнений со стороны ЖКТ при добавлении лучевой терапии (65–69 Гр на предстательную железу и семенные пузырьки с добавлением 45 Гр на тазовые лимфатические узлы или без такового) по сравнению с АДТ. При этом общая и канцероспецифическая выживаемость были значительно выше в группе с лучевой терапией и АДТ нежели в группе с АДТ в монорежиме [43]. Систематический обзор 10 рандомизированных исследований, сравнивающих нео/адъювантную АДТ до РПЭ, с одной стороны, и РПЭ в качестве монотерапии – с другой, продемонстрировал аналогичные общую и канцероспецифическую выживаемость, но было отмечено, что АДТ значительно снижала риск положительного хирургического края (ОР 0,49; 95% ДИ 0,42–0,56; р
В соответствии с рекомендациями EAU адъювантная АДТ является стандартом лечения у пациентов с поражением лимфатических узлов, и не существует никаких данных о преимуществах добавления АДТ к РПЭ у пациентов с инвазией в семенные пузырьки [4]. В ретроспективном исследовании пациентов с pT2-4pN1, перенесших РПЭ с расширенной тазовой лимфодиссекцией, назначение адъювантной АДТ с лучевой терапией показало лучшие результаты по сравнению с АДТ в монорежиме. Для подтверждения этих данных необходимо дальнейшее проведение рандомизированных клинических исследований [44].
У пациентов с ожидаемой продолжительностью жизни менее 5 лет ни РПЭ, ни АДТ не применяются. Сочетание ДЛТ и АДТ рекомендуется для лечения пациентов с индексом Глисона 8 или выше в сочетании с клинической стадией Т3 и уровнем ПСА выше 20 нг/мл. Если по той или иной причине у таких пациентов ДЛТ невозможна, то АДТ в монорежиме может быть предложена как альтернатива [5].
Несколько исследований III фазы изучают влияние химиотерапии в неоадъювантном и адъювантном режиме при РПЖ в комбинации с гормональной терапией или без нее. Потребуется длительное время, чтобы оценить результаты лечения таких больных, хотя известно, что лишь немногие из этих исследований завершились плановыми наборами. Использование неоадъювантной химиотерапии было оценено при РПЖ высокого риска. Сочетание гормональной терапии и химиотерапии доцетакселом, по-видимому, приводит к уменьшению распространенности опухолевого процесса при удовлетворительных показателях общей токсичности. Было проведено несколько исследований III фазы, оценивающих преимущество химиотерапии перед операцией на фоне АДТ, но в настоящее время результаты этих испытаний еще не опубликованы [45].
B настоящее время проводится III фаза рандомизированного исследования (CALGB 90203), которая оценивает неоадъювантную химиотерапию и АДТ перед РПЭ по сравнению с непосредственной РПЭ у пациентов с высоким риском локализованного и местнораспространенного РПЖ (стадия Т1-3aN0M0). Всего в исследовании проведено лечение 750 пациентов, в основной группе больным проводилось мультимодальное лечение, которое включало 6 циклов неоадъювантной химиотерапии таксанами на фоне АДТ с последующей радикальной простатэктомией, в контрольной группе выполнялась только РПЭ. Первичной конечной точкой исследования будет оцениваться выживаемость без прогрессирования в течение 5 лет [46].
GETUG 12 – это французское рандомизированное исследование III фазы, в котором сравнивали четыре цикла неоадъювантной терапии доцетакселом и эстрамустином до местной терапии, плюс АДТ в течение 3-х лет против местной терапии в комбинации с 3-летней АДТ. В этот протокол было рандомизировано 413 пациентов с местнораспространенным или локализованным РПЖ высокого риска, большинству из которых (87%) была проведена дистанционная лучевая терапия. Данные этого исследования достоверно продемонстрировали значимое улучшение выживаемости без прогрессирования в группе комбинированной терапии по сравнению с группой только АДТ (ОР 0,75; 95% ДИ 0,55–1,01; р=0,06). Также было показано преимущество ПСА-ответа, который был значимо выше у пациентов, получавших химиотерапию, чем у пациентов, получавших только АДТ. Анализ нежелательных явлений показал, что сочетание доцетаксела с эстрамустином имеет приемлемый профиль токсичности [47].
Исследование III фазы RTOG 0521 было разработано для оценки эффективности адъювантной химиотерапии доцетакселом в сочетании с АДТ и дистанционной лучевой терапией. Это исследование включило больных РПЖ высокого риска, получающих АДТ в течение 2-х лет в комбинации с лучевой терапией с адъювантной химиотерапией доцетакселом или без таковой в течение 6 циклов. Первичной конечной точкой определена общая выживаемость. На ASCO 2015 были представлены данные исследования RTOG 0521. Так, 5-летняя выживаемость без прогрессии составила 66% для АДТ+ДЛТ и 73% для АДТ+ДЛТ+химиотерапия (р=0,05; ОР 0,76; 95% ДИ: 0,57–1,00), 4-летняя общая выживаемость в группе химиотерапии составила 93% против 89% соответственно. Токсичность была приемлемой [48].
Исследование III фазы TAX 3501 оценивало адъювантную терапию в сравнении с активным наблюдением при регистрации биохимического прогрессирования. Пациенты высокого риска были рандомизированы на 2 группы, первой группе проводилась АДТ аналогами ЛГРГ в течение 18 мес., во второй группе пациенты получали аналоги ЛГРГ в сочетании с химиотерапией таксанами в течение 6 циклов. Первичной конечной точкой была определена выживаемость без прогрессирования. Это исследование было преждевременно закрыто из-за трудностей набора пациентов, а полученные результаты были недостаточны для определения значимых различий в выживаемости без прогрессирования заболевания [49]. Кроме того, не показала эффективности адъювантная химиотерапия после РПЭ. В III фазе исследования SPCG12 сравнивали действие адъювантной химиотерапии доцетакселом и динамическое наблюдение пациентов, перенесших РПЭ по поводу высокого риска прогрессирования РПЖ. При многофакторном анализе группа лечения не показала лучших результатов. При этом частота летальных исходов была больше в группе адъювантной химиотерапии по сравнению с таковой в группе наблюдения [50].
Выводы
Варианты лечения пациентов с высоким риском неметастатического РПЖ всегда должны обсуждаться в многопрофильной команде врачей. Беседа с пациентом, выявление клинических и патологических признаков болезни играют важнейшую роль в выборе стратегии лечения. Клиницисты должны помнить, что АДТ в монорежиме является неподходящим вариантом лечения пациентов с высоким риском неметастатического РПЖ. При этом необходимо тщательное обследование пациентов в целях исключения отдаленных метастазов и адекватной оценки соматического статуса пациента.
Литература
1. Humphrey P.A. Cancers of the male reproductive organs. In: World Cancer Report, Stewart BW, Wild CP, editors. (eds). Lyon: World Health Organization. 2014.
2. Ries L.A.G., Melbert D., Krapcho M. et al., editors. (eds). SEER cancer statistics review, 1975–2004. Bethesda. MD: National Cancer Institute, http://seer.cancer.gov/csr/1975_2004/ (2007, accessed 16 October 2009).
3. Horwich A., Parker C., de Reijke T. et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann Oncol. 2013. Vol. 24(Suppl. 6). P.vi106–vi114.
4. Aus G., Abbou C.C., Bolla M. et al. EAU guidelines on prostate cancer // Eur Urol. 2005. Vol. 48. P.546–551.
5. National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology, http://www.nccn.org/professionals/physician_gls/f_guidelines.asp (accessed 01 April 2014).
6. D’Amico A.V., Whittington R., Malkowicz S.B. et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer // JAMA. 1998. Vol. 280. P.969–974.
7. Edge S.B. et al. American Joint. Committee on Cancer. Prostate. AJCC cancer staging manual. New York: Springer. 2010. P.457.
8. Sundi D., Ross A.E., Humphreys E.B. et al. African American men with very low-risk prostate cancer exhibit adverse oncologic outcomes after radical prostatectomy: should active surveillance still be an option for them? // J Clin Oncol. 2013. Vol. 31. P.2991–2997.
9. Каприн А.Д., Гафанов Р.А. и др. Диагностика рака предстательной железы // Вопросы онкологии. 1999. Т.45. №1. С.20–25 [Kaprin A.D., Gafanov R.A. i dr. Diagnostika raka predstatel’noj zhelezy // Voprosy onkologii. 1999. T.45. №1. S.20–25 (in Russian)].
10. Каприн А.Д., Фарзат М.Ф., Гафанов Р.А., Костин А.А. Диагностика и лечение ранних форм рака предстательной железы // Вопросы онкологии. 2009. Т.55. №3. С.382–385 [Kaprin A.D., Farzat M.F., Gafanov R.A., Kostin A.A. Diagnostika i lechenie rannih form raka predstatel’noj zhelezy // Voprosy onkologii. 2009. T.55. №3. S.382–385 (in Russian)].
11. Pablico-Lansigan M.H., Hickling W.J., Japp E.A. et al. Magnetic nanobeads as potential contrast agents for magnetic resonance imaging // ACS Nano. 2013. Vol. 7. P.9040–9048.
12. Schreiter V., Reimann C., Geisel D. et al. Nuclear medicine imaging of prostate cancer // Rofo. 2016. Vol. 188. P.1037–1044.
13. Pyka T., Okamoto S., Dahlbender M. et al. Comparison of bone scintigraphy and (68)Ga-PSMA PET for skeletal staging in prostate cancer // Eur J Nucl Med Mol Imaging. 2016. Vol. 43. P.2114–2121.
14. Wahlgren T., Levitt S., Kowalski J. et al. Use of the Charlson combined comorbidity index to predict postradiotherapy quality of life for prostate cancer patients // Int J Radiat Oncol Biol Phys. 2011. Vol. 81. P.997–1004.
15. Buhmeida A., Pyrhönen S., Laato M. et al. Prognostic factors in prostate cancer // Diagn Pathol. 2006. Vol. 1. P.4.
16. Briganti A., Spahn M., Joniau S. et al. Impact of age and comorbidities on long-term survival of patients with high-risk prostate cancer treated with radical prostatectomy: a multi-institutional competing-risks analysis // Eur Urol. 2013. Vol. 63. P.693–701 .
17. Tendulkar R.D., Hunter G.K., Reddy C.A. et al. Causes of mortality after dose-escalated radiation therapy and androgen deprivation for high risk prostate cancer // Int J Radiat Oncol Biol Phys. 2013. Vol. 87. P.94–99.
18. Pilepich M.V., Winter K., Lawton C.A. et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma – long-term results of phase III RTOG 85–31 // Int J Radiat Oncol Biol Phys. 2005. Vol. 61. P.1285–1290.
19. Bolla M., Van Tienhoven G., Warde P. et al. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study // Lancet Oncol. 2010. Vol. 11. P.1066–1073.
20. Mcleod D.G., Iversen P., See W.A. et al. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer // BJU Int. 2006. Vol. 97. P.247–254.
21. Denham J.W., Steigler A., Lamb D.S. et al. Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomised controlled trial // Lancet Oncol. 2005. Vol. 6. P.841–850.
22. Roach M., Bae K., Speight J. et al. Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610 // J Clin Oncol. 2008. Vol. 26. P.585–591.
23. D’Amico A.V., Chen M.-H., Renshaw A.A. et al. Androgen suppression and radiation vs radiation alone for prostate cancer: a randomized trial // JAMA. 2008. Vol. 299. P.289–295 .
24. Bria E., Cuppone F., Giannarelli D. et al. Does hormone treatment added to radiotherapy improve outcome in locally advanced prostate cancer? Metaanalysis of randomized trials // Cancer. 2009. Vol. 115. P.3446–3456.
25. Shelley M.D., Kumar S., Wilt T. et al. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma // Cancer Treat Rev. 2009. Vol. 35. P.9–17 .
26. Verhagen P.C.M.S., Schröder F.H., Collette L. et al. Does local treatment of the prostate in advanced and/or lymph node metastatic disease improve efficacy of androgen-deprivation therapy? A systematic review // Eur Urol. 2010. Vol. 58. P.261–269 .
27. Sasse A.D., Sasse E., Carvalho A.M. et al. Androgenic suppression combined with radiotherapy for the treatment of prostate adenocarcinoma: a systematic review // BMC Cancer. 2012. Vol. 12. P.54.
28. Horwitz E.M., Bae K., Hanks G.E. et al. Ten-year follow-up of radiation therapy oncology group protocol 92–02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer // J Clin Oncol. 2008. Vol. 26. P.2497–2504.
29. Bolla M., de Reijke T.M., Van Tienhoven G. et al. Duration of androgen suppression in the treatment of prostate cancer // N Engl J Med. 2009. Vol. 360. P.2516–2527.
30. Jones C.U., Hunt D., McGowan D.G. et al. Radiotherapy and short-term androgen deprivation for localized prostate cancer // N Engl J Med. 2011. Vol. 365. P.107–118.
31. Van Poppel H., Joniau S. An analysis of radical prostatectomy in advanced stage and high-grade prostate cancer // Eur Urol. 2008. Vol. 53. P.253–259.
32. de Bono J.S., Logothetis C.J., Molina A. et al. Abiraterone and increased survival in metastatic prostate cancer // N Engl J Med. 2011. Vol. 364. P.1995–2005.
33. Spahn M., Joniau S., Gontero P. et al. Outcome predictors of radical prostatectomy in patients with prostate-specific antigen greater than 20 ng/ml: a European multi-institutional study of 712 patients // Eur Urol. 2010. Vol. 58. P.1–11.
34. Bolla M., van Poppel H., Tombal B. et al. Postoperative radiotherapy after radical prostatectomy for high-risk prostate cancer: long-term results of a randomised controlled trial (EORTC trial 22911) // Lancet Lond Engl. 2012. Vol. 380(9858). P.2018–2027.
35. Bolla M., van Poppel H., Collette L. et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911) // Lancet Lond Engl. 2005. Vol. 366. P.572–578.
36. Thompson I.M., Tangen C.M., Paradelo J. et al. Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial // JAMA. 2006. Vol. 296. P.2329–2335.
37. Thompson I.M., Tangen C.M., Paradelo J. et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term follow up of a randomized clinical trial // J Urol. 2009. Vol. 181. P.956–962.
38. Morgan S.C., Waldron T.S., Eapen L. et al. Adjuvant radiotherapy following radical prostatectomy for pathologic T3 or margin-positive prostate cancer: a systematic review and meta-analysis // Radiother Oncol. 2008. Vol. 88. P.1–9.
39. Cheng H.-W.B., Li C.-W., Chan K.-Y. et al. End-of-life characteristics and palliative care provision for elderly patients suffering from acute myeloid leukemia // Support Care Cancer. 2015. Vol. 23. P.111–116.
40. Каприн А.Д., Гафанов Р.А., Фарзат М.Ф. Неоадъювантная гормонотерапия бикалутамидом 150 мг перед проведением радикальных методов лечения у больных локализованным и местнораспространенным раком предстательной железы // Вестник Российского научного центра ренгенорадиологии Минздрава России. 2008. №8. Т.1. С.23 [Kaprin A.D., Gafanov R.A., Farzat M.F. Neoad»yuvantnaya gormonoterapiya bikalutamidom 150 mg pered provedeniem radikal’nyh metodov lecheniya u bol’nyh lokalizovannym i mestnorasprostranennym rakom predstatel’noj zhelezy // Vestnik Rossijskogo nauchnogo centra rengenoradiologii Minzdrava Rossii. 2008. №8. T.1. S.23 (in Russian)].
41. Lu-Yao G.L., Albertsen P.C., Moore D.F. et al. Survival following primary androgen deprivation therapy among men with localized prostate cancer // JAMA. 2008. Vol. 300. P.173–181.
42. Widmark A., Klepp O., Solberg A. et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial // Lancet Lond Engl. 2009. Vol. 373. P.301–308.
43. Mason M.D., Parulekar W.R., Sydes M.R. et al. Final report of the intergroup randomized study of combined androgen-deprivation therapy plus radiotherapy versus androgen-deprivation therapy alone in locally advanced prostate cancer // J Clin Oncol. 2015. Vol. 33. P.2143–2150.
44. Abdollah F., Karnes R.J., Suardi N. et al. Impact of adjuvant radiotherapy on survival of patients with node-positive prostate cancer // J Clin Oncol. 2014. Vol. 32. P.3939–3947.
45. Гафанов Р.А. Гормональная и химиотерапия у больных гормоночувствительным раком предстательной железы // Онкоурология. 2016. № 12(1). С.63-68 [Gafanov R.A. Gormonal’naja i himioterapija u bol’nyh gormonochuvstvitel’nym rakom predstatel’noj zhelezy // Onkourologija. 2016. №12(1). S.63-68 (in Russian)].
46. Eastham J.A., Kelly W.K., Grossfeld G.D. et al. Cancer and Leukemia Group B (CALGB) 90203: a randomized phase 3 study of radical prostatectomy alone versus estramustine and docetaxel before radical prostatectomy for patients with high-risk localized disease // Urology. 2003. Vol. 62. P.55–62.
47. Fizazi K., Lesaunier F., Delva R. et al. A phase III trial of docetaxel-estramustine in high-risk localised prostate cancer: a planned analysis of response, toxicity and quality of life in the GETUG 12 trial // Eur J Cancer. 2012. Vol. 48. P.209–217.
48. Sandler H. et al. A phase III protocol of androgen suppression (AS) and 3DCRT/IMRT versus AS and 3DCRT/IMRT followed by chemotherapy (CT) with docetaxel and prednisone for localized, high-risk prostate cancer (RTOG 0521) // J. Clin. Oncol. 2015. Vol. 33.
49. Schweizer M.T., Huang P., Kattan M.W. et al. Adjuvant leuprolide with or without docetaxel in patients with high-risk prostate cancer after radical prostatectomy (TAX-3501): important lessons for future trials // Cancer. 2013. Vol. 119. P.3610-8.
50. Ahlgren G. A randomized phase III trial between adjuvant docetaxel and surveillance after radical prostatectomy for high risk prostate cancer: results of SPCG12 // J Clin Oncol. 2016. Vol. 34.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/

