Содержание статьи
Введение
В настоящее время лимфома Ходжкина (ЛХ) у детей является одним из наиболее успешно поддающихся лечению онкологических заболеваний, главным образом за счет высокоэффективной химиотерапии. Общая выживаемость (ОВ) в течение 5–10 лет превышает 90%. Бессобытийная выживаемость (БСВ) колеблется в зависимости от исходного статуса больного. Если при ранних стадиях заболевания БСВ высокая и составляет более 95%, то при распространенных стадиях она снижается до 75% [1, 2]. Наиболее значимым фактором, влияющим на эффективность лечения, является объем исходной опухоли, оцениваемый по размерам конгломератов лимфатических узлов (особенно лимфатических узлов средостения) и числу зон поражения, определяющим скорость достижения полного эффекта. Скорость достижения полного эффекта достоверно коррелирует с риском развития рецидива и прогрессирования болезни [3, 4]. Последние десятилетия доля пациентов с отсутствием полного эффекта или рецидивом заболевания практически не меняется и составляет 25–35% [5, 6]. Попытки интенсификации лечения ЛХ путем повышения доз лучевой терапии привели к увеличению числа развития вторых опухолей, а также инвалидизации, связанной с отсроченными осложнениями, при отсутствии значимого прогресса показателей выживаемости [5, 7]. The German Hodgkin Lymphoma Study Group (Немецкая группа по изучению ЛХ) разработала концепцию ранней интенсификации терапии для пациентов с распространенными стадиями ЛХ и наличием факторов риска. Доказано преимущество интенсивных программ, основанных на схеме ВЕАСОРР (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин, преднизолон) в стандартных и эскалированных дозах у взрослых пациентов [6, 8]. В 1999 г. The Children’s Cancer Group (Группа по изучению рака у детей) начала проведение исследовательского протокола, основанного на интенсифицированной схеме escВЕАСОРР, среди детей с распространенными стадиями ЛХ [9]. Полученные предварительные результаты показали более высокую эффективность по сравнению с классическими схемами химиотерапии и стандартной схемой ВЕАСОРР без усиления токсичности [5, 6, 8–10]. Основные результаты подтвердили эффективность данной стратегии и показали пятилетнюю БСВ 94% [4].
Кроме достижения высоких показателей выживаемости больных ЛХ, не менее значимыми проблемами в клинической онкологии остаются обеспечение высокого качества жизни и снижение отдаленных эффектов проведенной терапии (миокардиальные и эндокринные дисфункции, развитие вторых опухолей). За счет применения интенсивных схем химиотерапии оказалось возможным редуцировать дозы последующей лучевой терапии, а при достижении раннего полного эффекта отказаться от лучевой терапии в комплексном лечении ЛХ.
Следовательно, анализ и обобщение отечественного опыта по изучению эффективности программной полихимиотерапии в лечении распространенных стадий ЛХ вызывают несомненный интерес и являются важными с научно-практической точки зрения.
Цель исследования: улучшить результаты лечения распространенных стадий ЛХ в детской когорте больных за счет интенсивной риск-адаптированной химиотерапии и дифференцированного подхода в назначении лучевой терапии.
Материал и методы
Характеристика пациентов
С 01.11.2003 по 01.06.2019 по протоколу ЛХ-2007 НИИ ДОГ (НИИ детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»), основанному на режиме escBEACOPP, было пролечено 134 ребенка с впервые диагностированной ЛХ. Всем детям была установлена IV стадия заболевания или II–III стадия с наличием большой опухолевой массы (опухолевые конгломераты ≥10 см в диаметре или опухоль средостения, занимающая более 1/3 диаметра грудной клетки на уровне средостения). Преобладали дети пубертатного возраста (табл. 1). Соотношение мальчиков и девочек — 1:1,06.
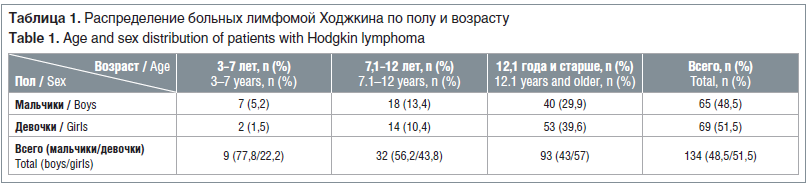
У всех детей диагноз ЛХ был подтвержден при гистологическом исследовании опухолевой ткани, у 75,4% — диагноз подтвержден иммунологически. Преобладал морфологический вариант нодулярного склероза (88,8%).
Для стадирования ЛХ использовалась классификация Ann Arbor в модификации Cotswold (1989 г.). Было выявлено превалирование IV стадии заболевания в 47,8% случаев, III стадия диагностирована в 20,9% случаев, II (с большой опухолевой массой) — в 31,3% случаев. Симптомы интоксикации полностью отсутствовали у 31,3% пациентов, были представлены температурной реакцией у 77 (59,7%) пациентов, снижением массы тела у 32 (23,9%), кожным зудом и потливостью у 17,2% и 18,7% пациентов соответственно. Сочетание двух и более симптомов отмечено у 40 (29,9%) пациентов.
Методы обследования
Для выявления очага первичного опухолевого роста и оценки степени распространения процесса всем детям проведено обследование, включавшее: тщательный сбор анамнеза, клинический осмотр, исследование гемограммы и биохимических показателей сыворотки крови, цитологическое исследование костномозгового пунктата и пунктата пораженного лимфатического узла, морфо-иммунологическое исследование. Кроме того, в обследование входил также комплекс лучевых методов диагностики: рентгенологическое исследование органов грудной клетки, ультразвуковая томография зон периферических лимфатических узлов, переднего средостения, брюшной полости, забрюшинного пространства, малого таза, рентгеновская компьютерная томография органов грудной клетки (РКТ), радиоизотопное исследование всего тела с цитратом галлия, радиоизотопное исследование костной системы с 99мТс-технефором, позитронная эмиссионная томография (ПЭТ) с 18F-фтордезоксиглюкозой (табл. 2). При оценке эффекта терапии ПЭТ проводилась с визуальным анализом данных по пятибалльной шкале (Deauville, 2009).
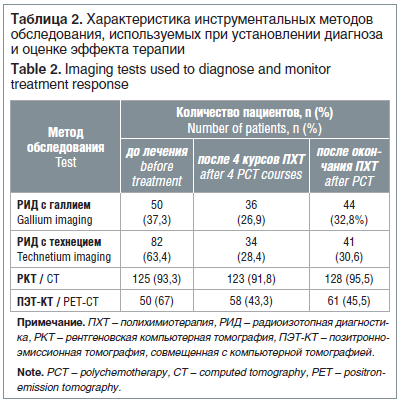
Наиболее частой зоной поражения были лимфатические узлы средостения — у 127 (94,8%) пациентов. Поражение лимфатических узлов выше уровня диафрагмы зафиксировано у 71 (53%) пациента, ниже — у 1 (0,7%). Зоны по обе стороны диафрагмы были поражены у 62 (46,3%) пациентов.
Перед началом каждого цикла химиотерапии проводилась оценка эффекта с помощью УЗИ зон первично выявленного поражения, а также рентгенография грудной клетки или рентгеновская компьютерная томография с контрастированием в случаях внутригрудной локализации.
После 4 курсов химиотерапии повторялся весь комплекс первичного обследования. Критерии оценки эффекта были следующими:
Полный эффект (ПЭ): отсутствие всех проявлений заболевания, в т. ч. выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
Частичный эффект 1 (ЧЭ-1): купирование симптомов интоксикации, сокращение опухолевой массы на 70% и более, нормальное распределение 67Ga, отсутствие очагов в легких, снижение уровня накопления 99mTc в костях, DC (шкала Deauville) менее 4 по ПЭТ-КТ.
Частичный эффект 2 (ЧЭ-2): купирование симптомов интоксикации, сокращение размеров опухоли во всех локализациях более чем на 50%, DC — 4 и менее по ПЭТ-КТ.
Стабилизация болезни: отсутствие критериев ПЭ, ЧЭ или прогрессирования.
Прогрессирование болезни (ПБ): любой значимый рост опухоли или появление новых локализаций, подтвержденных морфологически.
Программа лечения
Всем детям с распространенными стадиями ЛХ проводилась индукция ремиссии, состоящая из 4 курсов химиотерапии в режиме escВЕАСОРР: блеомицин 10 Ед/м2 внутривенно (в/в) 8-й день, этопозид 200 мг/м2 в/в капельно 1, 2, 3-й дни, доксорубицин 35 мг/м2 в/в капельно 1-й день, циклофосфамид 1200 мг/м2 в/в капельно 1-й день, винкристин 2 мг/м2 в/в 8-й день, прокарбазин 100 мг/м2 внутрь 1–7-й дни, преднизолон 20 мг/м2 внутрь 1–14-й дни. Особенностью предложенной терапии было снижение по сравнению со стандартными режимами химиотерапии суммарной дозы прокарбазина на 50%, преднизолона на 50%, доксорубицина до 35 мг/м2 вместо 50 мг/м2 и лучевой терапии до 20 Гр при сокращении опухоли более 70% после 4 курсов и полном ответе после 8 курсов химиотерапии.
Дальнейшее лечение зависело от полноты достигнутого эффекта (рис. 1) и различалось у мальчиков и девочек. Мальчики, у которых эффект от 4 курсов escВЕАСОРР был расценен как ПЭ или ЧЭ-1, получали 2 курса в стандартном режиме ABVD (доксорубицин 25 мг/м2, блеомицин 10 МЕ/м2, винбластин 6 мг/м2, дакарбазин 375 мг/м2) с последующим облучением зон первично выявленного поражения в суммарной очаговой дозе (СОД) 20 Гр. Девочки в этой ситуации получали еще 4 курса химиотерапии COPP/ABV (циклофосфамид 600 мг/м2 в/в капельно 1-й день, винкристин 1,4 мг/м2 в/в 1-й день, прокарбазин 100 мг/м2 внутрь 1–7-й дни, преднизолон 20 мг/м2 внутрь 1–14-й дни, доксорубицин 35 мг/м2 в/в капельно 8-й день, блеомицин 10 Ед/м2 в/в 8-й день, винбластин 6 мг/м2 в/в 8-й день). Консолидирующая лучевая терапия девочкам не проводилась.
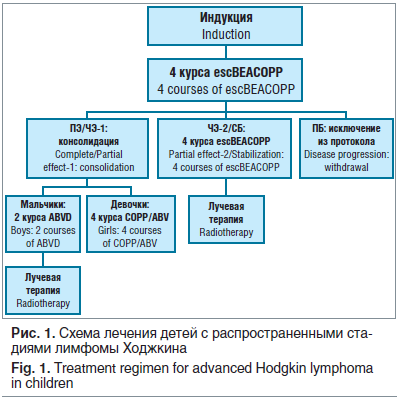
Если эффект лечения оценивался как ЧЭ-2, то независимо от пола проводилось еще 4 курса escВЕАСОРР с последующим облучением в СОД 20–30 Гр. Прогрессирование ЛХ являлось показанием для исключения из исследования.
Результаты исследования
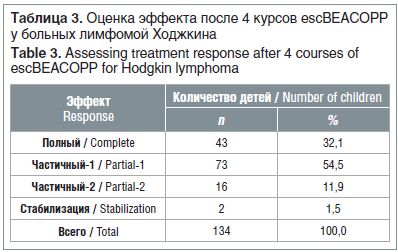
Наиболее быстрое достижение полного эффекта в результате проводимой химиотерапии у детей с ЛХ позволяет надеяться на более высокую выживаемость, а также снижает интенсивность дальнейшей химиотерапии. Оценка эффекта после 4 курсов химиотерапии по схеме escВЕАСОРР показала, что у 116 (86,6%) детей достигнуто сокращение объема опухоли более чем на 70%. У 8 детей из этой группы, несмотря на хороший ответ на лечение, сохранялись очаги в паренхиме легких, что потребовало проведения дополнительных 4 курсов химиотерапии escBEACOPP. Также дополнительные 4 курса химиотерапии escBEACOPP были проведены пациентам с ЧЭ-2. У двух пациентов наблюдалась стабилизация болезни и в дальнейшем отмечено рефрактерное течение ЛХ (табл. 3).
Из 134 больных у 9 (6,7%) зарегистрирован рецидив ЛХ в зонах первичного поражения, у 2 (1,5%) зафиксирована рефрактерная форма ЛХ. Один (0,7%) ребенок умер во время консолидирующей лучевой терапии в состоянии полной ремиссии от двусторонней пневмонии и сепсиса. У остальных (91,1%) детей сохраняется состояние полной ремиссии.
БРВ составила 92,2±2,4%, БСВ — 90,7±2,6%, средняя продолжительность наблюдения — 177,1±4,6 мес., ОВ — 97,7±1,3%, средняя продолжительность наблюдения — 189,7±2,4 мес. (рис. 2).
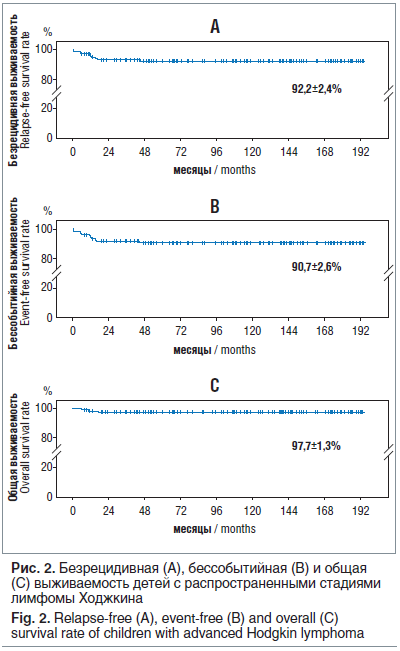
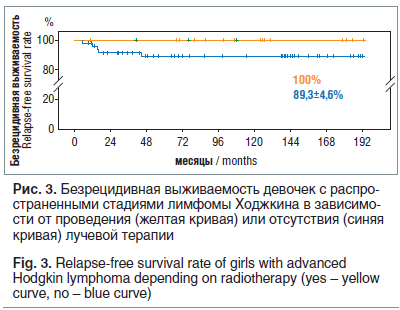
Не было отмечено разницы между БСВ, БРВ и ОВ у мальчиков и девочек. Одной из особенностей протокола было исключение лучевой терапии у 47 девочек с достигнутой ПЭ и ЧЭ-1. Рецидив заболевания в этой группе больных развился у 5 девочек: 2 поздних рецидива, 2 ранних (до 1 года от окончания лечения), 1 сверхранний. Все рецидивы возникли в зоне первичного поражения. ОВ в группе 47 девочек составила 98,5±1,5%: без лучевой терапии — 100%, с лучевой терапией — 90,9±8,7%. БРВ девочек — 92,1±3,4%: без лучевой терапии — 89,3±4,6%, с лучевой терапией — 100% (рис. 3).
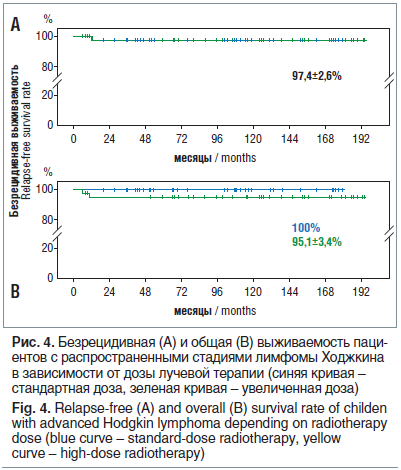
Согласно протоколу лучевую терапию получили 80 пациентов: в стандартных дозах (СОД 20 Гр на области первичного поражения) — 36 (47,5%), с увеличением доз (СОД 26–30 Гр) — 42 (52,5%) пациента. Не отмечено разницы между БРВ у этих групп (97,4±2,6%) (рис. 4А), ОВ при облучении в стандартных дозах составила 100%, в группе с увеличением дозы — 95,1±3,4% (рис. 4В).
Токсичность
Проведение химиотерапии по схеме escВЕАСОРР вызывало главным образом гематологическую токсичность. У всех детей отмечено снижение количества лейкоцитов и гранулоцитов периферической крови в той или иной степени. В 85% случаев наблюдалось снижение количества лейкоцитов III–IV степени (ниже 1,9×109/л), в 95% случаев отмечена гранулоцитопения ниже 0,9×109/л. Глубокая тромбоцитопения (<25×109/л) и анемия (гемоглобин <65 г/л) регистрировались в единичных случаях, и только после проведения 8 курсов escВЕАСОРР. Также в единичных случаях отмечены токсическая энтероколопатия и незначительная гепатотоксичность.
Обсуждение
Достижение быстрого и полного эффекта — необходимое условие на пути к излечению, независимо от применяемой программы. В результате у детей, получавших более интенсивную терапию, полный эффект достигался в более ранние сроки и в большем числе случаев, что позволило отдать преимущество этим программам. Уменьшение длительности терапии также оказалось немаловажным условием.
Наиболее широко распространенным протоколом неинтенсивной химиотерапии является GPOH-HD95, разработанный G. Schellong et al. Результаты лечения пациентов по данному протоколу оказались неудовлетворительными для группы с распространенными стадиями ЛХ (ОВ — 82,6±5,4%, БРВ — 88,7±2,0%) [11]. Одним из режимов временнóй и дозовой интенсивности при поддержке колониестимулирующими факторами (КСФ) являлся режим Stanford V. Результаты показали более высокую (89%) пятилетнюю выживаемость без прогрессирования ЛХ и ОВ — 96% [12]. Режим escBEACOPP предполагал также повышение интенсивности за счет сокращения интервала между курсами химиотерапии с помощью КСФ. Протоколы на основе данного режима показали высокие результаты и более ранние сроки выхода в ремиссию при отсутствии увеличения токсичности и крайне редком назначении КСФ. В представленном исследовании выживаемость детей с исходной большой опухолевой массой оказалась существенно выше (БРВ — 92,2±2,4% и ОВ — 97,7±1,3%). Кроме того, у девочек с ПЭ и ЧЭ-1 удалось избежать лучевой терапии без уменьшения общей выживаемости. Хотя у 5 девочек развился рецидив заболевания в местах первичного поражения на различных сроках наблюдения, все они достигли повторной ремиссии в результате противорецидивной терапии и живы без повторного рецидива. Быстрое и полное достижение повторных ремиссий у девочек и их выздоровление, скорее всего, обусловлено исключением лучевой терапии при первичном лечении и возможностью использования этого вида терапии при рецидиве ЛХ.
Таким образом, подтверждается гипотеза о большем значении интенсивной химиотерапии в индукции ремиссии при лечении детей с распространенными стадиями ЛХ, чем более длительной и неинтенсивной комбинированной терапии. Отсутствие увеличения токсичности при интенсификации химиотерапии, возможно, обусловлено снижением суммарной дозы прокарбазина, доксорубицина и преднизолона.
Заключение
Лечение детей с распространенными стадиями ЛХ по протоколу ЛХ-2007 НИИ ДОГ, основанному на схеме escВЕАСОРР, показало высокую эффективность и относительно приемлемую токсичность, заключающуюся главным образом в панцитопении периферической крови. Кроме того, благодаря более интенсивной химиотерапии удалось избежать лучевой терапии у 47 девочек, что, возможно, в будущем сократит вероятность развития у них опухоли молочных желез.
Полученные результаты позволяют рекомендовать данный протокол для лечения детей с распространенной ЛХ с исходной большой массой опухоли.
Литература/References
1. Kelly K.M. Hodgkin lymphoma in children and adolescents: improving the therapeutic index. Bloode. 2015;126:514–521. DOI: 10.1182/asheducation-2015.1.514.
2. Mauz-Körholz C., Metzger M.L., Kelly K.M. et al. Pediatric Hodgkin Lymphoma. J. Clin Oncol. 2015:33:2975–2985. DOI: 10.1200/JCO.2014.59.4853.
3. McCarten K.M., Nade H.R., Shulkin B.L., Cho S.Y. Imaging for diagnosis, staging and response assessment of Hodgkin lymphoma and non-Hodgkin lymphoma. Pediatric Radiology. 2019:49:1545–1564. DOI: 10.1007/s00247-019-04529-8.
4. Kelly K.M., Sposto R., Hutchinson R. et al. BEACOPP chemotherapy is a highly effective regimen in children and adolescents with high-risk Hodgkin lymphoma: a report from the Children’s Oncology Group. Bloode. 2011;117(9):2596–2603. DOI: 10.1182/blood-2010-05-285379.
5. Arya L.S., Dinand V. Current strategies in the treatment of childhood Hodgkin’s disease. Indian Pediatr. 2005:42:1115–1128. PMID: 16340052.
6. Diehl V., Franklin J., Pfeundschuh M. et al. Standart and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin’s disease. N. Engl. J. Med. 2003:348:2386–2395. DOI: 10.1056/NEJMoa022473.
7. lleman B.M.P., Raemaekers J.M.M., Tirelli U. et al. Involved-field radiotherapy for advanced Hodgkin’s lymphoma. N. Engl. J. Med. 2003:348:2396–2406. DOI: 10.1056/NEJMoa022628.
8. Klimm B., Diehl V., Pfisther B. et al. Current treatment strategies of the German Hodgkin Study Group (GHSG). Eur J Haematol. 2005:75(Suppl. 1):125–134. DOI: 10.1111/j.1600-0609.2005.00466.x.
9. Kelly K.M., Hutchinson R.J., Sposto R. et al. Feasibility of upfront dose-intensive chemotherapy in children with advanced-stage Hodgkin’s lymphoma: preliminary results from the Children’s Cancer Group Study CCG-59704. Annals of Oncology. 2002:13(Suppl. 1):107–111. DOI: 10.1093/annonc/13.S1.107.
10. Gomez-Almaguer D., Gonzalez-Liano O., Jimenez-Antolinez V. et al. Treatment of classical Hodgkin’s lymphoma in children and adolescents. Expert Opinion on Pharmacotherapy. 2019:20:1227–1234. DOI: 10.1080/14656566.2019.1606212.
11. Dörffel W., Rühl U., Lüders H. et al. Treatment of children and adolescents with Hodgkin lymphoma without radiotherapy for patients in complete remission after chemotherapy: final results of the multinational trial GPOH-HD95. J Clin Oncol. 2013:31:1562. DOI: 10.1200/JCO.2012.45.3266.
12. Horning S., Hoppe R., Breslin S. et al. Stanford V and radiotherapy for locally extensive and advanced Hodgkin’s disease: mature results of a prospective clinical trial. J Clin Oncol. 2003:20(4):630–637. DOI: 10.1200/JCO.20.3.630.
Сведения об авторах:
1Беляева Елена Сергеевна — к.м.н., детский онколог отделения детской химиотерапии гемобластозов отдела гематологии и трансплантации костного мозга, ORCID iD 0000-0002-5303-8411;
1,2Сусулева Наталья Александровна — д.м.н., детский онколог отделения детской химиотерапии гемобластозов отдела гематологии и трансплантации костного мозга, профессор кафедры детской онкологии им. академика Л.А. Дурнова, ORCID iD 0000-0002-0678-1720;
1,2Валиев Тимур Теймуразович — д.м.н., заведующий отделением детской химиотерапии гемобластозов отдела гематологии и трансплантации костного мозга, профессор кафедры детской онкологии им. академика Л.А. Дурнова, ORCID iD 0000-0002-1469-2365.
1НИИ детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. 115478, Россия, г. Москва, Каширское ш., д. 24.
2ФГБОУ ДПО РМАНПО Минздрава России. 123995, Россия, г. Москва, ул. Баррикадная, 2/1.
Контактная информация: Беляева Елена Сергеевна, e-mail: lena-333@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 11.01.2020.
About the authors:
1Elena S. Belyaeva — MD, PhD, pediatric oncologist of the Department of Pediatric Hemoblastosis Chemotherapy of the Division of Hematology and Bone Marrow Transplantation, ORCID iD 0000-0002-5303-8411;
1,2Natal’ya A. Susuleva — MD, PhD, pediatric oncologist of the Department of Pediatric Hemoblastosis Chemotherapy of the Division of Hematology and Bone Marrow Transplantation, Professor of Academician L.A. Durnov Department of Pediatric Oncology, ORCID iD 0000-0002-0678-1720;
1,2Timur T. Valiev — MD, PhD, Head of the Department of Pediatric Hemoblastosis Chemotherapy of the Division of Hematology and Bone Marrow Transplantation, Professor of Academician L.A. Durnov Department of Pediatric Oncology, ORCID iD 0000-0002-1469-2365.
1Scientific Research Center of Pediatric Oncology and Hematology of the N.N. Blokhin National Medical Research Center of Oncology. 23, Kashirskoe Road, Moscow, 115478, Russian Federation.
2Russian Medical Academy of Continuous Professional Education. 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation.
Contact information: Elena S. Belyaeva, e-mail: lena-333@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 11.01.2020.
.
Информация с rmj.ru





