Хронический болевой синдром продолжает оставаться одной из важных медико-социальных проблем современного общества, поскольку значимо влияет на функциональную активность и трудоспособность пациентов, существенно дезадаптирует и снижает качество жизни от 15% до 40% людей в экономически развитых странах [1] и связан с увеличением смертности и повышенной заболеваемостью [2–6]. Неврологические заболевания являются одной из ведущих причин возникновения и хронизации боли.
Невропатическая боль (НБ) — один из распространенных вариантов хронического болевого синдрома [7], наблюдается вследствие поражения или заболевания центральной или периферической соматосенсорной нервной системы на любом уровне и встречается в популяции в 7–10% случаев [8]. НБ отличается характерным клиническим паттерном и многообразием сенсорных проявлений и симптомов, большей интенсивностью и длительностью болевого синдрома, хроническим и чаще рецидивирующим течением и сопровождается разнообразными коморбидными патологическими состояниями, что в итоге формирует сложную для диагностики полиморфную картину болевого синдрома. Вместе с тем анализ предъявляемых жалоб, история повреждения или заболевания соматосенсорной нервной системы, данные осмотра пациента, а также результаты дополнительных методов обследования, объективно подтверждающих поражение соматосенсорной системы, способное привести к возникновению НБ, позволяют выявить данный вариант болевого синдрома.
Основные принципы клинической диагностики НБ [с измен. 9, 10]:
Внимательно выслушать, как пациент описывает боль — характерные словесные характеристики: «жжение», «горение», «прострелы», «удары током», «покалывание», «онемение», «жгучие» и т. д.
При неврологическом осмотре обратить внимание, есть ли у пациента характерные нарушения чувствительности — сочетание «позитивных» (симптомов раздражения — гипестезии, анестезии, гипалгезии, аналгезии) и «негативных» (симптомов выпадения — спонтанной боли, дизестезии, парестезии, аллодинии, гипералгезии) сенсорных феноменов.
При анализе болевого синдрома соотнести, совпадает ли зона предъявляемой боли с выявленными нарушениями чувствительности; локализация описанного болевого синдрома соответствует определенной нейроанатомической зоне — зоне иннервации соответствующей нервной структуры.
Пациент с хроническим болевым синдромом всегда представляет для врачей непростую клиническую задачу, что в том числе связано с наличием разнообразной коморбидной патологии, в частности тревожных и депрессивных нарушений, негативно влияющих на эффективность проводимого лечения и значимо снижающих комплаентность этой категории больных. Особенно трудными и «неудобными» в этой связи пациентами являются больные с хронической НБ, поскольку данный вариант болевого синдрома поздно диагностируется, хуже поддается терапии, отличается рецидивирующим течением и лишь немногим пациентам удается полностью купировать боль. В подавляющем большинстве случаев у пациентов с хронической НБ наблюдаются коморбидные состояния и заболевания, весомо утяжеляющие и без того мучительное существование этих больных [10].
Наиболее эффективным и стратегически оправданным при ведении пациентов с хронической НБ является комплексный и мультидисциплинарный подход, подразумевающий фармакологическую терапию препаратами с доказанной эффективностью, немедикаментозные методы лечения и терапию коморбидных расстройств, особенно тревожных, депрессивных проявлений и нарушения сна. Лишь при недостаточной эффективности указанных направлений терапии применяют малоинвазивные и хирургические методы лечения. Следует отметить, что фармакотерапия хронической НБ должна проводиться длительно и непрерывно, с учетом нозологии, коморбидности и выбора наиболее безопасного лекарственного средства. Начинать терапию следует с минимальных доз препарата с плавной титрацией до терапевтически эффективных, проводить анализ переносимости и параллельный мониторинг побочных или нежелательных явлений [11]. Среди препаратов первой линии терапии рассматриваются лекарственные средства из группы антиконвульсантов (габапентин и прегабалин), селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) (дулоксетин и венлафаксин) и трициклических антидепрессантов (амитриптилин, нортриптилин и имипрамин) [10].
При выборе лекарственного средства важно учитывать патогенетические механизмы формирования и поддержания хронического болевого синдрома, среди которых несомненную и важную роль играют нарушенное взаимодействие ноцицептивной и антиноцицептивной систем и феномен дезингибиции, наблюдающийся при недостаточной функциональной активности нисходящих антиноцицептивных влияний. И чем дольше существует и более выражен этот патологический процесс, тем более мучительный характер рецидивирующей боли может наблюдаться у пациента [12]. Основными медиаторами антиноцицептивной системы являются биогенные амины: эндорфины, серотонин, норадреналин и дофамин, поэтому лекарственные средства, которые активизируют и нормализуют их обмен, усиливают таким образом функциональную активность антиноцицептивной системы, что приводит к снижению интенсивности и частоты возникновения боли. Это наркотические анальгетики, трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина (СИОЗС) и СИОЗСН, причем именно антидепрессанты из группы СИОЗСН оказались эффективными и наиболее перспективными для терапии пациентов с хроническим болевым синдромом. Следует заметить, что из существующих на российском рынке препаратов из этой группы дулоксетин обладает большим сродством к рецепторам норадреналина, что предполагает большую эффективность этого лекарственного средства в терапии хронической боли [13]. Проведенные исследования [14–16] убедительно продемонстрировали выраженное влияние дулоксетина на серотонинергические и норадренергические системы, что повышает функциональную активность нисходящей системы подавления боли и оказывает обезболивающее действие независимо от его антидепрессивного эффекта. Именно поэтому изначально рассматриваемый в качестве антидепрессанта [17] дулоксетин достаточно быстро начал использоваться в терапии хронического болевого синдрома при широком спектре различных заболеваний. Многочисленные клинические исследования показали выраженный терапевтический эффект дулоксетина при лечении пациентов с остеоартритом [18–20], болью в нижней части спины [19, 21–23], болевой формой диабетической нейропатии [19, 24–28], фибромиалгией [19, 24], а также другими заболеваниями и патологическими состояниями, сопровождающимися хронической болью [29–32].
Содержание статьи
Болевая форма диабетической невропатии
При болевой форме диабетической невропатии применяется целый ряд фармакологических средств для лечения хронической НБ, сравнение эффективности которых в одном из последних метаанализов [24] рандомизированных контролируемых исследований (РКИ) продемонстрировало высокий результат дулоксетина. Клиническая эффективность дулоксетина убедительно показана в большом количестве исследований пациентов с хроническим болевым синдромом, обусловленным диабетической невропатией [19, 24–28, 30]. В частности, Кохрановский обзор 8 исследований применения у 2728 пациентов дулоксетина в суточной дозе 60 мг продемонстрировал его эффект даже при крат-косрочной терапии в течение 12 нед. в виде уменьшения выраженности боли на 50% и более (ОР 1,73, 95% ДИ 1,44–2,08) [24]. При этом побочные явления достоверно не отличались от таковых в группе плацебо, не наблюдалось серьезных нежелательных реакций [24]. В другом многоцентровом 6-месячном сравнительном проспективном исследовании эффективности дулоксетина, габапентина и прегабалина более высокая эффективность при купировании болевого синдрома, согласно краткому опроснику оценки боли BPI (англ. Brief Pain Inventory), была обнаружена у дулоксетина, как и достоверное уменьшение при его приеме выраженности тревоги и депрессии, согласно Госпитальной шкале тревоги и депрессии HADS (англ. Hospital Anxiety and Depression Scale) [25].
Следует заметить, что анальгетический эффект дулоксетина развивается гораздо раньше, чем антидепрессивный, что продемонстрировано в мультицентровом двойном слепом плацебо-контролируемом исследовании 348 пациентов с болевой формой диабетической нейропатии при сахарном диабете обоих типов, кроме того, препарат не оказывал влияния на контроль сахарного диабета и хорошо переносился [26]. Полученные результаты доказывают значимое влияние дулоксетина на основные патогенетические механизмы формирования хронической боли — процессы дезингибиции, нормализуя таким образом нисходящий контроль боли, а не уменьшение выраженности болевого синдрома посредством лечения только депрессивных нарушений, практически облигатно наблюдающихся у больных с длительным болевым синдромом. Об указанных особенностях дулоксетина следует сообщать пациентам до начала терапии, что позволит улучшить приверженность данной терапии и дальнейшие взаимоотношения врача и пациента. Немаловажно отметить, что у большинства пациентов с сахарным диабетом наблюдаются сердечно-сосудистые нарушения, поэтому применение дулоксетина более безопасно и предпочтительно, в частности, по сравнению с амитриптилином [26, 33].
Хронический болевой синдром в нижней части спины
Боль в нижней части спины продолжает оставаться одной из наиболее актуальных проблем современного человека и частой причиной обращения к врачу. Среди пациентов с хронической болью в нижней части спины (ХБНС) признаки невропатической боли наблюдаются в среднем в 37% случаев [21], однако наблюдаемая в клинической практике низкая диагностика НБ предполагает гораздо больший процент ее наличия.
Анализ данных 4 многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследований применения дулоксетина для лечения ХБНС у 1295 пациентов в суточной дозе 60 мг на протяжении 12–14 нед. показал наибольшую эффективность данного препарата в виде большего количества пациентов, у которых наблюдалось снижение боли на 30% и более на момент завершения лечения относительно исходного уровня (59,7% по сравнению с 47,8% в группе плацебо, р<0,001), а также большего снижения степени выраженности боли — на 50% и более (48,6% в сравнении с группой плацебо 35,1%; р<0,001) [21]. Следует отметить, что у этих больных определялись минимальные депрессивные нарушения (низкие баллы по шкале оценки депрессии Бека). Важно заметить, что предикторами наибольшей эффективности дулоксетина, по мнению исследователей, были ранний ответ на терапию — в первые 2 нед. от ее начала (улучшение не менее чем на 15%, согласно опроснику BPI), применение в суточной дозе 60 мг и наличие боли в нескольких областях [21]. Любопытно, что другие исследователи, помимо раннего ответа при приеме дулоксетина в суточной дозе 60 мг, отмечали в качестве предиктора его дальнейшего клинического эффекта у пациентов с ХБНС возникновение побочных реакций на начальном этапе терапии [22].
Другой анализ данных 3 двойных слепых плацебо-контролируемых исследований клинического применения дулоксетина у пациентов с ХБНС обнаружил, что значительно превосходящий плацебо анальгетический эффект дулоксетина в суточной дозе 60 мг на 91% связан с его прямым анальгетическим действием и лишь на 9% — с антидепрессивным, т. е. непрямым эффектом [23]. Полученные результаты доказывают важную роль дулоксетина в терапии хронической боли (в том числе НБ), применение которого направлено на восстановление функциональной активности нисходящих норадренергической и серотонинергической антиноцицептивных систем, что приводит к уменьшению выраженности боли, а также тревожных, депрессивных расстройств и нарушения сна. Напротив, системный анализ исследований эффективности лекарственных средств в терапии пациентов с ХБНС [34] не обнаружил разницы в анальгетическом эффекте между трициклическими антидепрессантами или препаратами из группы СИОЗС по сравнению с плацебо. В клинической практике лечение пациентов с хронической скелетно-мышечной болью, в том числе с ХБНС, начинается с суточной дозы 30 мг, через 7–10 дней прием составляет 60 мг, ряд исследователей при необходимости увеличивают суточную дозу до 120 мг [23].
В метаанализе 9 РКИ [20] эффективности и безопасности дулоксетина в терапии пациентов с ХБНС было продемонстрировано не только его влияние на выраженность боли, но и существенное улучшение функциональной составляющей, повседневной активности, эмоционального фона и качества жизни, причем не было выявлено статистически значимой разницы в серьезных нежелательных явлениях дулоксетина по сравнению с группой плацебо.
Все эти многочисленные исследования позволили включить дулоксетин в алгоритм лечения ХБНС в рекомендациях Американской коллегии врачей [35].
Хронический болевой синдром при остеоартрите
Остеоартрит (ОА) является самым частым заболеванием суставов, его ведущее проявление — хроническая боль, клинический анализ которой нередко демонстрирует характерные сенсорные проявления НБ [20]. Наиболее часто наблюдается ОА коленных суставов.
Результаты двойного слепого плацебо-контролируемого исследования [36] применения дулоксетина у пациентов с хронической болью при ОА коленного сустава показали значимое по сравнению с плацебо уменьшение выраженности боли и улучшение показателей качества жизни вне зависимости от того, какие именно нестероидные противовоспалительные препараты (НПВП) применялись ранее. По мнению исследователей, дулоксетин может рассматриваться как альтернатива применению НПВП при ОА коленного сустава, если их использование не показано в связи с имеющимися кардиоваскулярными или другими рисками [37]. Эффективность дулоксетина в купировании боли и улучшении функционирования при ОА также подтверждает системный обзор 4 рандомизированных исследований [20]. В метаанализе 3 РКИ [18] с участием 1011 пациентов было продемонстрировано статистически значимое влияние дулоксетина на уровень и частоту возникновения боли при ОА, улучшение функциональной активности, а также отсутствие значимых нежелательных или побочных явлений по сравнению с плацебо через 10–13 нед. терапии.
В другом рандомизированном двойном слепом плацебо-контролируемом исследовании [38] пациентов с ОА коленных суставов показано достоверное уменьшение боли, скованности, функциональной недостаточности и улучшение качества жизни на фоне приема дулоксетина на протяжении 14 нед. В рекомендациях Международного общества по изучению остеоартрита OARSI (англ. Osteoarthritis Research Society International) 2019 г. [39] дулоксетин рассматривается в качестве терапии ОА коленного сустава у пациентов с распространенным хроническим болевым синдромом и депрессивными нарушениями.
Другие варианты хронического болевого синдрома
Дулоксетин — единственный среди антидепрессантов в нашей стране, имеющий такие зарегистрированные показания, как болевая форма диабетической невропатии, хроническая мышечно-скелетная боль, в том числе ХБНС, ОА коленного сустава и фибромиалгия [40].
Фибромиалгия является хроническим заболеванием, характеризующимся распространенной дезадаптирующей болью, усталостью, нарушением сна и низким качеством жизни пациентов [19]. Кохрановский обзор [24] 6 исследований с участием 2249 пациентов с фибромиалгией продемонстрировал достоверный положительный эффект при применении дулоксетина в суточной дозе 60 мг в течение 12 нед. (ОР для ≥50% уменьшения боли 1,57, 95% ДИ от 1,20 до 2,06) и более 28 нед. (ОР 1,58, 95% ДИ от 1,10 до 2,27), а также его значимое влияние на физические симптомы депрессии (ОР 1,37, 95% ДИ от 1,19 до 1,59; NNTB 8, 95% ДИ от 5 до 14). Следует отметить, что большинство побочных эффектов были незначительными, серьезные нежелательные явления не отмечались [24].
В последние годы появился ряд исследований применения дулоксетина в периоперационном периоде как в виде монотерапии, так и в сочетании с эторикоксибом, что позволяет достоверно снизить выраженность послеоперационной боли и уменьшить потребность в опиоидных средствах без существенных побочных эффектов [32], при хронической послеоперационной боли после эндопротезирования коленного сустава [31] и поясничной ламиноэктомии [29], что влияет на течение болевого синдрома и способствует лучшему дальнейшему функциональному восстановлению, а также при других заболеваниях, сопровождающихся хроническим болевым синдромом [30, 32].
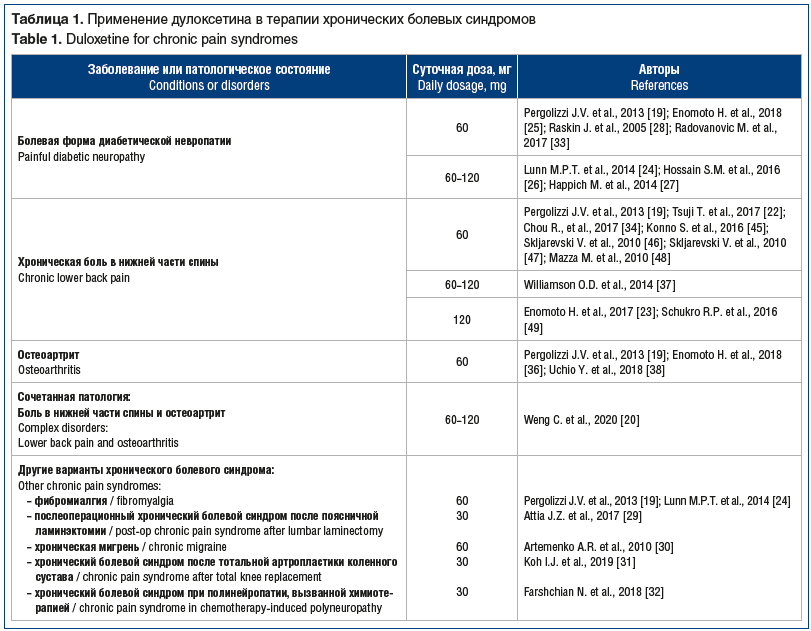
Дулоксетин обладает хорошим профилем безопасности, в частности наличием минимальных кардиоваскулярных рисков по сравнению с рядом других широко применяемых антидепрессантов [26, 33, 41], незначительным влиянием на сексуальные функции [42] и повышение веса [43], что, безусловно, позволяет применять дулоксетин у пациентов молодого и пожилого возраста при широком спектре заболеваний, сопровождающихся хронической болью, особенно НБ. Наиболее частыми побочными явлениями при применении дулоксетина являются тошнота, головокружение и головная боль, которые возникают в первые 1–2 нед. терапии, при этом наблюдается уменьшение их выраженности или отсутствие в дальнейшем при продолжении лечения, даже без коррекции дозы препарата [44] (табл. 1).
Как известно, эффективность лечения во многом зависит от приверженности пациента рекомендуемой терапии, что, безусловно, связано с удобством приема лекарственного средства и стоимостью общего курса терапии. В настоящее время на российском рынке появился новый препарат с действующим веществом дулоксетин — Депратал® (компания «Адамед») с удобной таблетированной формой выпуска и доступной ценой. Препарат представлен в двух дозировках — 30 мг и 60 мг, что позволяет рационально использовать его при титровании дозы и при выборе необходимой суточной дозы в процессе терапии и при ее постепенном завершении (табл. 2).
![Таблица 2. Применение препарата Депратал® в терапии хронических болевых синдромов [40] Table 2. Depratal® for chronic pain syndromes [40] Таблица 2. Применение препарата Депратал® в терапии хронических болевых синдромов [40] Table 2. Depratal® for chronic pain syndromes [40]](https://medblog.su/wp-content/uploads/2021/11/1636321570_835_vozmozhnosti-duloksetina-v-terapii-patsientov-s-hronicheskoj-bolyu-ekusheva-e-v.png)
Важно отметить, что курс терапии препаратом Депратал® у пациентов с хронической болью должен составлять не менее 10–12 мес., поскольку при более коротком курсе увеличивается риск рецидивов. Его применение не вызывает лекарственной зависимости при длительном приеме, о чем необходимо неоднократно информировать пациента и его родственников.
Таким образом, применение дулоксетина является эффективной, безопасной и патогенетически обоснованной терапией широкого спектра заболеваний, сопровождающихся хронической болью, часто представляющих нелегкую задачу для практикующего врача, а также позволяет значимо повлиять на сопутствующие тревожные, депрессивные расстройства и нарушение сна у этой категории пациентов [14, 17].
Благодарность
Редакция благодарит АО «Адамед Фарма» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
Acknowledgment
The Editorial Board is grateful to ADAMED for providing full-text foreign articles required to write the review.
Сведения об авторе:
Екушева Евгения Викторовна — д.м.н., профессор, заведующая кафедрой нервных болезней и нейрореабилитации Академии постдипломного образования Федерального государственного бюджетного учреждения «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства»; 125371, Россия, г. Москва, Волоколамское шоссе, д. 91; ведущий научный сотрудник лаборатории «Проблемы старения» ФГАОУ ВО «Белгородский государственный национальный исследовательский университет», 308015, Россия, г. Белгород, ул. Победы, д. 85; ORCID iD 0000-0002-3638-6094.
Контактная информация: Екушева Евгения Викторовна, e-mail: ekushevaev@mail.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.07.2021.
Поступила после рецензирования 28.07.2021.
Принята в печать 20.08.2021.
About the author:
Evgeniya V. Ekusheva — Dr. Sc. (Med.), Professor, Head of the Department of Nervous Diseases and Neurorehabilitation of the Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical Biological Agency of Russian Federation, 91, Volokolamskoe road, Moscow, 125371, Russian Federation; leading researcher of the laboratory «Issues of Aging», Belgorod State National Research University, 85, Pobedy str., Belgorod, 308015, Russian Federation; ORCID iD 0000-0002-3638-6094.
Contact information: Evgeniya V. Ekusheva, e-mail: ekushevaev@mail.ru.
Financial Disclosure: the author has no financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 05.07.2021.
Revised 28.07.2021.
Accepted 20.08.2021.
.
Информация с rmj.ru






