|
Задержка роста плода (ЗРП) возникает, когда плод не реализует свой генетический потенциал роста, и размеры его не соответствуют нормативам для данного срока беременности. Ранее ЗРП определялась как масса плода ниже 10-го процентиля для срока гестации. В настоящий момент пороговым значением является 3-й перцентиль или сочетание массы менее 10-го перцентиля и нарушения кровотока в артерии пуповины. Плод с массой менее 10-го перцентиля, но с нормальным кровотоком в артерии пуповины называют малым для гестационного возраста. |
Задержка роста плода занимает одно из лидирующих мест в структуре перинатальной заболеваемости и смертности [1–5]. Примерно 5–10% всех беременностей протекают с этим патологическим состоянием. Эффективных методов лечения ЗРП на данный момент не существует, поэтому усилия акушеров-гинекологов и специалистов медицины плода сконцентрированы на прогнозировании и профилактике данного патологического состояния [6]. Качественное прогнозирование и своевременная профилактика ЗРП существенно снижают медико-экономические затраты, связанные с лечением и реабилитацией детей1 [7, 8].
В основе патогенеза и преэклампсии (ПЭ), и ЗРП лежит плацентарная недостаточность. Важнейшим этапом развития данного патологического процесса является нарушение инвазии трофобласта:
усиливается апоптоз клеток трофобласта, который индуцируется факторами роста и цитокинами;
подавляется дифференцировка клеток;
скапливаются регуляторные Т-лимфоциты.
Маркером данных патологических состояний является нарушение синтеза сосудистых факторов роста [9–11]. Продолжает активно изучаться роль факторов ангиогенеза в формировании плаценты [9, 12–14]. Основную роль как в стимулировании, так и в подавлении ангиогенеза играют представители семейства сосудисто-эндотелиального фактора роста (VEGF) и фактора роста фибробластов [2, 9, 10, 15, 16].
Семейство VEGF регулирует развитие плаценты, рост сосудистой сети ворсинок и базальной пластинки, оно влияет на инвазию цитотрофобласта, обеспечивая нормальную трансформацию спиральных артерий, т. е. определяет становление полноценного маточно-плацентарного кровотока [9].
Из семейства VEGF в организме человека основным является VEGF-А. Вырабатывают его активированные эндотелиальные и другие эпителиальные клетки, моноциты, гладкомышечные клетки, а также клетки трофобласта [10, 11, 14]. Во время же беременности ведущим представителем семейства VEGF становится плацентарный фактор роста (PlGF), который по структуре очень схож с VEGF-А. Впервые его обнаружили в трофобласте, но синтезируется он не только в нем [17]. Синтез PlGF находящимися в покое эндотелиальными клетками очень невелик, но при активации клеток выработка PlGF быстро увеличивается, что приводит к активации ангиогенеза. Недостаточная выработка данного фактора способствует воспалению, ишемии и нарушению процессов репарации в тканях. В процессе эмбриогенеза участие PlGF не доказано [11, 18–21]. Основной функцией PlGF, вероятно, является регуляция развития сосудов плаценты. PlGF синтезируется в клетках ворсинчатого синцитиотрофобласта и в сосудах стволовых ворсин. Интересно, что PlGF может не только оказывать местное действие в сосудах ворсин, но и обладать системными эффектами [7, 10, 14, 22].
VEGF-А и PlGF влияют на развитие сосудов плаценты по-разному. Так, VEGF-А взаимодействует с обоими типами рецепторов к VEGF (VEGFR-1 и VEGFR-2), что приводит к формированию ветвящихся сосудов. PlGF активирует только VEGFR-1, в результате чего образуются маловетвящиеся сосуды. В течение I и II триместров беременности под действием VEGF-А, опосредованным VEGFR-2, развивается сеть богато разветвленных капилляров, мезенхимальных и незрелых промежуточных ворсин. PlGF и VEGFR-1, по всей видимости, стимулируют образование длинных, маловетвящихся капиллярных петель в III триместре беременности [16].
Повышение уровня VEGF в маточных артериях даже предлагается в качестве потенциального подхода для лечения ЗРП. В маточную артерию вводят аденовирусный вектор, несущий ген VEGF. В ответ на краткосрочное повышение выработки VEGF усиливается неоангиогенез. Такие технологии в настоящее время изучаются для коронарных артерий [23]. В ходе доклинических исследований на беременных овцах было показано, что по сравнению с плацебо-вектором эта терапия приводит к усилению кровотока в маточной артерии уже через 7 дней. Эффект сохраняется по крайней мере 4 нед. [24, 25]. Вектор увеличивает экспрессию VEGF в адвентиции сосудов, что сопровождается повышением выработки эндотелиальной NO-синтазы. В результате сосуды перестают сокращаться. Помимо этого, зафиксировано ремоделирование сосудов со снижением соотношения интима-медиа и усилением пролиферации эндотелия. Вектор не проникает к плоду и на животное никакого влияния не оказывает [26].
При нормально протекающей беременности концентрация PlGF в крови постепенно повышается до начала III триместра, когда она достигает плато. У пациенток с ПЭ и плацентарной недостаточностью выработка PlGF существенно снижается [11, 14]. Такая разница позволяет использовать PlGF для определения групп риска и профилактики осложнений беременности. Содержание PlGF является маркером формирования плаценты, образования сосудов и инвазии цитотрофобласта. Также важно, что концентрацию его можно определять уже на самых ранних этапах беременности [18, 21, 27].
Пренатальный скрининг I триместра обязательно проводится всем беременным в сроке от 11+0 до 13+6 нед. В ходе этого комплексного исследования определяют группы высокого риска по рождению ребенка с хромосомными аномалиями (ХА), развитию преждевременных родов, ПЭ и ЗРП [27, 28]. Алгоритм расчета рисков, заложенный в программный модуль Astraia Obstetrics («Астрайя Акушерство»), был разработан экспертами Фонда медицины плода (Fetal Medicine Foundation — FMF, Великобритания). Алгоритм успешно применяется в акушерской практике во многих странах мира и постоянно обновляется. Программа Astraia сертифицирована в РФ.
В комплекс признаков, учитываемых в ходе пренатального скрининга I триместра, входят: возраст матери, этническая принадлежность, рост и масса тела, результаты двукратной тонометрии (с интервалом в 5 мин), данные соматического и акушерского анамнезов, краниоторакальный размер (КТР) плода по данным ультразвукового исследования (УЗИ), толщина воротникового пространства (ТВП), оценка носовой кости, пульсационный индекс в венозном протоке плода и в маточных артериях, а также сывороточные уровни биохимических маркеров: свободной β-единицы хорионического гонадотропина (β-ХГЧ), протеина А, ассоциированного с беременностью (РАРР-А). В качестве дополнительного маркера возможно использование и концентрации PlGF.
Уровни биохимических сывороточных маркеров белков ХГЧ, РАРР-А, PlGF в крови матери широко варьируют в зависимости от индивидуальных особенностей организмов матери, плода и применяемых реагентов. С целью преемственности результаты биохимического пренатального скрининга с 1976 г. выражаются не в абсолютных цифрах, а в МоМ (multiples of median). МоМ — это относительная величина уровня биохимического маркера, равная его концентрации, деленной на норму (медиану) для данного срока беременности. Медиана определена для каждого конкретного срока нормально протекающей беременности. Международный общепринятый референс для биохимических показателей — 0,5–2,0 МоМ. Значение МоМ биохимических маркеров при первом скрининге соотносится с КТР плода.
В клинических рекомендациях Минздрава России «Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода)» 2022 г. для расчета риска ЗРП предлагается использовать только данные анамнеза, показатели допплерометрии маточных сосудов и уровень РАРР-А. Напротив, в клинических рекомендациях «Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде» (2021), приведена следующая формулировка: «Оптимальный скрининг на ПЭ включает калькуляцию риска на основании оценки факторов риска, измерения среднего артериального давления, пульсационного индекса в маточных артериях и определения PlGF. PlGF является лучшим, но пока еще малодоступным биохимическим маркером. При высоком риске ПЭ низкие значения этого маркера свидетельствуют о высоком риске ранней ПЭ, часто в сочетании с ЗРП (частота ложноположительных результатов составляет 9%)»[2].
В Москве Департаментом здравоохранения для оптимизации системы пренатальной диагностики была создана единая сеть программно-аппаратного комплекса (ПАК) Astraia (приказ Департамента здравоохранения г. Москвы от 14.06.2013 № 600 (ред. от 12.03.2015) «О совершенствовании организации пренатальной (дородовой) диагностики нарушений развития плода/ребенка».
С учетом прямой корреляции между сниженным уровнем PlGF и развитием ЗРП ожидалось, что при проведении раннего пренатального скрининга (РПС) включение третьего биохимического маркера, PlGF, приведет к повышению чувствительности и специфичности метода и, соответственно, его прогностической ценности до 85–90% [29–31].
Для оценки эффекта от включения PlGF в расчет риска в качестве третьего биохимического маркера было проведено сравнение данных РПС двух кабинетов антенатальной охраны плода за 3 года (2020–2022). РПС и расчет рисков в программно-аппаратном комплексе Astraia Obstetrics проводился врачами-экспертами, имеющими действующий сертификат специалиста и лицензию FMF на проведение РПС. Все беременные в зависимости от уровня риска были разделены по любому из оцениваемых рисков на группу низкого риска (частота 1:101 и ниже) и высокого риска (частота 1:100 и выше).
В ГБУЗ «ГКБ им. В.В. Вересаева ДЗМ», филиал «Родильный дом № 17», в аппаратный расчет рисков в ходе РПС PlGF не включали, использовали только два биохимических маркера (РАРР-А и ХГЧ). В ГБУЗ «ГКБ № 67 им. Л.А. Ворохобова ДЗМ», ОП «Родильный дом № 3» расчет проводился с включением трех биохимических маркеров (PlGF, РАРР-А и ХГЧ). Определение в сыворотке крови беременной концентрации всех биохимических маркеров проводили в лаборатории пренатального биохимического скрининга в ГБУЗ «ЦПСиР ДЗМ» методом иммуноферментного анализа на аппарате AutoDELFlA (PerkinElmer, США).
Включение в расчет рисков третьего биохимического показателя оказывает влияние не только на показатель риска развития ПЭ и ЗРП, но и на оценку риска рождения ребенка с ХА (см. таблицу).
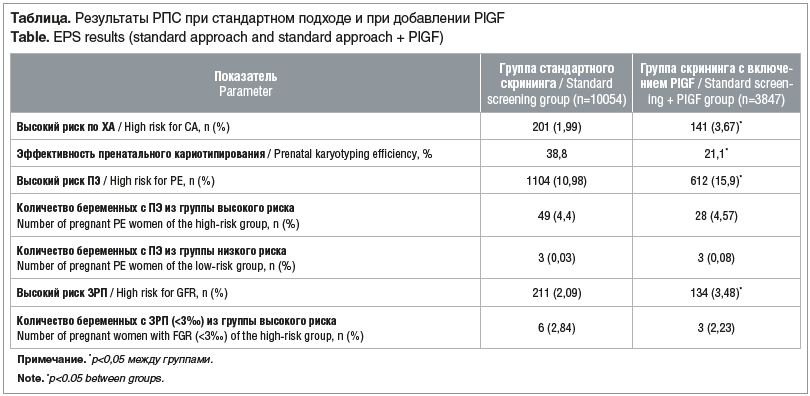
У беременных, которым при проведении РПС в расчет рисков был включен третий биохимический маркер, PlGF, уровни риска значительно превышали референсные значения: риск рождения ребенка с ХА составил 3,67% (референс по FMF 1–2%), риск развития ПЭ — 15,9% (референс 10–11%), риск развития ЗРП — 3,48% (референс 1–2%).
Анализ показал, что при проведении РПС с включением в расчет групп рисков наряду с ХГЧ и РАРР-А третьего биохимического маркера PlGF группа высокого риска рождения ребенка с ХА значительно расширяется. В свою очередь это приводит к повышению в 2 раза количества инвазивных методов исследования (аспирация ворсин хориона, амниоцентез), при этом эффективность пренатального кариотипирования снижается в 1,8–2 раза.
Также включение PlGF приводит к увеличению группы высоких рисков развития ЗРП и ПЭ, при этом частота развития данных осложнений не увеличивается по сравнению с беременными, у которых при проведении РПС учитывались два стандартных биохимических маркера. Тяжелых форм ЗРП у беременных, которые по результатам скрининга были отнесены к группе низкого риска, не было ни в одной из групп.
В каждой из групп из когорты высокого риска развития ПЭ тяжелая ПЭ развилась у 3 беременных. Таким образом, расширение группы риска (в 1,5 раза) не приводило к увеличению специфичности диагностики. Также большему количеству пациенток был рекомендован прием ацетилсалициловой кислоты, что не привело к увеличению эффективности профилактики.
Таким образом, вопрос о целесообразности включения в РПС PlGF в качестве третьего биохимического маркера нельзя считать решенным. Следует провести более масштабный анализ эффективности данного маркера на российской популяции женщин, ведь его внедрение может привести к расширению групп высокого риска развития ЗРП, ПЭ, рождения ребенка с ХА, что в свою очередь приведет к увеличению частоты инвазивных вмешательств и расширению группы пациенток, принимающих ацетилсалициловую кислоту без увеличения эффективности.
Сведения об авторах:
Шамугия Валериан Валерианович — заведующий отделением антенатальной охраны плода Родильного дома № 17, филиала ГБУЗ «ГКБ им. В.В. Вересаева ДЗМ»; 127247, Россия, г. Москва, ул. 800-летия Москвы, д. 22.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290
Кузнецов Павел Андреевич — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2492-3910
Джохадзе Лела Сергеевна — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-5389-7817
Иванова Оксана Геннадьевна — к.м.н., заместитель главного врача ОП Родильный дом № 3 ГБУЗ «ГКБ № 67 им. Л.А. Ворохобова ДЗМ»; 119501, Россия, г. Москва, ул. Нежинская, д. 3.
Контактная информация: Кузнецов Павел Андреевич, e-mail: poohsmith@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 22.12.2023.
Поступила после рецензирования 24.01.2024.
Принята в печать 16.02.2024.
About the authors:
Valerian V. Shamugia — Head of the Department of Antenatal Fetal Care, Maternity Hospital No. 17, Branch of the V.V. Veresaev City Clinical Hospital; 22, 800 Years of Moscow str., Moscow, 127247, Russian Federation.
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD: 0000-0002-7830-2290
Pavel A. Kuznetsov — C. Sc. (Med.), Assistant Professor of the Department of Obstetrics and Gynecology, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD: 0000-0003-2492-3910
Lela S. Dzhokhadze — C. Sc. (Med.), Assistant Professor of the Department of Obstetrics and Gynecology, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0001-5389-7817
Oksana G. Ivanova — C. Sc. (Med.), Deputy Chief Physician, Maternity Hospital No. 3, Separate Division of the L.A. Vorokhobov City Clinical Hospital No. 67; 3, Nezhinskaya str., Moscow, 119501, Russian Federation.
Contact information: Pavel A. Kuznetsov, e-mail: poohsmith@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 22.12.2023.
Revised 24.01.2024.
Accepted 16.02.2024.
1Клинические рекомендации. Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода). 2022
2Клинические рекомендации. Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде. 2021.
Информация с rmj.ru

