Введение
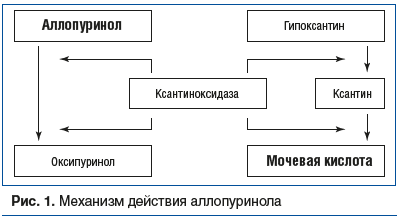
Изучение египетской цивилизации с позиции медицины приводит к удивительным выводам. Египетские жрецы диагностировали подагрический артрит и знали эффективный метод лечения, ограничивающий болевую и воспалительную реакции. Доказательство тому — наличие цветков колхицина в гробнице, где у мумии выявлены кристаллы уратов в больших пальцах стоп. На протяжении последующего времени в центре внимания специалистов ввиду яркости клинической картины находились такие проявления подагры, как артрит и тофусы. Исторические вехи изучения этой патологии представлены в таблице 1. Роль и место гиперурикемии при подагре впервые обозначил и изучил Альфред Бэринг Гаррод в 1848 г. В 1961 г. Маккарти и Холландер идентифицировали кристаллы уратов в суставной жидкости при подагрическом артрите, а уже в 1963 г. в клинической практике начали использовать аллопуринол. С этого времени аллопуринол является «золотым стандартом» в лечении гиперурикемии и подагры. Подробно изучены механизм действия препарата (рис. 1) и особенности его клинического применения. Таким образом, к середине XX в. были разработаны теоретические подходы и внедрены технологии, лежащие в настоящее время в основе диагностики и лечения этой патологии.

Содержание статьи
Диагностика
Концепция уратового континуума [1] предполагает как возможность последовательного развития трех клинических этапов: нормоурикемического, гиперурикемического и подагрического (аутовоспалительного), так и возможность при определенных условиях их обратного развития. Такой подход позволяет обобщить клиническую картину и охарактеризовать особенности клинического этапа в каждом конкретном случае. Но для этого требуется серьезная диагностическая база.
Лабораторная диагностика. Изучение особенностей пуринового обмена и клинических проявлений у пациентов дает возможность улучшить диагностику (например, поляризационная микроскопия кристаллов синовиальной жидкости), проводить динамическое наблюдение и на основании полученных данных применять наиболее эффективные и безопасные методы лечения.
В настоящее время уровень мочевой кислоты (МК) в крови является базовым (и нередко единственным) лабораторным показателем состояния пуринового обмена, на который, согласно клиническим рекомендациям [2, 3], ориентируются клиницисты.
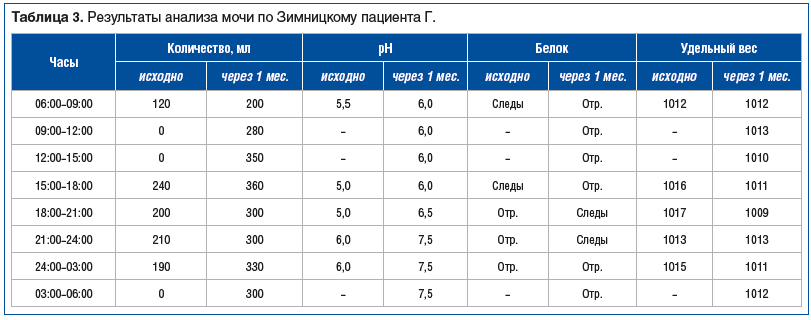
Между тем для полноценной диагностики необходим целый ряд дополнительных лабораторных исследований, прежде всего связанных с оценкой функционального состояния почек: определение клиренса креатинина, концентрации МК в крови и суточной моче с расчетом клиренса МК и фракционного клиренса, определение рН мочи, суточной протеинурии, анализ суточной мочи по Зимницкому. Для их выполнения необходимо, как правило, несколько суток, что увеличивает продолжительность диагностического периода, влияет на качество исследований, требует от пациента больших затрат времени и сил, ведет к определенным экономическим издержкам. По этой причине указанный диагностический комплекс в полном объеме проводится редко.
Нами запатентована [4] и внедрена [5, 6] методика, позволяющая указанные выше исследования осуществлять в течение суток. Последовательность действий выглядит следующим образом: сбор суточной мочи по методу Зимницкого (3-часовые порции мочи, начиная с 06:00), при этом непосредственно после завершения сбора последней порции мочи осуществляют забор крови натощак для определения уровня креатинина и МК. В каждой порции мочи определяют рН, белок и относительную плотность, после чего порции объединяют и в общем объеме мочи определяют концентрацию МК и креатинина и фракционный клиренс МК. Возможно расширение перечня исследований (например, определение концентрации и количества МК в каждой порции мочи, определение глюкозы в суточной моче и уровня глюкозы в крови, определение связывающей способности альбумина и др.).
Предлагаемая методика позволяет: 1) оптимальным образом одномоментно оценить выраженность патологических изменений у больных с нарушением пуринового обмена и на этом основании разработать тактику лечения; 2) осуществлять динамический лабораторный контроль.
Клиническое наблюдение 1
Пациент Г., 58 лет. Рост 178 см, масса тела 106 кг. Анамнез: с 52 лет периодически (преимущественно на фоне приема алкоголя и переедания) развивались типичные приступы подагрического артрита в области первых плюснефаланговых и локтевых суставов. С 54 лет — тофусы в области локтевых суставов. При обострении артрита краткосрочно принимал НПВП в высоких дозах. Отмечал (в основном после приема алкоголя) транзиторное повышение АД до 170/100 мм рт. ст. При повышении АД принимал каптоприл.
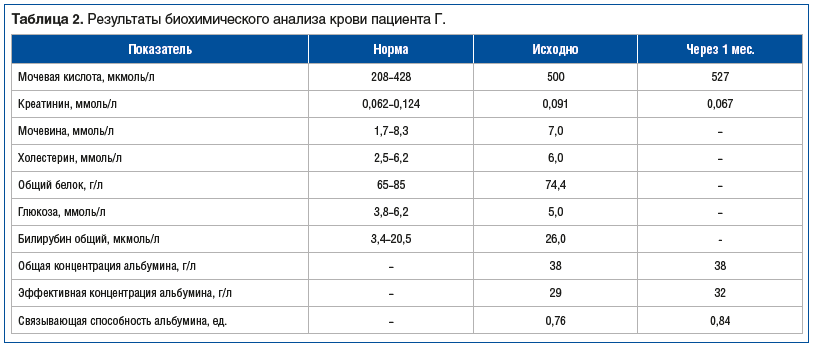
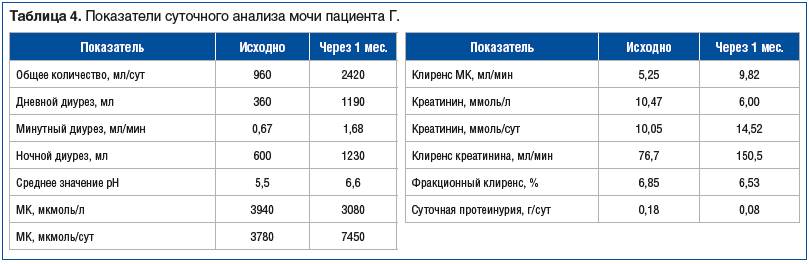
Пациенту проведено лабораторное обследование по предлагаемой методике (табл. 2–4). Было выявлено: суточный диурез 960 мл, низкий рН мочи, суточная протеинурия 0,18 г.
Пациенту было предложено увеличение питьевого режима до 3000 мл в сутки и употребление с жидкостью одного лимона в день, ограничение приема мясных и рыбных продуктов, а также алкоголя. Назначено лечение рамиприлом (5 мг 1 р/сут).
При контрольном лабораторном исследовании через 1 мес. (см. табл. 2–4) суточный диурез составил 2420 мл. Было отмечено существенное увеличение количества выделяемой с мочой МК за сутки с 3780 до 7450 мкмоль при снижении ее концентрации в моче с 3940 до 3080 мкмоль/л. Клиренс МК увеличился практически в 2 раза — с 5,25 до 9,82 мл/мин. Отмечено изменение кислотности мочи в щелочную сторону и снижение суточной протеинурии. Незначительное увеличение концентрации МК в крови с 500 до 527 мкмоль/л (при существенном увеличении выделения МК почками), видимо, было связано с активным выведением ее из депо. При клиническом осмотре (и со слов больного) тофусы в области локтевых суставов стали мягче.
В дальнейшем больному был рекомендован длительный питьевой режим в пределах 2500 мл в сутки, прием (с предварительной титрацией) аллопуринола 500 мг/сут, продолжение лечения рамиприлом.
При динамическом наблюдении в течение 3 лет прис-тупы артрита отсутствовали, через 1,5 года полностью растворились тофусы в области локтевых суставов. Уровень МК в крови находился в пределах 300–340 мкмоль/л. Пациенту был рекомендован длительный прием аллопуринола в дозе 300 мг/сут.
Данный клинический пример демонстрирует возможности лабораторной диагностики для выбора тактики лечения, значимость питьевого режима и объективного контроля за диурезом, эффективность гипоурикемической терапии аллопуринолом (Милурит®, «Эгис», Венгрия).
В целом предлагаемая нами методика лабораторной диагностики нарушений пуринового обмена показала свою эффективность на всех этапах развития уратового континуума. Она дает возможность объективизировать и персонализировать процесс постановки диагноза, а также осуществлять контроль за проводимым лечением.
Инструментальная диагностика. Современные возможности визуализации патологических изменений (комбинация рентгенологических, радиоизотопных и ультра-звуковых методов) позволяют выявить ранние структурные изменения и функциональные нарушения, а также контролировать динамику [7].
Клиническая диагностика. В настоящее время общепризнано, что патология, связанная с обменом МК, носит системный характер. Основные ее клинические проявления, связанные с образованием кристаллов уратов, представлены на рисунке 2. Если клиника острого подагрического артрита в целом общеизвестна, то кожные проявления тофусов ввиду их многоликости вызывают определенный интерес, в частности в диагностическом плане, особенно при локализации в области кистей рук.
Клиническое наблюдение 2
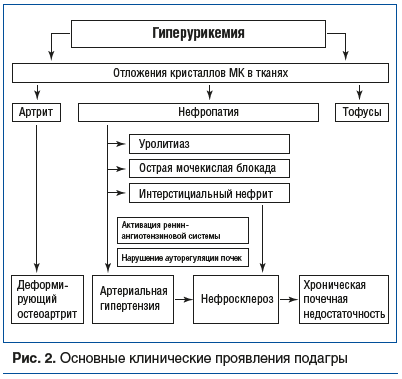
Пациентка М., 44 года. Рост 172 см, масса тела 74 кг. С 24 лет (после родов) страдает хроническим пиелонефритом с неоднократными обострениями. Наблюдается у нефролога. Обратилась по направлению гнойного хирурга с жалобами на боли в области дистального межфалангового сустава II пальца левой кисти и покраснение кожных покровов над суставом в течение 1 мес. Последние 10 дней отмечает появление над суставом округлого подкожного образования желтоватой окраски, возвышающегося над кожными покровами и постепенно увеличивающегося в размерах. Ранее болевых ощущений в суставах не отмечала.
При осмотре (рис. 3А) область дистального межфалангового сустава гиперемирована. Пальпация сустава и движение в пальце болезненны. При пальпации подкожного образования (6 мм в диаметре) определяется флюктуация и умеренная болевая реакция. Рядом с этим образованием видно еще одно (1–2 мм в диаметре) в стадии формирования. При рентгенологическом исследовании кистей рук костных деструктивных изменений не выявлено. При проведении пункции образования (рис. 3B) выделилась мутная жидкость желтовато-белого цвета. При лабораторном исследовании с применением поляризационной микроскопии выявлены кристаллы МК (все поле зрения). Бактериологический посев жидкости на микрофлору роста не дал. При биохимическом исследовании крови: уровень С-реактивного белка 8,2 мг/л, умеренно выраженная для женщины гиперурикемия (408 мкмоль/л) и нормальный уровень креатинина. Был поставлен диагноз вторичной подагры и рекомендован прием аллопуринола. При титрации дозы от 50 до 200 мг/сут уровень МК снижался и через полгода составил 320 мкмоль/л при нормальном уровне креатинина. Был рекомендован длительный прием аллопуринола в дозе 200 мг/сут под регулярным лабораторным контролем.
Особенность данного клинического примера — необходимость проведения дифференциальной диагностики с гнойным процессом ввиду специфики клинических проявлений.
Клиническое наблюдение 3
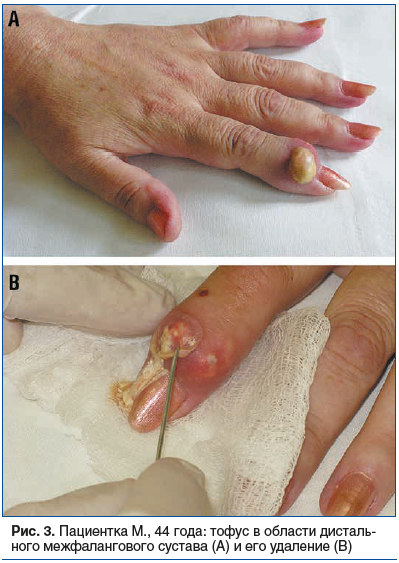
Пациент В., 78 лет. Длительно страдает остеоартритом с преимущественным поражением коленных суставов в виде умеренной болевой симптоматики, возникающей при физической нагрузке. Последние 3 года беспокоят периодически возникающие интенсивные боли и покраснение кожных покровов в области дистальных межфаланговых суставов обеих кистей, а также появление подкожных образований в этой области. При осмотре (рис. 4) в области боковой поверхности дистального межфалангового сустава II пальца правой кисти определяется образование овальной формы 6×4 мм, при пальпации умеренно болезненное, плотное и не связанное с костной тканью сустава. В области дистального межфалангового сустава II пальца левой кисти отмечается покраснение кожной поверхности и резкая болезненность ее при пальпации. При рентгенографии кистей: признаки артроза дистальных межфаланговых суставов (узлы Гебердена). При лабораторном обследовании в динамике: гиперурикемия (от 580 до 630 мкмоль/л). С предварительной титрацией был назначен аллопуринол 300 мг/сут. Через 1 год содержание МК в крови было в пределах 340–380 мкмоль/л. Покраснение кожных покровов и подкожные образования прошли. Остаются умеренные болевые ощущения при сгибании пальцев рук.
Особенность данного клинического примера — одновременное существование первичного артроза (узлы Гебердена) и подагрического артрита дистальных межфаланговых суставов кистей.
Клиническое наблюдение 4
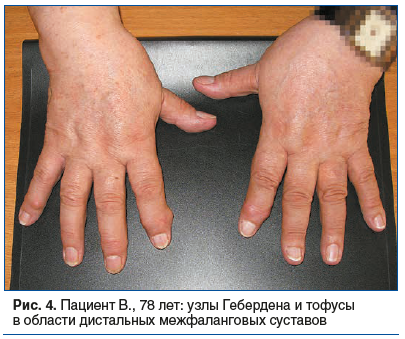
Пациент П., 38 лет. Рост 174 см, масса тела 92 кг. Из анамнеза известно, что отец страдал псориатическим артритом. Диагноз псориаза с кожными проявлениями в области волосистой части головы и кистей рук был поставлен в 16 лет. С 24 лет был поставлен диагноз псориатического артрита (поражение коленных суставов, а через несколько лет и поражение мелких суставов кистей и стоп). С 30-летнего возраста по совету знакомого стал самостоятельно регулярно принимать преднизолон (от 10 до 60 мг/сут) для купирования суставной боли. С этого же времени стал злоупотреблять блюдами китайской кухни и приемом алкоголя. Нерегулярно наблюдался дерматологами. С 34 лет — постоянные болевые ощущения в области кистей с покраснением кожи и периодическим выделением белесоватой густой жидкости (ввиду косметических проблем круглогодично носил шерстяные перчатки). Доставлен в клинику бригадой скорой медицинской помощи с жалобами на сильную боль в области больших пальцев стоп. При осмотре: одутловатость лица; на коже живота стрии; артрит плюснефаланговых суставов больших пальцев с гиперемией кожных покровов, кожные покровы кистей гиперемированы, определяются множественные мелкие тофусы, при надавливании на которые выделяется беловатая густая жидкость (рис. 5А). При рентгенографии: внутрикостные тофусы фаланг пальцев (рис. 5B) и крупные тофусы в области плюснефаланговых суставов больших пальцев (рис. 5C). Было проведено 3 курса экстракорпоральных (комбинация плазмафереза и плазмосорбции) методов лечения, рекомендовано последующее назначение гипоурикемической терапии аллопуринолом.
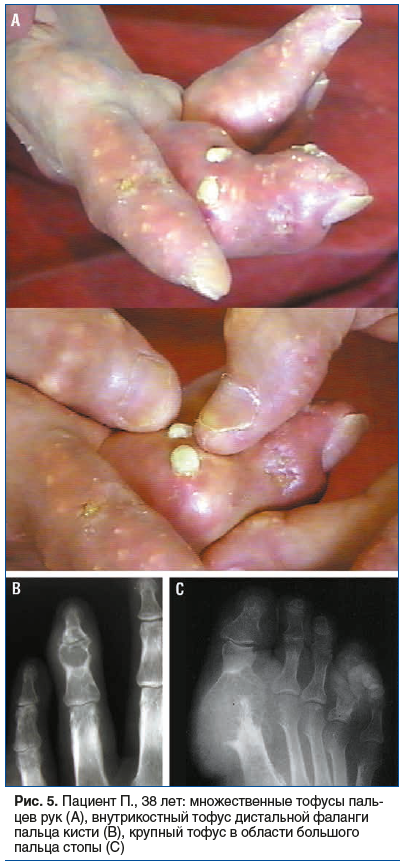
Особенность данного клинического примера — развитие тяжелого течения подагры на фоне ювенильного псориатического артрита, что затруднило своевременную диа-гностику.
Таким образом, представленные выше клинические примеры показали возможность неоднозначной трактовки проявлений заболевания на фоне коморбидной патологии, что существенно затрудняло диагностический поиск.
Каждый этап клинического развития уратового континуума имеет свои важные диагностические особенности. Так, например, на этапе нормоурикемии лабораторная диагностика по предлагаемой нами методике позволяет выявить и контролировать даже начальные нарушения обмена МК, связанные, прежде всего, с выделительной функцией. А на этапе развития подагры большое значение придается диагностике и дифференциальной диагностике клинических проявлений.
Лечение
Снижение уровня МК в крови до целевых значений рассматривается как главная задача лечения. Достижение результата возможно при изменении образа жизни и/или назначении гипоурикемической терапии.
Говоря об изменении образа жизни, прежде всего обсуждают вопросы питания. Так, на протяжении многих десятилетий в лечении пациентов активно использовались диетические столы по М.И. Певзнеру [9, 10], не потерявшие свою актуальность и в настоящее время.
Диетой, предписываемой пациентам с нарушением пуринового обмена, является стол № 6 (табл. 5). В основе этого диетического стола лежит резкое ограничение пуриносодержащих продуктов при значительном расширении приема углеводов (хлеб, сахар, мед, сладкие фрукты, варенье и т. д.). У пациента сравнительно молодого возраста и при отсутствии коморбидной патологии применение обсуждаемой диеты, вызывающей определенный дискомфорт из-за ограничения приема мясных и рыбных продуктов, в целом возможно. Однако в пожилом возрасте длительное применение этой диеты является фактором, однозначно способствующим развитию сахарного диабета (с чем нам неоднократно приходилось сталкиваться в клинической практике). Выход из этой ситуации — в раннем назначении гипоурикемической терапии аллопуринолом и ограничении избыточного потребления пуриносодержащих продуктов.

Большое значение имеет питьевой режим. Большинство здоровых людей могут поддерживать гидратацию, употребляя воду и другие жидкости всякий раз, когда они чувствуют жажду. При этом необходимо учитывать и особенности конституции. В целом количество употребляемой жидкости должно находиться в пределах 30 мл на 1 кг массы тела. Потребление жидкости зависит и от целого ряда дополнительных факторов (физическая нагрузка, специфика работы и отдыха, особенности климата, характер питания, наличие определенных заболеваний и др.), что также необходимо учитывать.
Национальная академия наук, инженерии и медицины США определила, что адекватное суточное потребление жидкости имеет определенные гендерные различия: около 3,7 л воды для мужчин и около 2,7 л воды в день для женщин. Эти рекомендации касаются как непосредственно воды, так и жидкостей из других напитков и продуктов питания. При этом около 20% суточной нормы воды обычно поступает с пищей, а остальное — с напитками.
Изучение потребления жидкости у наших пациентов, даже без признаков недостаточности кровообращения и гипертонии, продемонстрировало его снижение не менее чем у 40%. Это свидетельствует о важности контроля за достижением адекватного диуреза, увеличивающего суточное выделение МК без повышения ее концентрации в моче.
Контроль за кислотностью мочи (достижение рН более 6,0) дает еще одну возможность ограничить процесс кристаллобразования МК.
При ведении пациентов с нарушением пуринового обмена, приводящим к избыточному образованию МК в крови, необходимо придерживаться следующих общих принципов лечения. Оно должно быть:
патогенетически направленное;
своевременно начатое;
длительное.
Соблюдение этих условий позволяет избежать развития порой необратимых изменений в тканях.
Лечение гиперурикемии, как отмечалось выше, начинается с препарата первой линии — аллопуринола1 [2, 3].
Раннее начало медикаментозного лечения позволяет:
ограничить рост пула МК в организме;
улучшить течение и прогноз гипертонической болезни, ишемической болезни сердца, метаболического синдрома и сахарного диабета;
обеспечить достижение планируемого результата меньшими суточными дозами;
уменьшить вероятность развития побочных реакций;
уменьшить вероятность развития кристалл-индуцированной воспалительной реакции, приводящей, в частности, к развитию острого артрита;
уменьшить вероятность развития почечной патологии (камнеобразования и интерстициального нефрита);
исключить необходимость жестких диетических ограничений;
в целом улучшить качество жизни пациентов.
Эффективность действия аллопуринола оценивается, прежде всего, по его способности — с учетом титрования дозы препарата — снижать уровень МК в крови. Но существует ряд факторов, ограничивающих гипоурикемический эффект препарата, которые необходимо учитывать при назначении аллопуринола и комплексной оценке его эффективности.
Одной из причин, как отмечалось выше, является низкий суточный диурез, снижающий клиренс МК (что было наглядно показано на примере клинического наблюдения 1) и, соответственно, ее выделение с мочой.
Злоупотребление алкоголем и существенные диетические нарушения приводят к повышению уровня МК в крови и задержке ее выделения почками, что также снижает эффективность действия препарата.
У больных подагрой с наличием тофусов, которые свидетельствуют о значительном депо МК в организме, при лечении аллопуринолом снижение уровня МК в крови может быть менее выраженным и наступать позже, что связано с выходом МК из депо в кровь.
Остается актуальной, особенно у пациентов пожилого возраста, проблема коморбидности и связанной с ней полипрагмазией, особенно назначения препаратов, ограничивающих выделение МК. Так, недостаточность кровообращения закономерно требует ограничения поступления жидкости и назначения мочегонных. Гиперурикемия, особенно у женщин в пожилом возрасте, нередко возникает на фоне ежедневного длительного (иногда годами) приема низких доз аспирина и мочегонных [12].
Особенно важно понимание логики титрования дозы аллопуринола. Попытка быстрого достижения результата через резкое снижение уровня МК в крови путем изначального назначения высоких доз препарата у больных подагрой может спровоцировать развитие артрита. По-этому оптимальным общепризнанным решением является постепенное снижение уровня МК до целевых значений, достигаемое постепенным увеличением дозы препарата cо 100 мг/сут (с 50 мг при хронической болезни почек) до 900 мг (максимально возможная суточная доза). Использование такого подхода позволяет уверенно контролировать лечебный процесс. Длительное (годами) применение препарата не снижает эффективность его действия.
На каждом этапе уратового континуума лечение имеет свои особенности. На первых двух этапах его развития в подавляющем большинстве случаев аллопуринол (Милурит®), являясь препаратом первой линии, эффективно способствует нормализации урикемии. На третьем этапе при тяжелом течении подагры, особенно сопровождающемся выраженным поражением почек, возможно применение аллопуринола в низких дозах, а в случае недостаточной эффективности или непереносимости аллопуринола — назначение препаратов второй линии терапии1 [2, 3, 14], экстракорпоральных методов [15–19] и некоторых других технологий.
Заключение
Концепция уратового континуума предлагает холистический взгляд на проблему, расширяющий представления как о непосредственно пуриновом метаболизме, так и о воздействии МК (в растворенном и/или кристаллическом виде) на гомеостаз.
Это имеет определенную практическую значимость для развития персонализированной медицины, предполагающей индивидуальный подход на основании, прежде всего, клинического мониторинга. Он, в свою очередь, осуществляется при использовании углубленного лабораторного, инструментального и клинического обследования пациента.
Индивидуальная терапия, основанная на результатах клинического мониторинга, дает возможность не только подобрать необходимый препарат, но и оттитровать дозу до оптимальной. Подобный персонализированный подход, получивший название «тераностика» и объединяющий диа-гностику и терапию, — важная составляющая концепции уратового континуума. Ранняя диагностика и раннее начало лечения — самый короткий путь к выздоровлению.
Информация с rmj.ru






