Введение
Лимфома Ходжкина (ЛХ) — злокачественная опухоль, возникающая при нарушении нормального лимфопоэза В-лимфоцитов. Отличительной чертой этого заболевания является неопластическая клетка Ходжкина / Березовского — Рида — Штернберга (БРШ), которая, как считается, происходит из В-клеток зародышевого центра, но утрачивает многие В-клеточные маркеры. Клетки БРШ рассеяны внутри плотного воспалительного инфильтрата и через сеть цитокинов и хемокинов формируют свое микроокружение, избегают иммунного ответа, выживают и растут [1].
Всемирная организация здравоохранения (ВОЗ) в классификации опухолей гемопоэтической и лимфоидной тканей (2017 г.) выделяет 2 типа ЛХ: классическую и нодулярную с лимфоидным преобладанием. Классическая ЛХ включает следующие гистологические варианты: с нодулярным склерозом (I и II типа), смешанно-клеточный, классический с большим количеством лимфоцитов и редко встречающийся вариант с лимфоидным истощением [2, 3].
Заболеваемость ЛХ в России составляет 2,2 случая на 100 тыс. населения в год, смертность достигает 0,61 случая на 100 тыс. населения в год [3]. ЛХ занимает 26-е место в мире по распространенности среди других видов онкологической патологии [4]. Два пика заболеваемости приходятся на возрастные периоды 15–19 лет и после 50 лет. До 15 лет заболевание встречается редко [5].
В 1832 г. Томас Ходжкин впервые описал ЛХ как «заболевание, при котором поражаются лимфатические узлы и селезенка». Спустя 23 года S. Wilks добавил собственные наблюдения и назвал это состояние болезнью Ходжкина. С.Я. Березовский и C. Sternberg в 1890 г. описали гигантские многоядерные клетки и предположили, что они являются специфичными для данного заболевания, подробную характеристику этим клеткам дала английская исследовательница Dorothy Reed, поэтому в настоящее время эти клетки носят название Березовского — Рид — Штернберга [6]. В 2001 г. ВОЗ утвердила название «лимфома Ходжкина» в классификации лимфом.
На данный момент до сих пор неизвестна этиология ЛХ, но существуют состояния, которые повышают риск этого заболевания, генерируя образование клеток БРШ с неизвестным механизмом. Клетки БРШ накапливаются в лимфоидной ткани, выделяя цитокины. Цитокины привлекают нейтрофилы, лимфоциты, эозинофилы и моноциты, которые образуют основную часть лимфатического узла при ЛХ. К факторам риска относятся: иммунодефицитные состояния, инфицирование вирусом Эпштейна — Барр (ВЭБ), состояние при иммуносупрессивной терапии, изучаются связи аллергических заболеваний с ЛХ [7, 8].
M. Rafiq et al. [8] обнаружили, что у лиц с ранее диагностированным аллергическим заболеванием и экземой значительно выше вероятность развития ЛХ. Был проведен анализ документации 1236 пациентов с ЛХ, которые имели аллергические заболевания, такие как бронхиальная астма (БА), экзема, аллергический ринит, учитывалось применение кортикостероидных препаратов, проводилось сравнение с контрольной группой (n=7416). Риск ЛХ возрастал в 1,4 раза при наличии в анамнезе аллергического заболевания или только экземы. Эта связь не зависела от лечения стероидами в анамнезе, хотя предыдущее применение стероидов также повышало риск развития ЛХ независимо от статуса аллергического заболевания. Эти результаты дополняют растущее число доказательств того, что аллергические заболевания и иммуносупрессии играют важную роль в развитии ЛХ [8, 9].
Представляем собственное клиническое наблюдение ЛХ у ребенка с БА (получено согласие законного представителя на публикацию клинического наблюдения в обезличенном виде).
Содержание статьи
Клиническое наблюдение
Ребенок И., 2011 г. р., родился от 2-й беременности, первых срочных самостоятельных родов, с массой тела при рождении 2700 г, длиной тела 49 см. Ребенок находился на грудном вскармливании до 2 мес., развивался соответственно возрасту, привит по национальному календарю прививок. Отмечался отягощенный аллергический анамнез: у матери — аллергическая реакция на лимон; у отца — отек Квинке на укусы пчел; у двоюродной бабушки по линии матери — отек Квинке при употреблении кока-колы.
Ребенок перенес ветряную оспу, ежегодно отмечались ОР3 (3–4 раза в год), обструктивные бронхиты с 10 мес., проявления атопического дерматита с полутора лет (предположительно после употребления шоколада), поллиноз с 2 лет, БА с 10-летнего возраста.
С 2014 г. ежегодно отмечались явления поллиноза. В 2017 г. проведено аллергологическое обследование: сенсибилизация не выявлена. В течение всего лета 2018 г. отмечался зуд в глазах. По результатам кожных скарификационных проб (от 08.10.2018) выявлена сенсибилизация к домашней пыли (++), эпителию кошки (++), шерсти собаки (+), шерсти овцы (+), пыльце березы (+++), ольхи (+), лещины (++), клена (+), кукурузы (+), амброзии (+), подсолнечника (+). С 24.01.2019 по 03.02.2019 проведен курс аллерген-специфической иммунотерапии (АСИТ) аллергенами пыльцы березы, ольхи, лещины в условиях 23-го отделения ГБУЗ «ДГКБ св. Владимира ДЗМ» (ДГКБ св. Владимира. После проведенного курса АСИТ отмечалось улучшение, в период цветения симптомы поллиноза у мальчика проявлялись слабо. С 10.02.2020 по 18.02.2020 проведен 2-й курс АСИТ аллергенами пыльцы березы, ольхи, лещины в условиях пульмонологического отделения ДГКБ св. Владимира. Весной 2020 г. явлений поллиноза у пациента не отмечалось.
В октябре 2020 г. проведен 3-й курс АСИТ аллергенами пыльцы березы, ольхи, лещины. Весной 2021 г. — состояние стабильное. С июня 2021 г. периодическое чиханье — купировано антигистаминными препаратами (АГП). С августа 2021 г. — более выраженные заложенность носа, чиханье. Получал только АГП эпизодически. В сентябре 2021 г. проведен 4-й курс АСИТ аллергенами пыльцы березы, ольхи, лещины. В октябре и декабре 2021 г. пациент перенес острый обструктивный бронхит.
Компьютерная спирометрия от 07.04.2022: обструкция средних и мелких бронхов 1-й степени. Проба с бронхолитиком (сальбутамолом) сомнительная.
Риноконъюнктивальные проявления весной 2022 г. отсутствовали. Однако 06.05.2022 отмечен приступ бронхообструкции на фоне полного здоровья. Получал беродуал в течение четырех дней.
Компьютерная спирометрия от 24.05.2022: обструкция средних и мелких бронхов 1-й степени. На основании обследования выставлен диагноз БА.
Мальчик 17.08.2022 госпитализируется в отделение пульмонологии в ДГКБ св. Владимира для проведения 5-го курса АСИТ с диагнозом: БА, атопическая форма, легкое течение, период ремиссии.
Проведена спирометрия 18.08.2022. Заключение: показатели вентиляционной способности легких в пределах условной нормы, проба с сальбутамолом положительная.
Результаты лабораторного обследования приведены в таблицах 1, 2.
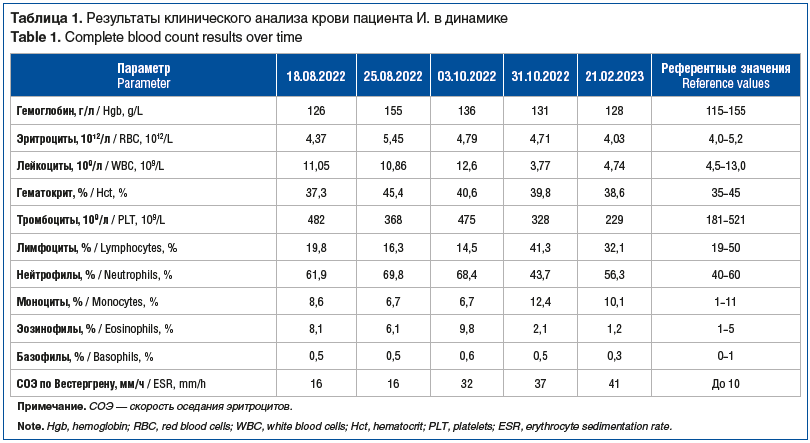
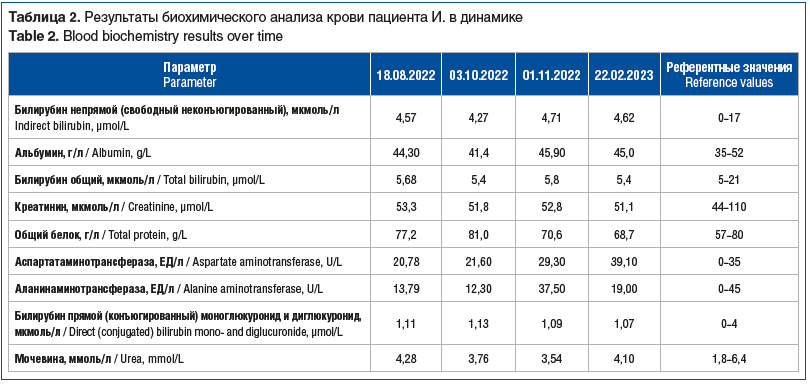
Заключение по данным обзорной рентгенографии органов грудной клетки (ОГК) от 18.08.2022: на рентгенограмме в прямой проекции очаговые, инфильтративные тени достоверно не определяются. На фоне выраженного обогащения легочного рисунка с обеих сторон определяются очаговоподобные тени невысокой плотности с нечеткими контурами. Определяется расширение верхнего средостения влево за счет суммации с тенью дуги аорты? Объемного образования? Трахея несколько оттеснена вправо. Корни легких недостаточно структурированы, тяжистые. Показана КТ ОГК для дообследования. Результаты представлены на рисунках 1 и 2.
На основании полученных результатов показана консультация онкогематолога в ГБУЗ «Морозовская ДГКБ ДЗМ» (Москва).
Аллерген туберкулезный рекомбинантный от 19.08.2022 в стандартном разведении 0,1 мл внутрикожно однократно. Заключение: результат отрицательный.
Ультразвуковое исследование гепатопанкреатобилиарной системы от 22.08.2022: эхо-признаки объемных образований в проекции ворот печени, на момент осмотра расцениваемые как увеличенные лимфатические узлы.
Консультация фтизиатра от 22.08.2022: данных за туберкулез не выявлено.
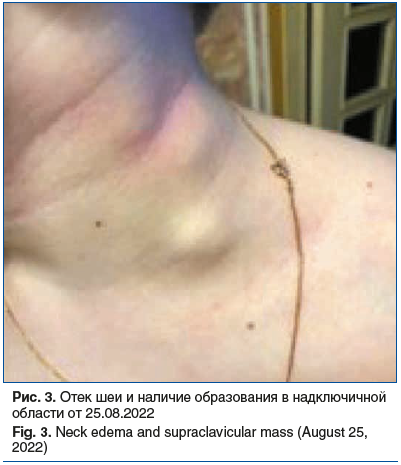
Со слов мамы, 25.08.2022 вечером после выписки из стационара ДГКБ св. Владимира заметила отек шеи и наличие образования в надключичной области (рис. 3). Обратились самостоятельно в приемный покой ГБУЗ «Морозовская ДГКБ ДЗМ».
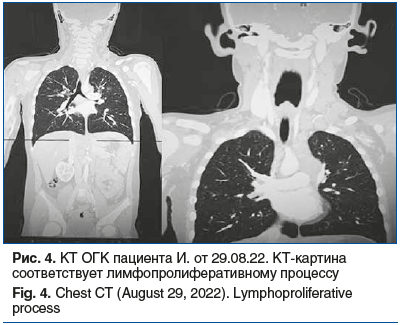
На КТ ОГК от 29.08.2022 отмечаются множественные резко увеличенные, с тенденцией к слиянию лимфатические узлы и крупные конгломераты. Слева: нижнечелюстные лимфатические узлы до 6 мм, глубокие шейные — от 4 до 15 мм, поверхностные шейные — до 12 мм, надключичные — до 20×17 мм, увеличенные яремные — от 7 до 18 мм, нижние шейные — 14,5, подключичные множественные, сливающиеся в конгломераты — от 14×17 до 28,4×30 мм, вышеописанные конгломераты оказывают объемное воздействие на яремную вену слева, смещая и компримируя последнюю. Справа нижнечелюстные лимфатические узлы до 11 мм, глубокие шейные — от 4,0 до 8,5 мм, поверхностные шейные — до 7,3 мм, надключичные — до 7,3 мм, увеличенные яремные — от 7 до 18 мм, нижние шейные — 2,3 мм, подключичные — единичные. В средостении также определяются крупные конгломераты: в ложе тимуса конгломерат общим размером 48×26×72 мм, парааортально (латеральнее дуги аорты) — 32,4×54,8×55,5 мм, паратрахеальные конгломераты до 10 мм, бронхопульмональные — до 7,5 мм. После внутривенного введения контрастного препарата вышеописанные конгломераты лимфатических узлов активно накапливают контрастный препарат. КТ ОГК: в обоих легочных полях билатерально полисегментарно визуализируются мягкотканные очаги, без четких контуров с перифокальной реакцией, накапливающие контрастный препарат, с максимальными размерами: в S2 справа — 10 мм, S3 справа — 12,3 мм, S4 справа — 12,5 мм, S9 справа — 12 мм, S1/2 слева — 17 мм. В теле грудины визуализируется остеолитический очаг с истончением кортикального слоя. Отмечаются парааортальные лимфоузлы максимального размера 19×31 мм. Заключение: КТ-картина соответствует лимфопролиферативному процессу (рис. 4).
Проведена операционная биопсия левого надключичного лимфоузла 08.09.2022. Заключение исследования биопсийного материала от 19.09.2022: ЛХ, нодулярный склероз.
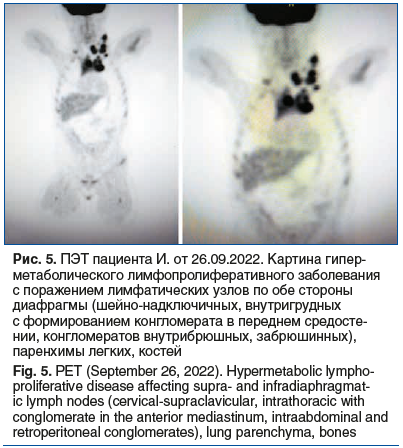
Результаты позитронно-эмиссионной томографии (ПЭТ) от 26.09.2022 представлены на рисунке 5.
Анализ крови на антитела IgG к Cytomegalovirus (ИФА) от 03.10.2022: индекс позитивности 5,68 Ед/мл (норма 0,00–0,90 Ед/мл). Анализ крови на антитела к ВЭБ от 04.10.2022: 33,9 ЕД/мл (норма 0,15 ЕД/мл).
Получено информированное согласие на лечение по программе EuroNe-PHL-C1 (с 04.10.2022). Была запланирована химиотерапия для пациентов терапевтической группы III.
С 04.10.2022 по 18.10.2022 проведена химиотерапия цикла OEPA № 1: преднизолон 60 мг/м2/сут (75 мг) пер-орально в дни 1–15; винкристин 1,5 мг/м2 (1,9 мг) в/в струйно в дни 1, 8, 15 (18) № 3; доксорубицин 40 мг/м2 (50 мг) в/в за 4 ч в дни 1, 15 (18) № 2; этопозид 125 мг/м2 (156 мг) в/в 2 ч в дни 1–5 № 5. Сопроводительная терапия: ко-тримоксазол 960 мг 3 дня в неделю per os с 10.10.2022 (профилактика пневмоцистной пневмонии). Химиотерапию перенес в полном объеме.
С 01.11.2022 по 15.11.2022 проведена химиотерапия цикла ОЕРА № 2 (S тела=1,27 м2): преднизолон 60 мг/м2/сут (77,5 мг) перорально в дни 1–15; винкристин 1,5 мг/м2 (1,9 мг) в/в струйно в дни 1, 8, 15 № 3; доксорубицин 40 мг/м2 (51 мг) в/в за 4 ч в дни 1, 15 № 2; этопозид 125 мг/м2 (160 мг) в/в за 2 ч в дни 1–5 № 5. Сопроводительная терапия: ко-тримоксазол 960 мг 3 дня в неделю реr os. Химиотерапию перенес удовлетворительно. Результаты лабораторного обследования в динамике см. в таблицах 1 и 2.
С 30.11.2022 начата химиотерапия цикла COPDAC № 1: преднизолон 40 мг/м2/сут (50 мг) перорально в дни 1–15; винкристин 1,5 мг/м2 (1,9 мг) в/в струйно в дни 1, 8 № 2; циклофосфамид 500 мг/м2(630 мг) в/в за 1 ч в дни 1, 8 № 2; дакарбазин 250 мг/м2 (315 мг) в/в за 30 мин в дни 1–3 № 3. Сопроводительная терапия: ко-тримоксазол 960 мг 3 дня в неделю per os, ондансетрон 8 мг в/в струйно в дни 1–3, 8 (антиэметическая терапия), месна 800 мг в/в струйно в дни введения циклофосфамида (профилактика геморрагического цистита). Химиотерапию перенес удовлетворительно. Инфекционных эпизодов не было.
С 28.12.2022 начата химиотерапия цикла COPDAC № 2: преднизолон 40 мг/м2/сут (52,5 мг) перорально в дни 1–15; винкристин 1,5 мг/м2 (1,9 мг) в/в струйно в дни 1, 8, № 2; циклофосфамид 500 мг/м2(640 мг) в/в за 1 ч в дни 1, 8 № 2; дакарбазин 250 мг/м2 (320 мг) в/в за 30 мин в дни 1–3 № 3. Сопроводительная терапия: ко-тримоксазол 960 мг 3 дня в неделю per os, ондансетрон 8 мг в/в струйно в дни 1–3, 8, месна 800 мг в/в струйно в дни введения циклофосфамида. Химиотерапию перенес удовлетворительно. Инфекционных эпизодов не было.
С 25.01.2023 по 08.02.2023 проведена химиотерапия цикла COPDAC № 3: преднизолон 40 мг/м2/сут (50 мг) пер-орально в дни 1–15; винкристин 1,5 мг/м2 (1,8/1,9 мг) в/в струйно в дни 1, 8 № 2; циклофосфамид 500 мг/м2 (623 мг) в/в за 1 ч в дни 1, 8 № 2; дакарбазин 250 мг/м2 (311 мг) в/в за 30 мин в дни 1–3 № 3. Сопроводительная терапия: ко-тримоксазол 960 мг 3 дня в неделю per os, ондансетрон 8 мг в/в струйно в дни 1–3, 8, месна 800 мг в/в струйно в дни введения циклофосфамида. Химиотерапию перенес удовлетворительно. Инфекционных эпизодов не было.
С 21.02.2023 начата химиотерапия цикла COPDAC № 4: преднизолон 40 мг/м2/сут (50 мг) перорально в дни 1–15; винкристин 1,5 мг/м2 (1,9 мг) в/в струйно в дни 1, 8 № 2, циклофосфамид 500 мг/м2(627 мг) в/в за 1 ч в дни 1, 8 № 2; дакарбазин 250 мг/м2 (314 мг) в/в за 30 мин в дни 1–3 № 3. Сопроводительная терапия: ко-тримоксазол 960 мг 3 дня в неделю per os, ондансетрон 8 мг в/в струйно в дни 1–3, 8, месна 800 мг в/в струйно в дни введения циклофосфамида, глутаминовая кислота 500 мг 2 р/сут реr os ежедневно, урсодезоксихолевая кислота 500 мг 1 р/сут реr os ежедневно (с 23.02.2023). Химиотерапию перенес удовлетворительно. Инфекционных эпизодов не было.
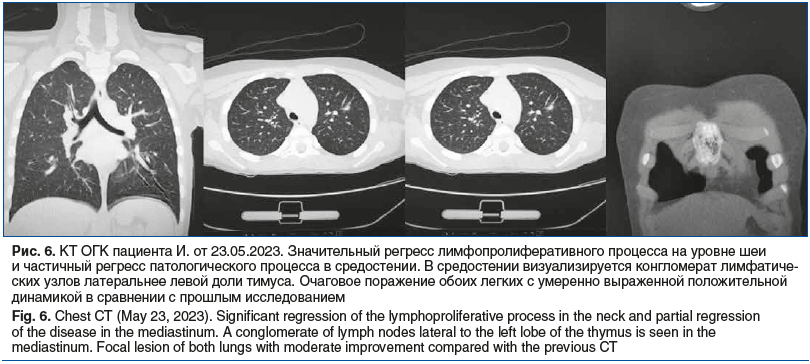
На КТ ОГК от 23.05.2023: значительный регресс лимфопролиферативного процесса на уровне шеи и частичный регресс патологического процесса в средостении (рис. 6).
В рамках диспансерного наблюдения 24.08.2023 пациент консультирован онкогематологом в ГБУЗ «Морозовской ДГКБ ДЗМ». Сохраняется ремиссия основного заболевания. На данный момент пациент чувствует себя хорошо, жалоб не предъявляет. Рекомендовано продолжить динамическое наблюдение в рамках 1-го года после окончания химиотерапии.
Обсуждение
В нашем клиническом наблюдении у пациента заболевание выявлено случайно при проведении КТ ОГК в возрасте 11 лет. БА диагностирована в возрасте 10 лет, данных за предшествующую ВЭБ-инфекцию не отмечалось. Диагноз установлен только в результате гистологического исследования биоптата пораженного лимфоузла и обнаружения специфических многоядерных клеток.
Этиология ЛХ до сих пор неизвестна, однако обсуждаются такие факторы риска, как предшествующая ВЭБ-инфекция и иммунокомпрометирующие состояния (трансплантация органов или ВИЧ-инфекция). Заболевание остается излечимым, с благоприятным прогнозом среди пациентов детского возраста, так как пятилетняя выживаемость оценивается в 98% как после химиотерапии, так и в сочетании химиотерапии с лучевой терапией. Несмотря на существенные успехи терапии ЛХ у детей, сохраняется определенное количество терапевтических неудач: 5% пациентов с ЛХ оказываются рефрактерными к терапии первой линии и 5% пациентов имеют рецидив заболевания, причем в 90% случаев он происходит в течение первых двух лет. У детей младшего возраста ЛХ является редкой патологией [10].
В дополнение к установленным факторам риска важно обращать внимание на растущую доказательную базу наличия изменения иммунной системы после аллергических заболеваний [7, 8]. В отличие от воспалительных заболеваний лимфатических узлов увеличенный при ЛХ узел совершенно безболезненный, плотной консистенции, покрывающая его кожа не изменена, нет повышения местной температуры над узлом. У трети пациентов наблюдаются системные симптомы, такие как лихорадка, ночная потливость и потеря массы тела, у многих пациентов отмечается постоянный зуд. Внутригрудная ЛХ может ассоциироваться с непродуктивным кашлем, одышкой, болью в груди или синдромом верхней полой вены.
Биопсия является обязательной для диагностики ЛХ. Злокачественная клетка БРШ должна быть идентифицирована при биопсии в клеточном контексте нормальных реактивных лимфоцитов, эозинофилов и гистиоцитов для подтверждения окончательного диагноза. При сохранении лимфаденита необходимы обязательная консультация онколога и диагностическая биопсия лимфатического узла, так как эффективность лечения зависит от ранней диагностики и своевременно начатого комплексного целевого лечения [8, 10].
Заключение
Лимфома Ходжкина на ранних стадиях не имеет спе-цифических признаков и характеризуется высокой степенью вариабельности клинической картины, что осложняет клиническую диагностику, особенно в детском возрасте. Принимая во внимание увеличение доказательной базы, наличие изменений иммунной системы при аллергических заболеваниях и связи аллергических заболеваний с ЛХ, важно учитывать наличие аллергопатологии в анамнезе. Необходимо проводить дифференциальную диагностику ЛХ с инфекционными заболеваниями. Диагноз устанавливается только при гистологическом исследовании биоптата пораженных лимфоузлов и обнаружении специфических многоядерных клеток. Точный диагноз ЛХ важен для индивидуализации клинической помощи.
СВЕДЕНИЯ ОБ АВТОРАХ:
Белых Наталья Анатольевна — д.м.н., доцент, заведующая кафедрой факультетской и поликлинической педиатрии с курсом педиатрии ФДПО ФГБОУ ВО РязГМУ Минздрава России; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0002-5533-0205.
Черненко Алексей Павлович — студент ФГБОУ ВО РязГМУ Минздрава России; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0009-0005-0257-5435.
Михайлова Юлия Владимировна — врач аллерголог-иммунолог ГБУЗ «ДГКБ св. Владимира ДЗМ»; 107014, Россия, г. Москва, ул. Рубцовско-Дворцовая, д. 1/3; ORCID iD 0009-0004-8495-8001.
Пизнюр Инна Владимировна — ассистент кафедры факультетской и поликлинической педиатрии с курсом педиатрии ФДПО ФГБОУ ВО РязГМУ Минздрава России; 390026, Россия, г. Рязань, ул. Высоковольтная, д. 9; ORCID iD 0000-0002-9267-439X.
Контактная информация: Пизнюр Инна Владимировна, e-mail: innaabramova@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 29.01.2024.
Поступила после рецензирования 21.02.2024.
Принята в печать 20.03.2024.
ABOUT THE AUTHORS:
Natalya A. Belykh — Dr. Sc. (Med.), Associate Professor, Head of the Department of Faculty and Policlinics Pediatrics with the Course of Pediatrics of the Faculty of Additional Professional Education, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; ORCID iD 0000-0002-5533-0205.
Aleksei P. Chernenko — student, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; ORCID iD 0009-0005-0257-5435.
Yuliya V. Mikhaylova — allergist & immunologist, St. Vladimir Children’s City Clinical Hospital; 1/3, Rubtsovsko-Dvortsovaya str., Moscow, 107014, Russian Federation; ORCID iD 0009-0004-8495-8001.
Inna V. Piznyur — assistant of the Department of Faculty and Policlinics Pediatrics with the Course of Pediatrics of the Faculty of Additional Professional Education, Ryazan State Medical University; 9, Vysokovol’tnaya str., Ryazan, 390026, Russian Federation; ORCID iD 0000-0002-9267-439X.
Contact information: Inna V. Piznyur, e-mail: innaabramova@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 29.01.2024.
Revised 21.02.2024.
Accepted 20.03.2024.
Информация с rmj.ru



