Содержание статьи
Введение
Нарушение мозгового кровообращения — это состояние, при котором происходит критическое уменьшение кровотока в мозге, приводящее к ишемии клеток. Острое нарушение мозгового кровообращения (ОНМК) в артериальном русле возникает вследствие ишемии и/или кровоизлияния. В патогенезе ОНМК по ишемическому типу выделяют 5 патогенетических подтипов по классификации TOAST (Trial of ORG 10172 in Acute Stroke Treatment) [1]: атеротромботический, кардиоэмболический, лакунарный, инсульт другой установленной этиологии, инсульт неустановленной этиологии. Успех лечения ОНМК во многом зависит от своевременности постановки диагноза.
Диагностика ОНМК по ишемическому типу в артериальном русле головного мозга
После стабилизации витальных функций большое значение приобретает коррекция артериального давления (АД), содержания глюкозы в крови, температуры тела пациента. Неврологический осмотр помогает определить тяжесть инсульта по шкале NIHSS.
Нейроваскулярная визуализация показана всем пациентам с подозрением на ОНМК:
КТ или МРТ головного мозга с контрастированием;
перфузионная КТ или МРТ;
КТ- или МР-ангиография, субтракционная ангиография;
ультразвуковые методы исследования сосудов головы и шеи.
Компьютерная томография позволяет выявлять как выраженные ишемические повреждения головного мозга, так и ранние признаки инфаркта. Для простой и надежной оценки с целью определения ранних ишемических изменений в бассейне средней мозговой артерии (СМА) на КТ головного мозга был разработан метод ASPECTS (Alberta Stroke Programme Early CT Score) [2]. Оценка по шкале ASPECTS рассчитывается на основе двух стандартных осевых срезов на КТ головного мозга (на уровне таламусов и базальных ганглиев, ростральнее базальных ганглиев). При этом бассейн СМА делится на 10 областей: 3 области находятся в подкорковых структурах, 7 областей — в коре головного мозга. При отсутствии поражения области ставится 1 балл, при ранних ишемических изменениях балл не ставится. Метод ASPECTS можно с большой точностью применять при перфузионной КТ и КТ-ангиографии. Также данный метод был принят для оценки степени ишемии на изображениях, получаемых при МРТ в режиме DWI.
КТ-ангиография. Коллатеральный кровоток по пиальным артериям головного мозга можно оценить с помощью многофазной КТ-ангиографии. Наличие от умеренного до хорошего пиального коллатерального кровообращения может использоваться как критерий отбора пациентов для механической тромбэктомии [3].
Перфузионная КТ. Методика предусматривает проведение серии КТ-сканирований после внутривенной болюсной инъекции КТ-контраста. Используя программное обеспечение, можно создать карты, показывающие перфузию мозга. Анализ кинетики болюса КТ-контраста позволяет оценить: внутричерепной объем крови (ВЧОК, CBV), мозговой кровоток (МК, CBF), среднее время прохождения (СВП, MTT), время достижения максимума (ВДМ, TTP). Эти карты полезны для оценки размера зоны инфаркта и пенумбры, клетки которой потенциально могут быть спасены.
Магнитно-резонансная томография. Несоответствие изображений, полученных в режимах DWI и FLAIR, относится к доказательствам острого инфаркта, при этом на изображениях DWI область поражения гиперинтенсивна, а на изображениях FLAIR — изоинтенсивна. Это свидетельствует о прошествии не более 4,5 ч от начала ОНМК, что может служить критерием отбора пациентов для лечения, у которых неизвестно время от начала ОНМК [4].
Новые протоколы сверхбыстрой МРТ-визуализации могут сократить время сбора данных, необходимых для обычной МРТ [5].
МР-ангиография с контрастным усилением обеспечивает более высокое качество визуализации крупных внутричерепных сосудов по сравнению с более устоявшейся техникой времяпролетной ангиографии.
Перфузионная МРТ, выполняемая в перфузионно-взвешенном режиме (PWI), служит для количественной оценки контрастного вещества, достигающего ткани мозга после внутривенного болюса, аналогично перфузионной КТ, описанной выше.
Режим PWI полезен для выявления ишемических областей мозга с критически низкой перфузией. Напротив, DWI позволяет получить доказательства необратимого ишемического повреждения (некроза, т. е. ядра инфаркта), а не ишемии. Несоответствие площадей очагов поражения (больший — в режиме PWI) свидетельствует о наличии подлежащей спасению мозговой ткани (т. е. ишемической полутени) и успешно используется в качестве критерия отбора пациентов для реперфузионной терапии [6].
Еще одним методом визуализации перфузии с помощью МРТ является мечение артериального спина (ASL) без использования контрастного вещества. Визуализация с помощью ASL в течение 24 ч после появления симптомов ОНМК может выявить дефекты перфузии и несовпадения перфузии (ASL) и диффузии (DWI) [7].
Цифровая субтракционная ангиография остается «золотым стандартом» оценки сосудов головного мозга при определении степени артериального стеноза и обнаружения васкулопатии или сосудистых мальформаций, а также является неотъемлемой частью эндоваскулярного лечения.
Ультразвуковые методы исследования сосудов головы и шеи (УЗИ брахиоцефальных артерий и транскраниальная допплерография) позволяют оценить состояние крупных экстра- и интракраниальных сосудов и могут быть эффективно использованы для отбора пациентов на реперфузионную терапию, а также для контроля реперфузии после тромболитической терапии [8].
Лечение пациентов с ОНМК по ишемическому типу
Методы реперфузионной терапии включают:
системную тромболитическую терапию (класс рекомендаций I, уровень доказательности А) [9];
механическую тромбэктомию (класс рекомендаций I, уровень доказательности А) [9];
селективный тромболизис (метод не имеет большой доказательной базы);
ультразвуковой тромболизис (сонотромболизис) (метод лечения находится в стадии исследований) [10];
применение антагонистов гликопротеиновых IIb/IIIa-рецепторов, например тирофибана (метод находится в стадии исследований) [11];
электростимуляцию крылонебного ганглия, что увеличивает коллатеральный кровоток (метод лечения находится в стадии исследований) [12].
Тромболитическая терапия и тромбоэкстракция проводятся у лиц 18 лет и старше. Для пациентов младше 18 лет отсутствует необходимая доказательная база для данных методов лечения. Возраст старше 80 лет не является абсолютным противопоказанием к системной тромболитической терапии и механической тромбэктомии. Вопрос о проведении системного тромболизиса у таких пациентов должен решаться в индивидуальном порядке, с учетом предполагаемого риска [13].
Системная тромболитическая терапия
Для данной терапии применяются препараты с доказанной эффективностью — алтеплаза, тенектеплаза. Процедура может проводиться в течение 3–4,5 ч он начала ОНМК. При превышении данного времени вред от процедуры будет превышать пользу.
Системный тромболизис не проводят, если выявляются обширные области очевидной гиподенсивности по данным КТ головного мозга, соответствующие инфаркту, а также при наличии признаков внутричерепного кровоизлияния. Другое исследование, обязательное для всех пациентов перед началом внутривенного введения альтеплазы, — определение уровня глюкозы в крови, так как гипергликемия может ингибировать фибринолиз [14]. По имеющимся данным, тенектеплаза не уступает по эффективности и безопасности алтеплазе [15].
В течение как минимум первых 24 ч после системного тромболизиса следует избегать применения антикоагулянтов и антиагрегантов. Пациенту показано снижение уровня липидов с помощью высокоинтенсивной терапии статинами, начатой как можно раньше. После системного тромболизиса, если в дальнейшем не планируется проведение механической тромбэктомии, рекомендована антитромботическая терапия.
Селективная тромболитическая терапия
Селективный тромболизис проводится, когда превышено время «терапевтического окна» для системного тромболизиcа, в пределах 6 ч от начала ОНМК в бассейне внутренней сонной артерии (ВСА), 12 ч — в вертебрально-базилярной системе [16, 17]. Доза алтеплазы при селективном тромболизисе значительно ниже дозы, используемой при системном тромболизисе [16].
Механическая тромбэктомия
Тромбэктомия проводится при неэффективности тромболитической терапии, превышении времени «терапевтического окна» для тромболитической терапии, при противопоказаниях к тромболитической терапии в пределах первых суток от начала ОНМК [9].
Перед тромбоэкстракцией рекомендуется проводить системный тромболизис, не проводя долгую оценку эффективности последнего. Было показано, что доля успешной реканализации после совместного использования системного тромболизиса и тромбэктомии по сравнению с эффектом от изолированного тромболизиса повышалась в 1,6 раза [18]. По мнению некоторых авторов, большинство используемых в настоящее время критериев отбора для механической тромбэктомии являются лишь предикторами результата, а не истинными критериями отбора [19].
Для механической тромбэктомии можно использовать устройства для катетерной аспирации и/или стент-ретривер второго поколения. Оценку реперфузии проводят с помощью шкалы mTICI: первоначальной целью является достижение реперфузии 2b или 3-й степени. После механической тромбэктомии, так же как и после системного тромболизиса, рекомендована антитромботическая
терапия.
Представляем два клинических наблюдения успешного проведения механической тромбэктомии у пациенток старше 70 лет.
Клиническое наблюдение № 1
Пациентка, 89 лет, с длительным анамнезом гипертонической болезни, диффузным кардиосклерозом, постоянной формой фибрилляции предсердий (брадисистолический вариант) и синдромом Морганьи — Адамса — Стокса поступила в кардиохирургическое отделение для замены имплантированного электрокардиостимулятора (ЭКС) в связи с истощением элемента питания. Показатели коагулограммы крови соответствовали нормальным значениям. После замены ЭКС пациентке был назначен эноксапарин натрия по 0,4 мл подкожно 2 р/сут. Также пациентка получала антигипертензивную терапию.
На 4-й день от замены ЭКС после подъема АД до 200/100 мм рт. ст. у пациентки появились слабость мышц левой половины лица, девиация языка влево, дизартрия, слабость мышц левой руки (сила в проксимальном отделе составляла 3 балла, в дистальном — 2 балла), паралич мышц левой ноги, небольшое снижение сухожильных рефлексов с левых конечностей. Несмотря на появление вялости и адинамии, сознание оставалось ясным. Оценка по шкале NIHSS составила 10 баллов.
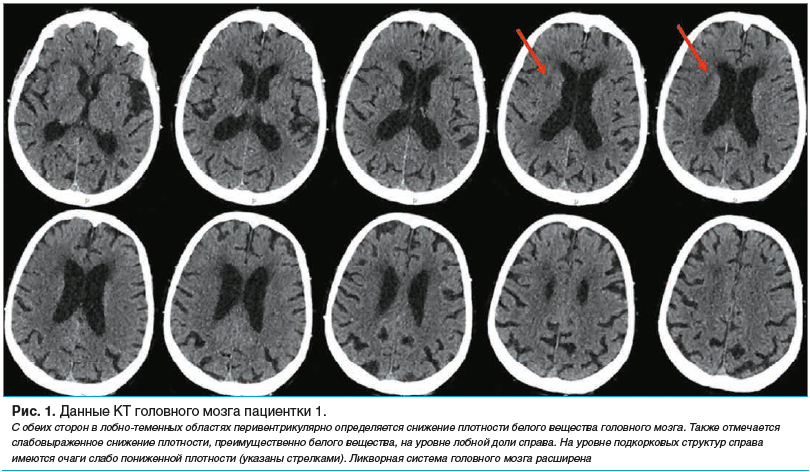
После внутривенного введения сульфата магния АД снизилось до 170/90 мм рт. ст. Пациентке в срочном порядке проведена КТ головного мозга (рис. 1).
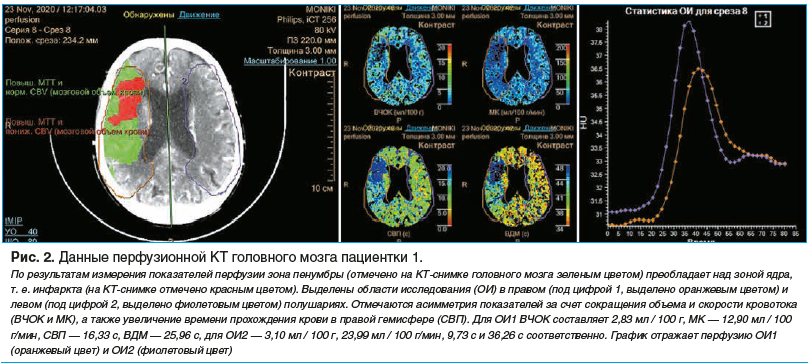
Следующим этапом были выполнены КТ-ангиография и перфузионная КТ (рис. 2). При КТ-ангиографии правая СМА дистальнее сегмента М2 не контрастировалась, отдельные ветви ее на этом уровне прослеживались. На уровне проксимальных отделов брахиоцефального ствола была обнаружена атеросклеротическая бляшка, обусловившая сужение просвета более чем на 50%. Также были обнаружены изгибы в брахиоцефальных артериях справа.
Таким образом, у пациентки имелась окклюзия дистальных отделов (сегмента М2) СМА справа с КТ-картиной ОНМК в острейшей стадии по ишемическому типу в правой гемисфере большого мозга в бассейне правой СМА. Подтип инсульта по TOAST определен как атеротромботический.
С учетом наличия обширной зоны пенумбры, выявленной окклюзии на уровне сегмента М2 СМА справа, грубого неврологического дефицита, времени от появления симптомов менее 6 ч, противопоказаний к системному тромболизису пациентке было показано проведение тромбоэкстракции в срочном порядке.
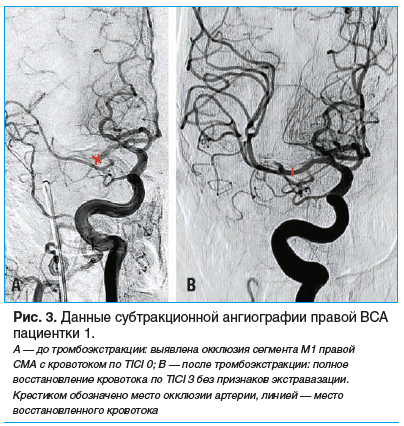
Эндоваскулярная тромбэктомия выполнена с использованием стента-ретривера и аспирационного метода. Под местной анестезией проведена пункция правой общей бедренной артерии по Сельдингеру, селективная катетерная ангиография (рис. 3A), по результатам которой выявлена окклюзия сегмента М1 правой СМА. Была выполнена механическая реканализация окклюзии сегмента М1 правой СМА. В сегментах М2 и М3 окклюзированной СМА был раскрыт стент-ретривер и выполнена тромбоэкстракция с получением макрофрагментов тромба. При промежуточной ангиографии данных за восстановление кровотока в СМА не получено. Далее в тромбированном сегменте СМА была выполнена вакуумная аспирация тромба с получением макрофрагментов тромба. При ангиографии отмечалась реканализация одной из двух ветвей СМА. Для второй окклюзированной ветви СМА также была выполнена вакуумная аспирация и получены макрофрагменты тромба. При контрольной ангиографии отмечалось полное восстановление кровотока по правой СМА (рис. 3B).
Спустя 1 нед. от тромбоэкстракции при неврологическом осмотре выявлялись небольшое повышение тонуса в левых конечностях по спастическому типу, гипестезия левых конечностей; сила мышц в левой руке составляла 3 балла, в левой ноге — 2 балла; не было выявлено слабости мимических мышц, лицо было симметричным. Оценка по шкале NIHSS составляла 6 баллов.
Таким образом, несмотря на возраст пациентки, проведенная тромбоэкстракция имела положительный эффект и не имела осложнений.
Клиническое наблюдение № 2
Пациентка, 71 год, страдает брадисистолией, пароксизмальной формой фибрилляции предсердий, гипертонической болезнью. За 4 года и за 1 год до поступления у пациентки были ишемические инсульты в бассейне левой СМА: при первом ОНМК у пациентки отмечались эфферентная моторная афазия, псевдобульбарная дизартрия, дисфагия, легкий правосторонний гемипарез; при втором ОНМК у пациентки появилось нарушение речи. Причиной настоящей госпитализации стало резкое ухудшение состояния с эпизодом потери сознания без судорог, уринации или прикуса языка. После выхода из данного состояния у пациентки отмечалось оглушение, затем нарушилась речь, наросли псевдобульбарные симптомы, появилась слабость в ногах, АД составляло 160/95 мм рт. ст.
При неврологическом осмотре отмечались асимметрия глазных щелей D
Пациентке были проведены КТ головного мозга (рис. 4), КТ-ангиография (рис. 5), перфузионная КТ (рис. 6).
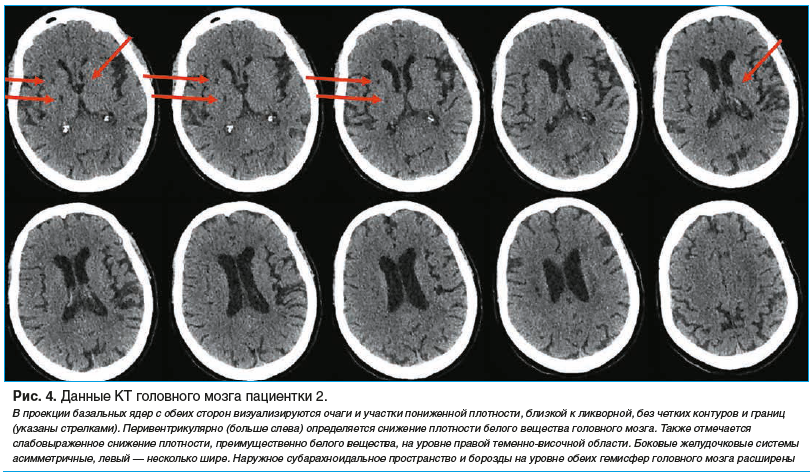
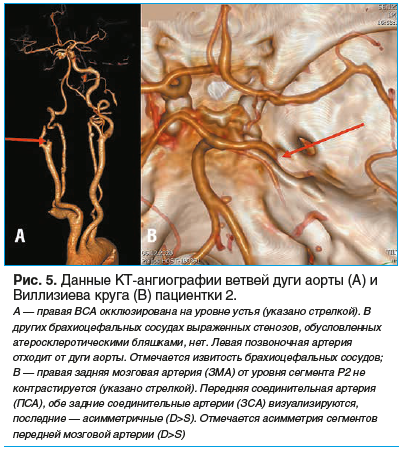
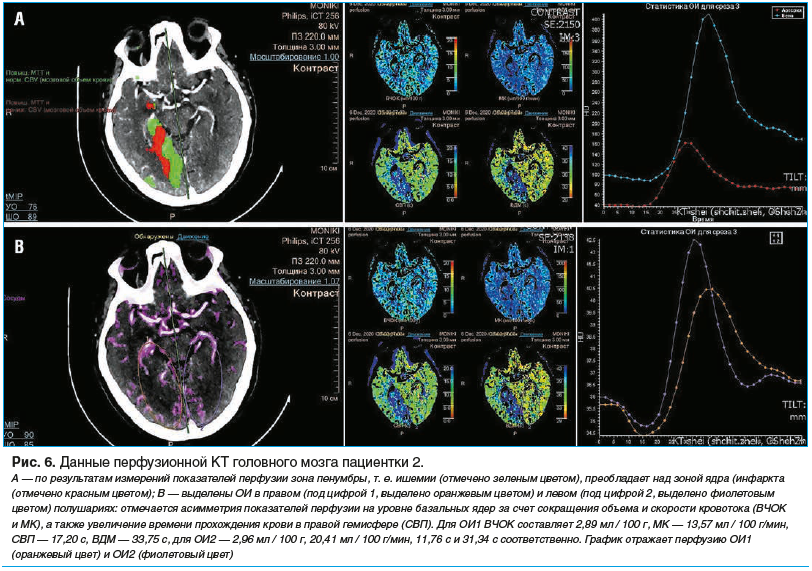
Данные КТ соответствовали картине ОНМК в острейшей стадии по ишемическому типу в правой гемисфере большого мозга в бассейне правой ЗМА. Также были обнаружены последствия предыдущих нарушений мозгового кровообращения в виде очагов и участков пониженной плотности в обеих гемисферах головного мозга, окклюзия правой ВСА. Пациентка имела противопоказания к проведению системного тромболизиса из-за приема оральных антикоагулянтов (ривароксабан) для профилактики тромбоэмболических осложнений фибрилляции предсердий. С учетом риска нарастания неврологического дефицита, данных об окклюзии правой ЗМА от уровня сегмента Р2, преобладания зоны пенумбры над зоной некроза пациентке было показано проведение тромбоэкстракции по жизненным показаниям.
Выполнена селективная катетерная ангиография с доступом через лучевую артерию по Сельдингеру с местной анестезией. При церебральной ангиографии была выявлена острая окклюзия сегмента Р1 правой ЗМА с кровотоком по TICI 0 (рис. 7). Также отмечалась хроническая окклюзия правой ВСА (в соответствии с данными КТ-ангиографии). Контрастирование правого интракраниального каротидного бассейна осуществлялось через хорошо развитые ЗСА и ПСА.
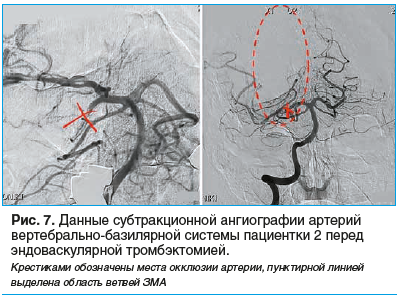
Затем пациентке проведена эндоваскулярная тромбэктомия с использованием аспирационного метода. Под местной анестезией выполнена пункция правой общей бедренной артерии по Сельдингеру для последующей механической реканализации сегмента Р1 правой ЗМА. В дистальных отделах окклюзированной ЗМА в тромбированном сегменте была проведена прямая аспирация тромба через катетер дистального доступа. При промежуточной ангиографии отмечались реканализация проксимального сегмента ЗМА и признаки дистальной окклюзии двух ветвей ЗМА (рис. 8).
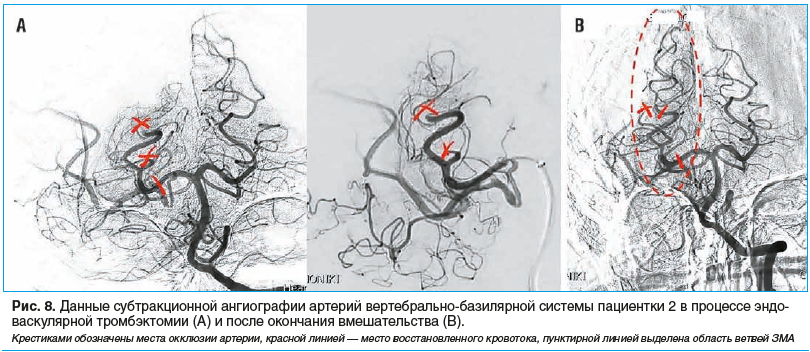
Была выполнена механическая реканализация окклюзии мелкой ветви ЗМА проводником, благодаря чему был получен антеградный кровоток. Определялись признаки окклюзии дистального сегмента мелкой ветви ЗМА. Далее были выполнены механическая реканализация второй крупной окклюзированной ветви ЗМА проводником и вакуумная аспирация тромба с получением макрофрагментов тромба. При контрольной ангиографии отмечалось практически полное восстановление кровотока по правой ЗМА с кровотоком по TICI 2b, без признаков экстравазации (рис. 8B).
На следующий день после тромбэктомии при неврологическом осмотре констатировали симметрию глазных щелей, полный объем движений глазных яблок, расположение языка по средней линии, увеличения силы в правой ноге до 5 баллов. Оценка по шкале NIHSS составила 3 балла, что подтверждало эффективность тромбоэкстракции. На 2-й день после эндоваскулярного вмешательства положительная динамика выражалась в увеличении силы в правой руке до 5 баллов, отсутствии чувствительных нарушений и мимопопадания при пальценосовой пробе. При проведении КТ головного мозга отмечалось появление небольшого очага геморрагической плотности размером до 5 мм на уровне базальных ядер справа без смещения срединных структур. Таким образом, тромбэктомия имела у данной пациентки, несмотря на ее возраст, положительный эффект.
Обсуждение
Одной из причин ишемического инсульта является тромбоэмболическая окклюзия артерий головного мозга, приводящая к нарушению мозгового кровотока с возможным необратимым повреждением нервной ткани [20]. Механическая тромбэктомия устраняет окклюзию, физически удаляя тромб с помощью эндоваскулярных подходов [21]. Широкое признание эффективности механической тромбэктомии в лечении острого инсульта произошло несколько лет назад, когда были опубликованы клинические исследования, демонстрирующие преимущества этой методики в течение нескольких часов после появления симптомов инсульта (с использованием в основном стент-ретриверов второго поколения) [22]. При выполнении механической тромбэктомии необходимо помнить об осложнениях: возможна перфорация сосуда, реперфузионное кровотечение. Однако в метаанализе HERMES было показано, что риск реперфузионного кровотечения в целом относительно низкий (4,4% в группе эндоваскулярной тромбэктомии против 4,3% в контрольной группе) [23]. Поэтому комбинированный подход к эндоваскулярной терапии с использованием стент-ретриверов и аспирации является наиболее эффективным способом достижения быстрой и полной реперфузии поврежденного очага [22].
Механическая тромбэктомия проводится при окклюзии крупной мозговой артерии в бассейне ВСА, подтвержденной ангиографическими методами. Для тромбоэкстракции в крупных артериях вертебрально-базилярной системы нет достаточной доказательной базы, но имеющиеся исследования свидетельствуют об эффективности данной процедуры [24]. Перфузионные КТ и МРТ позволяют отбира ть пациентов с небольшой зоной инфаркта и большой зоной пенумбры, которым тромбоэкстракция может помочь, в том числе при позднем «терапевтическом окне», т. е. 6–24 ч после начала ОНМК. В исследовании SELECT когортный проспективный анализ 105 пациентов показал, что у людей с большой зоной инфаркта (до 100 мл) также может наблюдаться благоприятный исход после механической тромбэктомии [25].
В представленных нами клинических наблюдениях был продемонстрирован положительный эффект от механической тромбэктомии в течение 6 ч от начала ОНМК по ишемическому типу. Наше наблюдение согласуется с результатами многих исследований. Так, многоцентровое клиническое исследование в Нидерландах (2014 г.) продемонстрировало, что при окклюзии артерий бассейна ВСА внутриартериальное лечение, проводимое в течение 6 ч от начала ОНМК, является безопасным и дает положительный эффект. Среди данных пациентов механическая тромбэктомия проводилась в 83,7% случаев [26].
В представленных нами клинических наблюдениях механическая тромбэктомия с положительным эффектом была выполнена пациенткам старше 70 лет, что подтверждает целесообразность использования этого метода у данной когорты пациентов. Соответствующий вывод согласуется с результатами исследования, упомянутого выше, где отсутствовала разница в эффективности лечения среди лиц младше и старше 80 лет [26]. Другое много¶ 6ентровое клиническое исследование продемонстрировало эффективность эндоваскулярного лечения у пациентов всех возрастов [3]. Метаанализ [23] подтвердил положительный эффект механической тромбэктомии у пациентов 80 лет и старше.
Заключение
В последние годы значительно увеличилась доля пациентов, у которых острый ишемический инсульт можно лечить с помощью современных эндоваскулярных технологий. Успешная реканализация и низкая частота осложнений при механической тромбэктомии при ОНМК позволяют использовать этот метод лечения у пациентов пожилого и старческого e2озраста. Самая большая проблема, с которой сталкиваются специалисты в настоящее время, связана не с протоколами визуализации или техникой лечения ОНМК, а с организацией помощи при инсульте: как доставить пациента в нужную больницу в кратчайшие сроки.
Несмотря на развитие новых способов терапии пациентов с ОНМК, необходимо помнить, что изначально должны доминировать меры, направленные на профилактику возможных осложнений, а не на излечение пациентов, так как реперфузионная терапия спасает клетки в зоне пенумбры, но не может оживить погибшие нейроны в зоне инфаркта. Поэтому наибольший эффект может быть достигнут лишь при проведении профилактических мер до возникновения ОНМК.
.
Информация с rmj.ru

