Введение
Псориатический артрит (ПсА), или псориаз артопатический, — это хроническое воспалительное заболевание суставов, позвоночника и энтезисов, которое развивается у больных псориазом. Частота развития ПсА колеблется от 19,7 до 24,6% у лиц с различной тяжестью псориаза, обычно с умеренной и тяжелой формой кожных проявлений. Вместе с тем не всегда развитие ПсА ассоциировано с выраженностью кожного синдрома. Обычно ПсА дебютирует на фоне манифестного псориаза, реже дебют ПсА и псориаза совпадает по времени, а у 15–20% пациентов ПсА возникает до первых клинических проявлений псориаза [1].
По действующей классификации МКБ-10 суставные поражения при псориазе кодируются как L40.5 — псориаз артропатический либо определяются кодом M07.0–M07.3 — псориатические и энтеропатические артропатии. Особенностью ПсА является полиморфизм суставных проявлений. При ПсА чаще наблюдается воспаление периферических суставов по типу моно- или олигоартрита нижних конечностей, характерно поражение дистальных межфаланговых суставов, пальцев кистей и стоп (дактилит), энтезисов (энтезит), а также поражение позвоночника в виде остеита тел позвонков (спондилит) и/или илиосакральных сочленений (сакроилиит). Следует отметить, что все перечисленные формы подпадают под код L40.5 — псориаз артропатический. Вместе с тем в разделе M07 — псориатические и энтеропатические артропатии даны уточняющие коды: M07.0 — дистальная межфаланговая псориатическая артропатия; М07.1 — мутилирующий артрит; M07.2 — псориатический спондилит; M07.3 — другие псориатические артропатии1 [1].
Проблема ПсА по праву рассматривается как мультидисциплинарная, поскольку требует тесного взаимодействия дерматовенеролога и ревматолога. В связи с этим действующие национальные рекомендации по ведению пациентов с ПсА разработаны совместно Российским обществом дерматовенерологов и косметологов и Ассоциацией ревматологов России (АРР). Кроме того, характерные внесуставные проявления ПсА, а также чрезвычайно частое присутствие коморбидной патологии определяют вовлеченность специалистов разного профиля в ведение пациента с ПсА1. Следует отметить, что международные, в том числе европейские, рекомендации включают отдельные документы, разработанные Европейской противоревматической лигой (EULAR) и Группой по изучению и оценке псориаза и псориатического артрита (GRAPPA) [2, 3].
Содержание статьи
Инновационные аспекты ПсА
В обновленных рекомендациях ЕULAR по ПсА подчеркивается, что благодаря значительным достижениям последних лет прогноз при этом заболевании существенно улучшился [2]. Появились новые концепции, такие как очень ранний и даже доклинический ПсА, обновляются терапевтические цели, предлагается применение целостного подхода к управлению сопутствующими заболеваниями. В целом в течение последнего десятилетия парадигма ПсА претерпела серьезные изменения.
Наиболее значимыми инновационными аспектами ПсА следует считать отмеченную выше концепцию раннего и очень раннего ПсА, которая определяет окно возможностей для полного купирования активного воспаления и достижения стойкой клинической ремиссии [4]. В контексте данной парадигмы появилась дефиниция доклинической формы ПсА, или пре-ПсА. Исследованиями последних лет показано, что в развитии суставного поражения при псориазе можно выделить 3 стадии: доклиническую, субклиническую и продромальную [5]. Обоснованность такого подхода продиктована необходимостью предотвращения вовлечения суставов при псориатической болезни с помощью своевременной и рациональной биологической или таргетной терапии. Зарубежными экспертами была предложена концепция «treat-to-intercept» — «лечение для перехвата» развития ПсА, которая предусматривает активное лечение пациентов с псориазом в отсутствие клинических проявлений ПсА, т. е. с пре-ПсА [6–8]. Важным современным подходом к ведению пациентов с ПсА является выделение клинических фенотипов ПсА, а также доменов псориатической болезни. Как известно, эффективность современных терапевтических опций неодинакова у пациентов с различными формами поражения опорно-двигательного аппарата. Более того, внесуставные проявления ПсА также определяют ответ на противоревматическую терапию. В связи с этим действующие национальные и международные рекомендации выделяют ведущие клинические домены как ключевые факторы, определяющие выбор рациональной базисной терапии. К числу таких основных доменов относятся: периферический артрит, аксиальный спондилоартрит, энтезит, дактилит, поражение кожи, поражение ногтей, глаз и кишечника [3, 9].
Еще одним актуальным аспектом является концепция ПсА как мультидисциплинарной проблемы, что обусловлено высокой частотой ассоциированных заболеваний и состояний у лиц с псориазом и ПсА. Следует подчеркнуть, что коморбидная патология в значительной степени определяет тяжесть течения ПсА, риск неблагоприятных исходов и ограничивает возможности противоревматической терапии [9–11]. Безусловно, современным и оправданным подходом к ведению пациентов с псориатической болезнью является согласованная с пациентом терапевтическая тактика, а также оценка качества лечения на основании данных, полученных от пациента (Patient reported outcome — PRO) [3, 12].
Совершенствование стратегии ведения пациентов с ПсА, внедрение современных алгоритмов в реальную практику имеют огромное медицинское и социальное значение, поскольку позволяют улучшить качество жизни пациентов, предотвратить инвалидизацию и преждевременную смерть этой категории больных.
Ввиду чрезвычайной важности своевременной диагностики артрита, в том числе ПсА, разработаны клинические рекомендации по раннему артриту [13]. Как правило, при первом медицинском контакте ранний артрит определяют как «недифференцированный артрит». Недифференцированный артрит может быть ранней стадией широкого спектра ревматических заболеваний, прежде всего ревматоидного артрита, аксиального спондилоартрита, анкилозирующего спондилита и, конечно, ПсА [10]. При невозможности поставить определенный диагноз у пациентов с ранним артритом следует оценить факторы риска развития стойкого и/или эрозивного артрита, к которым относятся такие показатели, как число припухших суставов, маркеры воспаления (СОЭ, С-реактивный белок (СРБ)), иммунологические маркеры (ревматоидный фактор, антитела к циклическому цитруллинированному пептиду), признаки структурных нарушений по данным УЗИ, МРТ, КТ суставов и периартикулярных тканей. Даже в отсутствие достоверного диагноза конкретной нозологической формы у лиц с персистирующим артритом при наличии перечисленных факторов риска базисная терапия должна быть назначена в течение первых 12 нед. [1, 13].
Современные алгоритмы диагностики ПсА
Что касается ранней диагностики ПсА, то он должен быть заподозрен у больного псориазом со следующими симптомами1:
-
воспалительная боль или припухлость периферических суставов;
-
воспалительная или ночная боль в аксиальном скелете;
-
энтезит (главным образом, ахиллово сухожилие или плантарная фасция);
-
дактилит — припухлость всего пальца в момент осмотра или дактилит в анамнезе, зафиксированный врачом-ревматологом.
Для врачей общей практики и дерматовенерологов предложен простой алгоритм первичной диагностики ПсА на основе мнемоники (PSA): P — pain in joints (боль в суставах), S — stiffness (скованность), A — axial / spine involvement (аксиальное поражение). Любые 2 положительных утверждения позволяют думать о ПсА, при этом наличие скованности и аксиального вовлечения без периферического артрита предполагают ПсА с аксиальным поражением. Подтверждение либо исключение диагноза ПсА является зоной ответственности специалиста-ревматолога, который принимает соответствующее решение после полного клинического обследования [9].
В диагностике и оценке тяжести течения ПсА и других форм спондилоартритов (СпА) особое место занимают поражения энтезисов. Клиническое и прогностическое значение энтезитов при СпА и ПсА обусловлено следующими моментами. Энтезиты часто возникают в дебюте заболевания, они отражают его активность, ассоциированы с быстрой структурной прогрессией, являются факторами неблагоприятного прогноза и в связи с этим рассматриваются как основание для применения биологической и таргетной терапии. Как отмечалось ранее, нет четкой корреляции между тяжестью кожных и суставных проявлений при псориатической болезни, тем не менее в ряде когортных наблюдений показана более высокая частота манифестации ПсА у лиц с распространенным псориазом [2, 14, 15]. Диагностика энтезита строится на клинических признаках: боль, реже припухлость в точках энтезисов. При осмотре определяются болезненные точки следующей локализации: верхний край надколенника, края (крылья) подвздошных костей, трохантеры, место прикрепления ахиллова сухожилия и подошвенного апоневроза к пяточной кости, латеральный надмыщелок плечевой кости, медиальный мыщелок бедренной кости. Верификация энтезитов требует визуализации с помощью УЗИ и/или МРТ [1, 12].
Диффузное воспаление всего пальца — дактилит возникает в результате одновременного поражения сухожилий сгибателей и/или разгибателей пальцев и артрита межфаланговых суставов. Клинически проявляется болью, равномерной припухлостью с цианотично-багровым окрашиванием кожных покровов, плотным отеком всего пальца, болевым ограничением сгибания, формируется характерная для ПсА «сосискообразная» деформация пальца. Дактилит рассматривается как фактор неблагоприятного прогноза и яркий признак активного ПсА1 [3, 9].
Фенотипы ПсА
Согласно действующей клинической классификации выделяют 5 форм или фенотипов артрита при псориазе1 [1]:
Дистальная форма — поражение дистальных межфаланговых суставов кистей и стоп (L40.5, М07.0); характеризуется преимущественным вовлечением дистальных суставов пальцев кистей и стоп, ведет к «редискообразной» деформации пальцев, может сочетаться с другими фенотипами артрита, а также с псориазом ногтей. При дистальной форме нередко наблюдается осевой артрит — одновременное поражение трех суставов одного пальца.
Мутилирующий артрит (L40.5, М07.1) представляет собой редкую клиническую форму, наблюдается примерно у 5% больных ПсА. Характеризуется распространенной резорбцией суставных поверхностей (остеолиз) с укорочением пальцев кистей и/или стоп и формированием «телескопической деформации», разнонаправленных подвывихов пальцев конечностей. Следует иметь в виду, что локальный (ограниченный) остеолиз суставных поверхностей может развиваться при всех клинических вариантах ПсА.
Псориатический спондилит (L40.5, М07.2) характеризуется воспалительным поражением позвоночника, как при анкилозирующем спондилите (АС), у половины больных сочетается с периферическим артритом, редко (2–4%) наблюдают изолированный спондилит и/или сакроилиит. В 25% случаев сакроилиит и спондилит при ПсА протекают латентно, без боли. Сакроилиит при ПсА, в отличие от АС, часто асимметричный [1, 10]. Для ПсА характерно медленное рентгенологическое прогрессирование сакроилиита, полный анкилоз крестцово-подвздошных сочленений на фоне длительного течения заболевания отмечается значительно реже, чем при АС (до 6% пациентов).
Асимметричный моно-олигоартрит (L40.5, М07.3) является самым частым фенотипом: он встречается у большинства больных с ПсА — до 70%. Как правило, вовлекаются суставы нижних конечностей (коленные, лучезапястные, голеностопные, мелкие суставы стоп), но возможно поражение и верхних конечностей (обычно локтевые и межфаланговые суставы). При олигоартрите общее число воспаленных суставов не превышает четырех.
Симметричный полиартрит, или ревматоидоподобная форма (L40.5, М07.3), наблюдается значительно реже, чем асимметричный олигоартрит. Характеризуется вовлечением парных суставных областей, как при ревматоидном артрите. Часто ПсА протекает как асимметричный полиартрит пяти или более суставов.
Диагноз ПсА
Диагноз ПсА устанавливают в соответствии с действующими критериями CASPAR (ClASsification criteria for Psoriatic ARthritis, 2006) [1], согласно которым пациент должен иметь признаки воспалительного заболевания суставов (артрит или спондилит, или теносиновит, или энтезит) и удовлетворять 3 или более критериям из 5: псориаз, семейный анамнез псориаза; ониходистрофия; отрицательный РФ; дактилит при осмотре или в анамнезе; рентгенологические признаки внесуставной костной пролиферации по типу краевых разрастаний (кроме остеофитов) на рентгенограммах кистей и стоп.
Активный ПсА — это ≥1 ЧБС/ЧПС (число болезненных суставов, число припухших суставов), и/или болезненный энтезис, и/или дактилит, и/или воспалительная боль в спине (спондилит). Для оценки активности периферической формы ПсА может применяться индекс DAS28, для оценки активности аксиальной формы — индексы BASDAI и ASDAS. В клинических исследованиях для более точной оценки ответа на терапию применяется индекс DAPSA (Disease Activity index for PSoriatic Arthritis)1 [9]:
DAPSA = ЧПС (из 66) + ЧБС (из 68) + ОЗП (ВАШ, см) + ОБП (ВАШ, см) + CРБ (мг/дл),
где ОЗП — общая оценка состояния здоровья пациентом, ОБП — оценка боли пациентом.
Степени активности по DAPSA: ремиссия ≤4, низкая активность ≤14, умеренная активность ≤28, высокая активность >28. Сотрудниками НИИ ревматологии им. В.А. Насоновой предложен новый интегральный энтезиально-коморбидный индекс оценки активности ПсА, учитывающий наличие энтезитов и ассоциированных состояний [11].
При оценке тяжести течения ПсА и риска осложнений необходимо учитывать факторы неблагоприятного прогноза, к которым относятся полиартрит (≥5 болезненных либо припухших суставов), наличие структурных нарушений — эрозий при рентгенологической, МРТ или УЗ-визуализации, повышение СОЭ или уровня СРБ, дактилит, функциональные нарушения.
Сложность диагностики и лечения пациентов с ПсА обусловлена тем, что в воспалительный процесс вовлечен не только опорно-двигательный аппарат (суставы, позвоночник, энтезы), но и кожа, ногти (псориаз), желудочно-кишечный тракт (воспалительные заболевания кишечника), глаза (увеит, иридоциклит). В клинической практике псориаз ногтей нередко трактуется как онихомикоз, поэтому поиск иммуновоспалительного процесса начинается лишь после манифестации увеита, сакроилиита либо другого признака ПсА. Еще один фактор, негативно влияющий на своевременность и качество специализированной помощи, — это коморбидность. Как известно, пациенты с ПсА характеризуются более высоким риском развития ожирения, инсулинорезистентности, сахарного диабета 2 типа, метаболического синдрома, артериальной гипертонии, дислипидемии, сердечно-сосудистых заболеваний, ряда нервно-психических расстройств и фибромиалгии по сравнению с общей популяцией1 [2, 9].
Этиопатогенез ПсА — ключ к патогенетической терапии
По усредненным данным, частота развития ПсА у лиц с псориазом достигает 30%. Как следует из современных рекомендаций, ПсА является гетерогенным и потенциально тяжелым заболеванием, в развитии которого играет роль широкий спектр факторов риска [2, 3]. Этиопатогенез ПсА схематично можно представить как результат взаимодействия генетических и средовых факторов, приводящего к активации иммунной системы и нарушению иммунологической толерантности к собственным тканям. Иммунопатологические реакции лежат в основе системного и локального воспаления, усиленной васкуляризации, прогрессирующих тканевых повреждений, характерных для ПсА (рис. 1) [15–17].
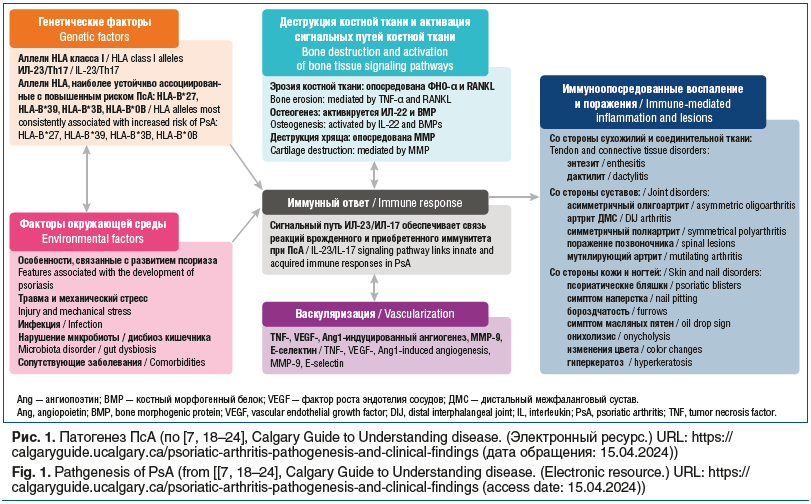
Как известно, псориаз относится к заболеваниям, наследуемым в семьях. Неслучайно действующие диагностические критерии включают пункт семейного анамнеза по псориазу. Среди генетических факторов псориаза и ПсА присутствует ряд аллелей, кодирующих антигены главного комплекса гистосовместимости (HLA) I класса, ассоциированных с риском развития псориатической болезни. Наряду с этим доказана роль генов, кодирующих ось ИЛ-23/Th17 в манифестации заболевания и его неблагоприятного течения [16].
Что касается риска развития псориаза, то установлено, что антиген HLA-C*06:02 ассоциирован с псориазом (отношение шансов 6,61 в сравнении с 1,97 для ПсА), а также с дебютом псориаза до развития ПсА (приблизительно на 8 лет раньше) [7, 16]. Аллели HLA, наиболее устойчиво ассоциированные с повышенным риском развития ПсА, включают следующие локусы: HLA-B27, HLA-B39, HLA-B38, HLA-B08 [17, 25]. Некоторые локусы генетического риска, связанные с предрасположенностью к ПсА, также указывают на предрасположенность к псориазу, например, IL12B и TRAF3IP2(участвующие в оси ИЛ-23/ИЛ-17) [5, 25, 26].
Целый ряд факторов внешней среды выступают возможными триггерами хронической активации иммунной системы при наличии генетической предрасположенности. Установлено, что механический стресс способствует псориатическому поражению сустава. Для внутрисуставных и периартикулярных структур после механического стресса характерно повреждение коллагеновых волокон с последующей инфильтрацией иммунными клетками, усилением васкуляризации, неоангиогенезом и образованием нервных окончаний под действием медиаторов воспаления, хемокинов и эндотелиальных факторов роста (VEGF, NGF и PGE2) [16, 26].
Нарушения микробиоты при псориазе рассматриваются как дополнительный фактор риска ПсА при наличии генетической предрасположенности. Дисбиоз кишечника ведет к дефекту эпителиального барьера и может быть следствием дисбаланса нативного и адаптивного иммунитета. Пенетрация микробных антигенов приводит к нарушению толерантности к тканевым антигенам с развитием ауто-иммунных реакций. Обнаружение бактериальной ДНК у пациентов с ПсА трактуется как следствие повышенной проницаемости кишечных эпителиальных барьеров. Кроме того, дисбиоз кишечника вносит определенный вклад в развитие кишечных проявлений ПсА [27].
В последние годы получены убедительные данные о патогенетической роли провоспалительного цитокина ИЛ-17, вырабатываемого субпопуляцией Т-лимфоцитов Th17. Другие иммунные клетки, такие как γδ-Т-клетки и естественные киллеры (NK-клетки), также могут синтезировать ИЛ-17. Клетки Th17 дифференцируются из наивных Т-клеток в присутствии трех потенциальных комбинаций цитокинов: 1) ИЛ-6 и трансформирующий фактор роста β (TGF-β) с дополнительным потенцирующим эффектом ИЛ-1β и ФНО-α; 2) ИЛ-21 и TGF-β; и 3) ИЛ-6, ИЛ-1β и ИЛ-23 [18, 19]. Клетки Th17 продуцируют не только провоспалительный цитокин ИЛ-17, но и другие медиаторы: MMP-3, CCL1, CCL20 и ИЛ-6. ИЛ-17 реализует свой биологический эффект, связываясь с рецепторами ИЛ-17 (ИЛ-17R), представленными пятью специфичностями: ИЛ-17RA, RB, RC, RD и RE. Для клеточного ответа на стимуляцию наиболее важных сигнальных путей — ИЛ-17A и ИЛ-17F — требуются обе составляющие. При активации клетки Th17 высвобождают эффекторные молекулы, способные активировать различные клетки-мишени, такие как остеокласты, В-клетки и макрофаги, которые ответственны за специфическую для заболевания воспалительную реакцию. При ПсА иммунная активация и связанная с ней экспрессия провоспалительных цитокинов наиболее выражены на уровне суставов / синовиальной оболочки и кожи [18, 28]. Сигнальный путь ИЛ-23/ИЛ-17 обеспечивает связь реакций врожденного и приобретенного иммунитета при ПсА [16, 19].
Интерлейкин 23, состоящий из субъединиц р19 и р40 и продуцируемый в основном дендритными клетками, макрофагами и кератиноцитами, воздействует на многочисленные клетки-мишени посредством ИЛ-17-зависимого либо ИЛ-17-независимого механизма. В первом случае ИЛ-23 стимулирует клетки Th17 через ИЛ-23R и индуцирует высвобождение таких молекул, как ИЛ-17 или ИЛ-22. Они, связываясь со своими родственными рецепторами ИЛ-17R или ИЛ-22R, в конечном итоге активируют эффекторные клетки: кератиноциты, В-клетки, предшественники остеокластов, макрофаги и фибробластоподобные синовиоциты. Возможен альтернативный путь воздействия ИЛ-23 на ту же подгруппу клеток-мишеней без помощи ИЛ-17. Общий эффект активации пути ИЛ-23 заключается в привлечении воспалительных клеток в пораженную ткань. Важным биологическим эффектом ИЛ-23 является его влияние на выживание и размножение Th17-клеток [19, 28].
Наряду с этим ИЛ-23 играет Th17-независимую критическую роль в гомеостазе и ремоделировании костей: индуцируя экспрессию активатора рецептора ядерного фактора kB (RANKL) в синовиальных фибробластах и повышая экспрессию рецептора RANK в предшественниках остеокластов, ИЛ-23 в конечном итоге способствует дифференцировке остеокластов и остеокластогенезу [19]. Исследования экспрессии геномных ассоциаций (GWAS) и белков у человека показали, что ИЛ-23p19 и p40, ИЛ-22, ИЛ-17 и родственные им рецепторы могут быть обнаружены в псориатических очагах на коже и в воспаленной синовиальной оболочке [19, 29], что позволяет предположить, что они могут быть мишенями для лечения, направленного на ингибирование оси ИЛ-23/ИЛ-17.
Фармакотерапия ПсА
Цель терапии ПсА — достижение ремиссии или уменьшение основных клинических проявлений заболевания до минимальных, замедление или предупреждение рентгенологической прогрессии, увеличение продолжительности жизни пациентов и улучшение ее качества1 [2]. Стратегия лечения определяется как «лечение до достижения цели» (T2T — Treat-to-target), где цель — ремиссия, альтернативная цель — низкая активность. В течение последнего десятилетия фармакологические возможности расширились и были одобрены новые препараты, действующие на разные мишени патогенеза ПсА и псориаза. Препараты, лицензированные для лечения ПсА, теперь включают (1) обычные синтетические противоревматические препараты, модифицирующие течение заболевания (DMARDs), такие как метотрексат, сульфасалазин и лефлуномид; (2) биологические DMARDs, воздействующие на ФНО-α, ИЛ12/23 или рецепторы ИЛ-23 и пути ИЛ-17A и ИЛ-17A/F; и (3) таргетные синтетические DMARDs, которые ингибируют янус-киназы (JAK) или фосфодиэстеразу 4 (PDE4). Появились новые данные о безопасности используемых при воспалительном артрите препаратов, в частности, во всем мире появилось предостережение в отношении ингибиторов JAK [2]. Следует подчеркнуть, что зарубежные рекомендации, в отличие от национальных российских, включают абатацепт в число препаратов, применяемых для лечения ПсА [2, 9].
Домены ПсА в выборе лечения
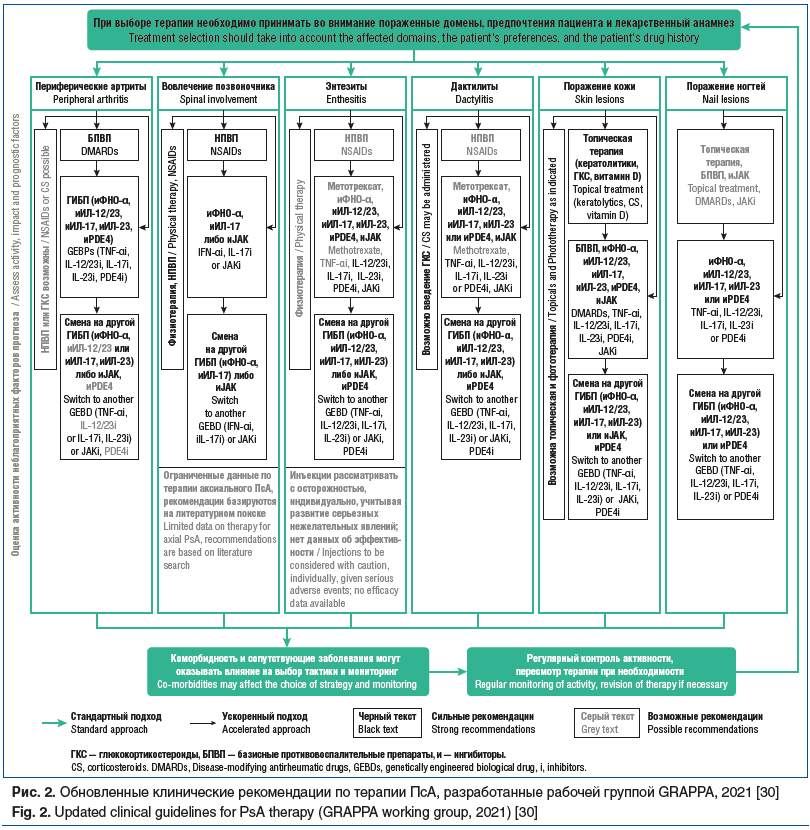
Дифференцированный подход к выбору оптимальной тактики ведения пациентов с ПсА предложен в рекомендациях GRAPPA, 2021; EULAR, 2023; ACR/NPF, 2018; национальных рекомендациях АРР, 2021. Как следует из этих документов, алгоритм терапии зависит от тяжести ПсА и псориаза, клинических проявлений (фенотип артрита, пораженные домены), факторов риска неблагоприятного течения ПсА, предшествующего лекарственного анамнеза, а также предпочтений пациента1 [2, 3, 9].
Касаясь доменов поражения или вариантов манифестации ПсА, следует отметить, что они представлены периферической либо аксиальной формой, наличием энтезитов, дактилитов, поражения кожи, ногтей, глаз, кишечника. Указанный спектр доменов определяет выбор стандартной базисной терапии, генно-инженерных биологических препаратов (ГИБП) и таргетных средств (рис. 2). Так, периферический артрит является показанием к применению метотрексата и других традиционных иммунодепрессантов. При аксиальной форме ПсА после неэффективности НПВП должны быть применены ГИБП или ингибиторы JAK. Наличие энтезитов и дактилитов, а также поражения кожи и ногтей также является прямым показанием к лечению ГИБП либо ингибиторами JAK. При развитии увеита предпочтение отдается ингибиторам ФНО-α, за исключением этанерцепта, при поражении кишечника также рекомендованы ингибиторы ФНО-α, кроме этанерцепта, ингибиторы ИЛ-12/23 и ингибиторы JAK, при этом не рекомендовано применение ингибиторов ИЛ-17 [2, 9].
Согласно указанным рекомендациям последовательность назначения фармакотерапии может быть разделена на 4 фазы: I фаза — начало терапии с применением НПВП и локальных ГКС, II фаза — при периферическом артрите — стандартные базисные средства (метотрексат), при аксиальной форме — переход к фазе III, предусматривающей применение ГИБП и таргетных препаратов, IV фаза — смена ГИБП или таргетных препаратов при недостижении цели на этапе III фазы. Следует отметить, что в целом рекомендации АРР вполне согласуются с международными, прежде всего, в плане стратегии ведения пациентов с ПсА. Вместе с тем в российских рекомендациях пока остается ингибитор кальциневрина циклоспорин, но нет абатацепта, включенного в рекомендации ACR, 2018; EULAR, 2023.
Блокада ИЛ-23 как перспективный метод лечения ПсА
Клиническая гетерогенность ПсА частично обусловлена перекрестными иммунологическими нарушениями вследствие передачи сигнала через ось ИЛ-23/ИЛ-17 от эпителиальных клеток к суставным тканям [27, 18]. Как отмечалось выше, ИЛ-23 вырабатывается преимущественно дендритными клетками, макрофагами и кератиноцитами и воздействует на многочисленные клетки-мишени либо с помощью ИЛ-17-зависимого, либо с помощью ИЛ-17-независимого механизма. Экспериментальные исследования показали, что ингибирование ИЛ-23 может предотвращать дифференцировку наивных Т-клеток в клетки Th17. В связи с этим благодаря блокаде ИЛ-23 предотвращается последующая выработка провоспалительных цитокинов, которые опосредуют развитие заболевания при ПсА [5, 31]. В настоящее время для ингибирования ИЛ-23 применяются два препарата, зарегистрированных в РФ, — гуселькумаб и рисанкизумаб.
Гуселькумаб и рисанкизумаб являются моноклональными антителами, направленными против субъединицы p19 ИЛ-23, они обладают уникальными молекулярными свойствами, которые могут иметь большое функциональное значение, определяющее преимущество препарата перед другими биологическими агентами. Хотя гуселькумаб и рисанкизумаб связывают и нейтрализуют ИЛ-23 с одинаковой высокой аффинностью и активностью, гуселькумаб дополнительно блокирует рецептор FcyRI/CD64 моноцитов человека дозозависимым образом, в то время как рисанкизумаб этого не делает в силу мутации в его Fc-области. Следует подчеркнуть, что даже при связывании с клеточным рецептором FcyRI/CD64 не теряется способность гуселькумаба блокировать ИЛ-23. Более того, связывание гуселькумаба с FcyRI/CD64 в моноцитах человека, индуцирующих воспаление, не приводит к их активации в плане выработки провоспалительных цитокинов. Это имеет особое значение, так как многочисленные исследования показали, что мононуклеарные фагоциты FcγRI/CD64+ аккумулируются в псориатической коже и служат основным источником ИЛ-23. Еще один важный феномен был установлен в результате экспериментальных и клинических исследований: блокада ИЛ-23 гуселькумабом уменьшает количество Т-клеток памяти, «спящих» в тканях, что объясняет поддержание клинического ответа и более стойкую ремиссию при использовании данного препарата [28, 32, 33].
Таким образом, уникальность действия гуселькумаба обусловлена комбинированным воздействием на разные мишени: связывание как с ИЛ-23, так и с CD64+-клетками, что может обеспечивать более устойчивый ответ на терапию по сравнению с другими ингибиторами ИЛ-23 и ингибитором ИЛ-12/23 [33].
Клиническая эффективность и безопасность гуселькумаба были доказаны целым рядом мультицентровых исследований. В исследованиях DISCOVER1, DISCOVER2 была продемонстрирована высокая терапевтическая эффективность этого препарата у пациентов с ПсА, как бионаив-ных, так и после неэффективности ингибиторов ФНО-α [34–36]. Возможность применения гуселькумаба при аксиальной форме ПсА была изучена в исследованиях STAR и COSMOS [37]. Продолжаются сравнительные исследования по оценке динамики экспрессии генов после лечения биологическими агентами у пациентов с активным ПсА (исследование TIGER), влияния гуселькумаба на рентгенологическое прогрессирование ПсА, а также влияние на внескелетные проявления псориатической болезни [18, 38].
По мере получения конкретных результатов появляются публикации в ведущих международных изданиях, демонстрирующие высокий эффект препарата при псориазе и ПсА. Весьма обнадеживающим феноменом следует считать возможность предотвращения суставного поражения или его прогрессирования у лиц с псориазом при своевременно начатом лечении гуселькумабом [15, 29].
Спускаясь с высоты научных поисков и перспективных исследований на землю реальной практики, приходится констатировать, что ингибиторы ИЛ-23, как правило, являются препаратами 2–3-й линии и рассматриваются как альтернатива другим ГИБП или таргетным препаратам при резистентном течении ПсА [39, 40]. При этом опытные специалисты нередко сталкиваются с феноменом «полирезистентности» пациентов, когда смена препарата не приводит к достижению цели. Причем чем больше препаратов было ранее применено, тем труднее добиться контроля заболевания. Следует учитывать, что возможно развитие псориаза при лечении ГИБП [41]. Особенно трудной бывает эта задача у полиморбидных пациентов, при наличии спектра ассоциированных с ПсА заболеваний, влияющих на тяжесть ПсА и на возможность маневра при выборе оптимальных терапевтических опций [39].
В качестве примера, демонстрирующего реализацию стратегии T2T на практике у коморбидного пациента с ПсА, приводим собственное клиническое наблюдение. Следует отметить, что пациент наблюдается нами в течение длительного периода, история его заболевания и предыдущего лечения обсуждалась нами в публикации [42], в которой был показан хороший эффект при использовании ингибитора ИЛ-17. Однако в последующем вновь наступило обострение заболевания, потребовавшее изменения схемы лечения.
Клиническое наблюдение
Пациент К., 1981 г. р., находится под наблюдением ревматолога с 2017 г. С 20 лет страдает псориазом. Лечился у дерматовенеролога, получал местную терапию, терапию системными ГКС (дексаметазон 8 мг парентерально коротким курсом в период стационарного лечения). В последующем пациент по собственной инициативе продолжил инъекции дексаметазона в амбулаторных условиях в течение не менее 2 лет в дозе 2–4 мг в/м ежедневно. В 2017 г. впервые обратился к ревматологу по поводу болей в суставах и позвоночнике, самостоятельно принимал НПВП. Ревматологом в амбулаторных условиях была назначена базисная терапия метотрексатом 25 мг в неделю, отменен дексаметазон, рекомендован плановый прием НПВП. Несмотря на это, в течение последующего периода отмечал усиление болей в коленных, плечевых, тазобедренных суставах, выраженное ограничение активных и пассивных движений из-за болей в плечевых, тазобедренных суставах и выраженную скованность в утренние часы. По данным лабораторных исследований, имело место повышение уровня СРБ, ускорение СОЭ до 30 мм/ч. При рентгенографии суставов выявлен асептический некроз головок обеих бедренных костей; определялись энтезопатии плечевых, локтевых суставов. Наряду с усилением суставного синдрома увеличивалась площадь поражения кожи. В 2018 г. пациент поступил в клинику факультетской терапии на базе ГУЗ «Клиническая больница № 4» г. Волгограда.
При сборе анамнеза предъявлял жалобы на боли воспалительного характера в плечевых, коленных, тазобедренных суставах, ограничение движений в плечевых, тазобедренных суставах, боли воспалительного характера в пояснично-крестцовом отделе позвоночника, скованность в позвоночнике, боли и припухлость голеностопных суставов.
При осмотре состояние удовлетворительное. Псориатические высыпания на коже груди, живота, разгибательных поверхностях нижних и верхних конечностей по типу эритродермии, индекс PASI составил 10,3. Гиперстенического телосложения, повышенного питания. ИМТ 38 кг/м2 (ожирение 2-й степени). Периферические лимфоузлы не пальпируются. В легких дыхание везикулярное, хрипов нет. Частота дыхательных движений (ЧДД) 20 в 1 мин. При аускультации сердца тоны ритмичные, шумов нет, частота сердечных сокращений (ЧСС) 80 в 1 мин, АД 140/90 мм рт. ст. Живот мягкий, безболезненный при пальпации. Симптом поколачивания отрицательный с обеих сторон. Нарушений стула и мочеиспускания не отмечает. Отеков нет.
Status localis. Голеностопные суставы деформированы за счет экссудативных явлений, пальпация их болезненна, движения ограничены, имеется локальная гипертермия. Отмечается болезненность и ограничение движений в правом плечевом суставе, в обоих тазобедренных суставах. Имеется болезненность при отведении правого плеча и заведении руки за спину. Локальная болезненность в точках прикрепления длинной головки бицепса и надостной мышцы справа.
При рентгенографии пораженных суставов и позвоночника подтверждены асептические некрозы головок обеих бедренных костей, признаки остеоартрита тазобедренных суставов III стадии, эрозивный артрит голеностопных суставов. При МРТ пояснично-крестцового отдела позвоночника и правого плечевого сустава обнаружен двусторонний сакроилиит II стадии, синовит правого плечевого сустава, теносиновит длинной головки бицепса и тендинит надостной мышцы справа с подакромиальным импинджмент-синдромом. При УЗИ органов брюшной полости выявлены признаки стеатогепатита, микролиты левой почки. В биохимическом анализе крови: гиперурикемия 442 мкмоль/л, креатинин 82 мкмоль/л.
На основании жалоб пациента, истории заболевания, клинических, лабораторных, инструментальных данных был установлен диагноз: псориатический артрит с поражением плечевых, голеностопных, тазобедренных суставов и позвоночника, двусторонний сакроилиит II стадии, активность 3 (DAS28 5,41, DAPSA 28,5), рентгенологическая стадия III, ФК III. Теносиновит длинной головки бицепса, синовит правого плечевого сустава. Тендинит сухожилия надостной мышцы с развитием подакромиального импинджмент-синдрома. Стероидозависимость. Псориаз, псориатическая эритродермия, индекс PASI 10,3. Асептический некроз головок обеих бедренных костей. Вторичный остеоартроз тазобедренных суставов, стадия III, ФК II–III. Артериальная гипертензия, степень 2, риск 3. Неалкогольная жировая болезнь печени. Мочекаменная болезнь. Микролиты левой почки. Хроническая болезнь почек С1. Ожирение 2-й степени (ИМТ 38 кг/м2).
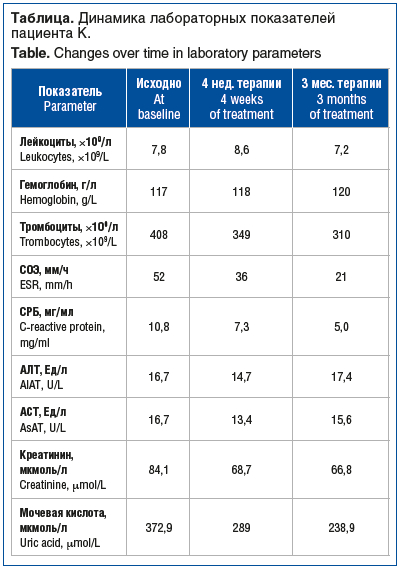
В связи с неэффективностью стандартной базисной и противовоспалительной терапии, стероидозависимостью пациенту была рекомендована инициация терапии ингибитором ИЛ-17 после проведенного скрининга для исключения латентного туберкулеза: диаскин-тест отрицательный, рентгенограмма органов грудной клетки: легкие без очаговых и инфильтративных теней. В июле 2019 г. пациенту была инициирована биологическая терапия ингибитором ИЛ-17 секукинумабом 300 мг п/к с последующим введением препарата 1 раз в месяц. Уже после 2-й инъекции секукинумаба пациент отметил уменьшение болей в плечевых, голеностопных, коленных суставах, увеличение объема движений в суставах. Значительно сократилась площадь поражения кожи. Через 3 мес. терапии была достигнута умеренная клинико-лабораторная активность заболевания: снижение индекса PASI с 10,3 до 6,7, индекса DAS28 с 5,41 до 4,1, уровня СРБ до 5 мг/л (норма). В связи с уменьшением площади кожных проявлений стала возможной подготовка к проведению планового эндопротезирования тазобедренных суставов.
В 2021 и 2022 гг. было выполнено тотальное эндопротезирование обоих тазобедренных суставов, после оперативного лечения увеличился объем движений в суставах, пациент стал более активным, вернулся к трудовой деятельности, полностью отказался от приема системных ГКС, было достигнуто снижение индекса массы тела до 25,2 кг/м2. При анализе выраженности артрита низкая активность по индексу DAS28 — 2,4, псориатических высыпаний на коже не обнаружено, индекс PASI составил 1. Пациент продолжал принимать метотрексат, дозу уменьшил до 15 мг/нед.
В январе 2023 г. после перенесенной вирусной инфекции отметил выраженное ухудшение состояния: вновь усилились боли в суставах плечевых, коленных, суставах стоп, появились выраженные высыпания на коже груди, живота, верхних и нижних конечностей по типу эритродермии, продолжение терапии секукинумабом в дозе 300 мг п/к не давало эффекта: кожные проявления, суставной синдром — без динамики. В связи с этим был повторно госпитализирован. При осмотре состояние средней тяжести, ИМТ 26,5 кг/м2. На коже груди, спины, живота, верхних и нижних конечностей высыпания по типу эритродермии, местами сливного характера (рис. 3А). В легких дыхание везикулярное, хрипов нет, ЧДД 20 в 1 мин. Тоны сердца ритмичные, ясные, ЧСС 80 в 1 мин, АД 130/80 мм рт. ст. Живот мягкий, безболезненный при пальпации. Симптом поколачивания отрицательный с обеих сторон. Стул, диурез в норме. Отеков нет.
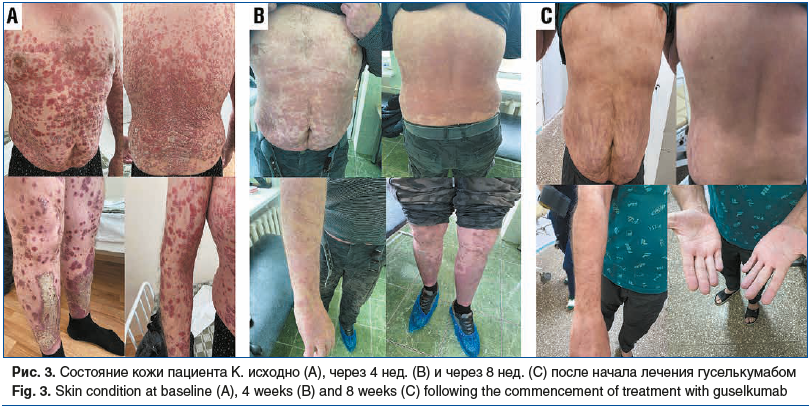
При осмотре суставов отмечалась припухлость и гипертермия в области правого голеностопного сустава, пальпация его была болезненна, движения ограничены из-за болей. Пальпация плечевых суставов болезненна, движения ограничены, объем отведения уменьшен до 80°. Локальная болезненность при пальпации сухожилия надостной мышцы справа. Индекс DAPSA 35,7, индекс PASI 56,4.
В анализах крови при поступлении отмечалось повышение СОЭ, уровня СРБ, мочевой кислоты (см. таблицу). В связи с выраженной активностью ПсА, увеличением площади поражения кожи, неэффективностью ранее проводимой терапии ГИБП (секукинумаб) было принято решение о переключении пациента на ингибитор ИЛ-23 гуселькумаб по стандартной схеме. Противопоказаний к продолжению биологической терапии не было (диаскин-тест отрицательный, рентгенография органов грудной клетки — без патологии). Пациенту инициирована терапия гуселькумабом в дозе 100 мг п/к. Первое введение препарата пациент перенес хорошо. Через 4 нед. повторная госпитализация — для введения второй дозы гуселькумаба 100 мг п/к, без побочных явлений. Уже на этом сроке пациент отметил улучшение состояния: уменьшились боли в суставах, прошли явления синовита в голеностопном суставе, потускнели высыпания на коже груди, спины, живота (рис. 3B), высыпания практически утратили сливной характер, прошел зуд кожи. Наблюдалась положительная динамика лабораторных показателей (см. таблицу): снижение СОЭ, уровня СРБ. Следующая госпитализация через 2 мес. показала выраженную положительную клинико-лабораторную динамику: высыпания на коже груди, живота, верхних и нижних конечностей практически разрешились, кожа очистилась полностью (рис. 3C), суставной синдром был полностью купирован, в анализах крови: СОЭ 21 мм/ч, СРБ 5 мг/л, биохимические показатели крови в норме (см. таблицу). Пациенту была выполнена третья инъекция гуселькумаба 100 мг п/к, которую он перенес хорошо. Достигнутый индекс DAPSA — 6,1 (низкая активность), индекс PASI — 2 (после 3 инъекций).
Обсуждение. В представленном клиническом наблюдении у пациента с тяжелым ПсА высокой активности, поздней клинической стадии, с мультиморбидностью и стероидозависимостью после периода низкой активности на ингибиторе ИЛ-17 развилась вторичная неэффективность, потребовавшая смены схемы лечения. Уже через 1 мес. от начала лечения гуселькумабом был получен ответ в виде уменьшения выраженности суставного и кожного синдрома, а через 3 мес. достигнута низкая активность ПсА по индексу DAPSA, снижение индекса PASI до 2. Полученный результат свидетельствует о возможности переключения пациентов на гуселькумаб в случае неэффективности предшествующей терапии, включая резистентность к ГИБП с другим механизмом действия. Хорошая переносимость препарата позволяет использовать его при лечении пациентов с коморбидной патологией.
Заключение
В заключение необходимо отметить, что ПсА остается одной из наиболее трудных проблем современной ревматологии в связи с полиморфизмом клинической картины, возможным субклиническим течением заболевания на ранних стадиях, быстрым развитием суставной деструкции, высокой степенью коморбидности, недостаточным ответом на адекватную противоревматическую терапию. Обновленные международные и национальные клинические рекомендации ставят перед специалистами амбициозную цель — достижение ремиссии или низкой активности ПсА. Современная стратегия «лечение до достижения целей» позволяет предотвратить прогрессирование ПсА, значимо повысить качество жизни пациентов и снизить риск неблагоприятных исходов. В последние годы разработана концепция «лечение для перехвата ПсА», которая предусматривает раннее применение ГИБП из группы ингибиторов ИЛ-23, способных прервать цепь иммунопатологических реакций, опосредуемых осью ИЛ-17/ИЛ-23. Вместе с тем остается серьезным вызовом ведение пациентов с тяжелым псориазом и ПсА, резистентных к стандартной терапии и ГИБП. Как показал наш собственный клинический опыт, при вторичной неэффективности биологических агентов, в частности ингибитора ИЛ-17, переключение пациента на ингибитор ИЛ-23 гуселькумаб позволяет добиться цели лечения.
1Клинические рекомендации. Псориаз артропатический. Псориатический артрит. 2021. (Электронный ресурс.) URL: http://disuria.ru/_ld/10/1094_kr21L40M07MZ.pdf?ysclid=lv2it1rct276528687 (дата обращения: 14.03.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Бабаева Аида Руфатовна — д.м.н., профессор, заведующая кафедрой факультетской терапии ФБГОУ ВО ВолгГМУ Минздрава России; 400131, Россия, г. Волгоград, пл. Павших борцов, д. 1; ORCID iD 0000-0002-7588-8089.
Калинина Елена Валерьевна — к.м.н., доцент, доцент кафедры факультетской терапии ФБГОУ ВО ВолгГМУ Минздрава России;400131, Россия, г. Волгоград, пл. Павших борцов, д. 1; ORCID iD 0000-0002-1762-6056.
Звоноренко Максим Сергеевич — ассистент кафедры факультетской терапии ФБГОУ ВО ВолгГМУ Минздрава России; 400131, Россия, г. Волгоград, пл. Павших борцов, д. 1; ORCID iD 0000-0002-5335-9151.
Солоденкова Карина Сергеевна — к.м.н., доцент кафедры поликлинической терапии Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8/2; ORCID iD 0000-0003-3131-5737.
Осадчук Михаил Алексеевич — д.м.н., профессор, заведующий кафедрой поликлинической терапии Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8/2; ORCID iD 0000-0003-0485-6802.
Контактная информация: Бабаева Аида Руфатовна, e-mail: arbabaeva@list.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 10.02.2024.
Поступила после рецензирования 06.03.2024.
Принята в печать 29.03.2024.
ABOUT THE AUTHORS:
Aida R. Babaeva — Dr. Sc. (Med.), Professor, Head of the Department of Faculty Therapy, Volgograd State Medical University; 1, Pavshikh Bortsov sq., Volgograd, 400131, Russian Federation; ORCID iD 0000-0002-7588-8089.
Elena V. Kalinina — C. Sc. (Med.), Associate Professor, associate professor of the Department of Faculty Therapy, Volgograd State Medical University; 1, Pavshikh Bortsov sq., Volgograd, 400131, Russian Federation; ORCID iD 0000-0002-1762-6056.
Maksim S. Zvonorenko — assistant of the Department of Faculty Therapy, Volgograd State Medical University; 1, Pavshikh Bortsov sq., Volgograd, 400131, Russian Federation; ORCID iD 0000-0002-5335-9151.
Karina S. Solodenkova — C. Sc. (Med.), associate professor of the Department of Polyclinics Therapy, N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-3131-5737.
Mikhail A. Osadchuk — Dr. Sc. (Med.), Professor, of the Department of Polyclinics Therapy, N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-0485-6802.
Contact information: Aida R. Babaeva, e-mail: arbabaeva@list.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 10.02.2024.
Revised 06.03.2024.
Accepted 29.03.2024.
Информация с rmj.ru






