В статье представлены результаты исследования, посвященного оценке системного воспалительного статуса при ВИЧ-инфекции на фоне антиретровирусной терапии и возможности его коррекции с помощью иммунокорригирующих препаратов
Содержание статьи
Введение
В последние годы достигнут прогресс в изучении патогенетических механизмов ВИЧ-инфекции. Появляется все больше доказательств того, что системная иммунная активация играет значительную роль в патогенезе заболевания [1].
Высокие уровни системной иммунной активации и воспаления не только способствуют репликации вируса и апоптозу CD4+ Т-клеток, но также могут привести к более быстрому прогрессированию иммунодефицита [2, 3]. Антиретровирусная терапия (АРВТ) ВИЧ-инфекции за счет подавления вирусной репликации восстанавливает функцию иммунной системы, снижает риск развития оппортунистических заболеваний, но не восстанавливает здоровье и не всегда приводит к купированию клинических проявлений заболевания [4]. Даже на фоне эффективной АРВТ маркеры системной иммунной активации остаются повышенными [5].
В отсутствие доступных методов лечения, которые могли бы полностью вылечить больных ВИЧ-инфекцией, в настоящее время изучаются новые методы лечения, направленные на уменьшение системного воспаления, связанного с ВИЧ, а также на снижение риска развития сопутствующих заболеваний. При ВИЧ-инфекции, помимо повреждения Т-клеточного звена иммунитета и поликлональной активации его гуморального звена, наблюдаются нарушения нормального баланса цитокинов и функционирования цитокиновой сети [6]. Цитокины играют жизненно важную роль в координации воспалительного ответа, являются маркерами воспаления и системной иммунной активации. Чрезмерное продуцирование провоспалительных, например ИЛ1β, ИЛ2, ИЛ6, ИЛ8 и ФНО-α, или противовоспалительных цитокинов, например ИЛ4 и ИЛ10, приводит к дисбалансу иммунных реакций [7].
Патологические изменения в кишечнике при ВИЧ-инфекции являются пусковым механизмом для начала иммунной активации с последующим прогрессированием заболевания [9]. Истощение CD4+Т-лимфоцитов в кишечнике и нарушение их функции приводят к повышению проницаемости кишечника для микробных продуктов. Эндотоксинемия обусловлена микробной транслокацией и сопровождается развитием системного воспалительного ответа [20]. Липополисахарид (LPS), компонент грамотрицательных бактериальных клеточных стенок и известный агонист Toll-подобного рецептора 4 (TLR-4), считается основным маркером микробной транслокации. В дополнение к локальной защите от эндотоксинемии на уровне слизистой оболочки желудочно-кишечного тракта и в печени, в системном кровообращении также активируются защитные факторы: IgM, IgG и IgA, специфичные для основного антигена LPS и основных антител эндотоксина (EndoCAb). Важно, что LPS индуцирует несколько реакций во врожденной иммунной системе при взаимодействии LPS с LPS-связывающим белком (LBP), который каталитически переносит LPS на мембрану или растворимый CD14 (sCD14), что приводит к активации NF-κB и продукции цитокинов. Таким образом, у подавляющего большинства больных ВИЧ-инфекцией отмечается активация системы антиэндотоксиновой защиты и повышение провоспалительных цитокинов [8].
Степень микробной транслокации может быть оценена либо непосредственно путем измерения побочных продуктов бактерий в плазме, таких как LPS и фрагменты бактериальной ДНК или РНК, либо косвенно, например, с помощью антител sCD14, LBP и EndoCAb. Человеческий LPS-связывающий белок (LBP) играет центральную роль в ответе на эндотоксинемию. Содержание LBP в сыворотке значительно возрастает при травмах, системном воспалительном синдроме, сепсисе, инфекционных заболеваниях. Современные литературные данные свидетельствуют о возможности использования определения концентрации LBP в качестве диагностического биомаркера эндотоксинемии и индикатора системного ответа на LPS при различных инфекционных процессах.
Полученные доказательства повышенного риска прогрессирования ВИЧ-инфекции при выраженной активации иммунной системы диктуют необходимость поиска новых терапевтических подходов в дополнение к АРВТ. Принимая во внимание противовоспалительный эффект иммуномодулятора аминодигидрофталазиндиона натрия (АДФNa) [10, 11], представляется перспективным изучить возможность его применения у больных ВИЧ-инфекцией в дополнение к АРВТ с целью коррекции системного воспалительного ответа. Основные фармакологические эффекты АДФNa обусловлены его избирательным (в зависимости от исходной активности клеток иммунной системы) влиянием на функционально-метаболическую активность макрофагов, избыточный синтез активных форм кислорода и провоспалительных цитокинов, пролиферативную функцию Т-лимфоцитов и естественных киллерных клеток, синтез антител, интерферона, репаративные процессы в тканях, а также снижение образования фиброзной ткани при заживлении, повышение неспецифической резистентности организма к инфекционным заболеваниям [12–15]. Ранее в клинических исследованиях было показано положительное влияние АДФNа на нормализацию показателей иммунного статуса и цитокинового профиля при целом ряде неинфекционных и инфекционных заболеваний различной, в т. ч. и вирусной, этиологии [5, 16–19].
С учетом вышеизложенного целью настоящей работы явились оценка состояния системного воспалительного ответа при ВИЧ-инфекции на фоне АРВТ и изучение возможности его коррекции.
Материал и методы
В исследование включено 100 больных ВИЧ-инфекцией в возрасте 39,4±2,2 года. Клинический протокол исследования одобрен ученым советом ФБУН Ростовский НИИ микробиологии и паразитологии Роспотребнадзора. Все пациенты были информированы о целях и задачах работы, получено их согласие на участие в исследовании. Согласно Хельсинкской декларации Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki — Еthical Principles for Medical Research Involving Human Subjects, 1964, 2013 ред.) при работе с пациентами соблюдались этические принципы. Распределение пациентов по стадиям заболевания: субклиническая стадия — 30,2%, стадия вторичных заболеваний 4А — 49,4%, стадия 4Б — 17,9%, стадия 4В — 2,5%. Все пациенты получали АРВТ в соответствии с современными нормативными документами, действующими на момент проведения исследования. Методом случайной выборки пациенты были рандомизированы в 2 равные группы по 50 человек в каждой. Рандомизацию осуществляли с помощью таблицы случайных чисел, сгенерированной в программе SРSS. По возрасту, полу и основным клиническим параметрам группы оказались сопоставимы, что позволило провести в дальнейшем их сравнение (табл. 1).
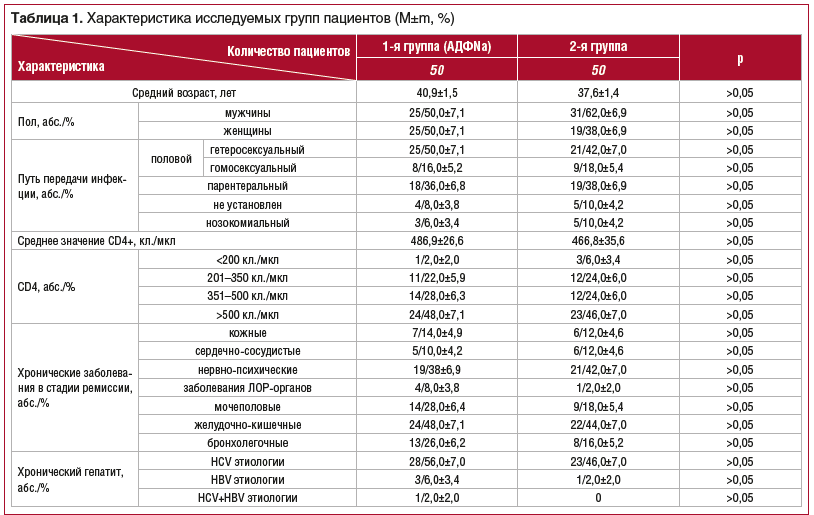
У большинства пациентов обеих групп имелись сопутствующие заболевания желудочно-кишечного тракта в стадии ремиссии, что соответствовало критериям включения/исключения.
Среди таких заболеваний лидировали хронический холецистит (в 1-й группе — 41,7±10,1% больных, во 2-й — 40,9±10,5%) и хронический панкреатит (20,8±8,3% и 18,2±8,2% соответственно). Сопоставимость больных обеих групп на момент включения в исследование по клиническим и лабораторным параметрам позволила провести дальнейший сравнительный анализ. В соответствии с клиническим протоколом исследования клинико-лабораторное обследование пациентов проводилось исходно (визит 1) и через 4 нед. (2-й визит) при плановом диспансерном наблюдении. Пациентам 1-й группы при 1-м визите, помимо планового наблюдения и лечения, дополнительно к стандартной АРВТ назначали сублингвальные таблетки АДФNа (Галавит): по 2 таблетки 2 р./день в течение 10 дней, затем по 2 таблетки 2 р./день через день в течение 10 дней. Эффективность терапии оценивали по динамике концентрации липополисахарид-связывающего белка (LBP), ФНО-α, ИЛ1β, IL6, IL8, IL10, ИНФ-γ, ИНФ-α, определенных методом ИФА. Фенотипирование лимфоцитов выполняли методом проточной цитометрии. Все пациенты получали АРВТ, продолжительность которой в среднем составляла 6,3±0,5 года.
Исследование концентрации LBP проводили методом ИФА с использованием тест-системы Hbt Human LBP ELISA Kit, Product Number: HK315, производства Hycult biotechnology (Голландия).
Для иммуноферментного определения концентрации ФНО-α, ИЛ1β, ИЛ6, ИЛ8, ИЛ10, ИНФ-γ, ИНФ-α использовали наборы «Альфа-ФНО-ИФА-БЕСТ», «Интерлейкин-1бета-ИФА-БЕСТ», «Интерлейкин-6-ИФА-БЕСТ», «Интерлейкин-8-ИФА-БЕСТ», «Интерлейкин-10-ИФА-БЕСТ», «Гамма-Интерферон-ИФА-БЕСТ», «Альфа-Интерферон-ИФА-БЕСТ» (ЗАО «Вектор-Бест», Новосибирск) согласно инструкциям производителя.
Исследование Т-лимфоцитов проводили с помощью шестицветного иммунофенотипирования на цитометре FacsCanto II (Becton Dickinson, США) с использованием меченых моноклональных антител в соответствии с инструкциями производителя.
Группа сравнения была сформирована из 30 практически здоровых лиц сопоставимого возрастного и полового состава.
Для статистической обработки использовали программу SPSS Statistics Base 22.0.
Результаты и обсуждение
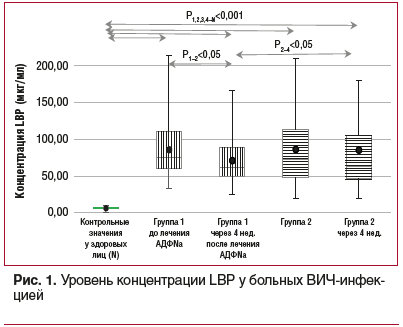
В ходе исследования было выявлено, что в 1-й и 2-й группах больных ВИЧ-инфекцией концентрация LBP была на достоверно более высоком уровне, чем у здоровых людей — 85,9±3,8 и 86,3±4,8 мкг/мл при референсных значениях у здоровых лиц (6,2±1,53 мкг/л) (рис. 1). При исследовании через 4 нед. в 1-й группе отмечалось достоверное снижение LBP до 70,9±4,6 мкг/мл (р<0,05). Во 2-й группе в динамике заболевания достоверных изменений концентрации LBP не выявлено.
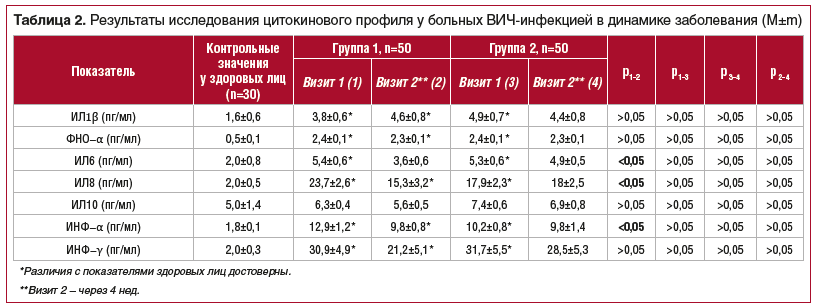
Результаты определения концентрации цитокинов в исследуемых группах представлены в таблице 2. У пациентов обеих групп наблюдался сдвиг цитокинового профиля в провоспалительную сторону с достоверным превышением средних значений концентрации ИЛ1β, ФНО-α, ИЛ6, ИЛ8, ИНФ-α и ИНФ-γ по сравнению с референсными значениями у здоровых лиц, что отражает системный воспалительный ответ. При сравнении средних значений уровня противовоспалительного цитокина ИЛ10 в обеих группах с аналогичными показателями у здоровых лиц достоверных отличий не выявлено.
При повторном обследовании пациентов через 4 нед. в 1-й группе было выявлено снижение ИЛ6 с 5,4±0,6 пг/мл до 3,6,±0,6 пг/мл, ИЛ 8 — с 23,7±2,6 пг/мл до 15,3±3,2 пг/мл,
ИНФ-α — с 12,9±1,2 пг/мл до 9,8±0,8 пг/мл (р<0,05). Во 2-й группе в динамике заболевания достоверных изменений концентрации исследуемых цитокинов не обнаружено.
При определении поверхностных иммунологических маркеров у больных ВИЧ-инфекцией были выявлены значительные изменения фенотипа CD4+ и CD8+ Т-лимфоцитов по сравнению со здоровыми лицами. Эти изменения характеризовались снижением относительного количества СD4+ Т-лимфоцитов наивных (CD4+ RA+) и достоверным повышением активированных CD4+ Т-лимфоцитов памяти (CD4+ R0+) (р<0,05) (см. табл. 2).
Маркер поздней активации иммунитета — относительное количество клеток CD3+HLA-DR+ — в обеих группах был на достоверно более высоком уровне по сравнению с аналогичным показателем у здоровых лиц (в 1-й группе — 55,2±2,5%, во 2-й группе — 49,9±2,8 против референсного значения у здоровых лие — 4,0±1,0 (p<0,001)). При исследовании этого показателя в группах в динамике заболевания достоверных отличий не выявлено.
У больных ВИЧ-инфекцией 1-й и 2-й групп также имели место изменения фенотипа CD8+ Т-лимфоцитов с достоверным превышением относительного количества клеток с маркерами CD38+ или HLA-DR+, а также с одновременной экспрессией CD38+ и HLA-DR+ по сравнению со здоровыми лицами (р<0,05).
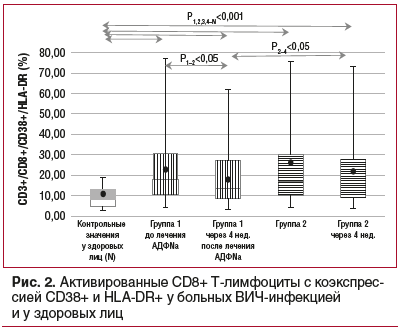
Известно, что количество активированных Т-клеток с экспрессией маркеров активации клеток CD38 и HLA-DR на CD8+T-лимфоцитах коррелирует со скоростью прогрессирования ВИЧ-инфекции. В 1-й группе через 4 нед. отмечено снижение CD3+/CD8+/CD38+/HLA-DR с 23,0±2,2% до 18,0±1,8% (р<0,05). Во 2-й группе по анализируемому показателю в динамике заболевания достоверных изменений не выявлено (рис. 2).
В последние годы выявлению маркеров микробной транслокации и антиэндотоксиновой защиты организма при ВИЧ-инфекции уделяется определенное внимание. В исследовании группы российских ученых было подтверждено, что эндотоксинемия обусловлена микробной транслокацией и сопровождается развитием системного воспалительного ответа [20]. Современные литературные данные свидетельствуют о возможности использования концентрации LBP в качестве диагностического биомаркера эндотоксинемии и индикатора системного ответа на LPS при различных инфекционных процессах [21–23]. Также для углубленной оценки степени тяжести и прогноза течения ВИЧ-инфекции целесообразно проводить исследование цитокинового профиля. При этом ряд авторов считают, что выраженность иммунной активации является лучшим прогностическим маркером прогрессирования заболевания независимо от показателей репликации ВИЧ [24–26].
На основании результатов, полученных нами при изучении маркеров системного воспаления и иммунной активации, можно прийти к заключению, что уровень LPS-связывающего белка (LBP), играющий центральную роль в ответе на эндотоксинемию, достаточно информативно отражает активность инфекционного процесса при ВИЧ-инфекции. Кроме того, выявлено существенное изменение цитокинового профиля в провоспалительную сторону с достоверным превышением средних значений концентрации ИЛ1β, ФНО-α, ИЛ6, ИЛ8, ИНФ-α и ИНФ-γ. При оценке выраженности иммунной активации наиболее значимым оказалось определение процентного содержания CD8+ Т-клеток с коэкспрессией CD38+ и HLA-DR.
Проведенное исследование продемонстрировало положительное влияние АДФNa на течение ВИЧ-инфекции при добавлении его к стандартной схеме АРВТ. Это выразилось в более быстрой динамике снижения маркера антиэндотоксиновой защиты LBP, провоспалительных цитокинов ИЛ6, ИЛ8 и ИНФ-α, а также процентного содержания CD8+ Т-клеток с коэкспрессией CD38+ и HLA-DR. Вероятно, способность этого препарата оказывать непосредственное или опосредованное влияние на системный воспалительный ответ при ВИЧ-инфекции в условиях подавления репликации ВИЧ с помощью АРВТ обусловила позитивное влияние препарата на течение ВИЧ-инфекции. Для определения продолжительности выявленных эффектов, целесообразности и кратности повторных курсов лечения иммуномодулирующими препаратами требуются дальнейшие исследования.
Заключение
ВИЧ-инфекция вызывает выраженную активацию как врожденного, так и адаптивного иммунитета, индуцирует и поддерживает в организме системное воспаление. У подавляющего большинства больных ВИЧ-инфекцией отмечается активация системы антиэндотоксиновой защиты. На фоне ВИЧ-инфекции цитокиновый профиль характеризуется более выраженной провоспалительной направленностью.
У ВИЧ-инфицированных пациентов отмечается снижение доли наивных CD4+ Т-клеток и увеличение уровня CD4+ Т-клеток памяти. АРВТ снижает активацию T-клеток, но не нормализует ее.
Снижение активности системного воспаления при ВИЧ-инфекции наблюдается при дополнении стандартной АРВТ препаратом АДФNa. Патогенетическим обоснованием применения АДФNa является его противовоспалительная и иммуномодулирующая активность, связанная с его корригирующим влиянием на цитокиновый профиль в условиях подавления репликации ВИЧ при АРВТ. Эффект АДФNa заключается в более быстром снижении концентрации в крови LBP, ИЛ6, ИЛ8, ИНФ-α и относительного количества активированных цитотоксических Т-лимфоцитов с коэкспрессией CD38+ и HLA-DR. Курсовой прием препарата АДФNa будет способствовать повышению эффективности и переносимости АРВТ.
Информация с rmj.ru