Введение
Ежегодно в мире регистрируют более полумиллиона новых больных раком шейки матки (РШМ), и более половины заболевших умирают в течение года. В 2018 г. в России было зарегистрировано 17 505 новых случаев заболевания РШМ, что составило около 0,04% от всего женского населения РФ в возрасте от 14 лет и старше. Средний возраст заболевших РШМ в России — 52,2 года. Среднегодовой темп прироста заболеваемости на 100 тыс. женского населения за последние 20 лет составил 24,9%.
Основной прирост заболеваемости (около 72%) пришелся на возрастную категорию 14–49 лет — 8516 человек в 2018 г., что на 71% больше, чем в 2008 г. (4959 человек) [1]. В возрастной группе 25–29 лет прирост заболеваемости РШМ составил 78,8%, в группе от 30 до 34 лет — 149% (максимальный прирост по сравнению с другими возрастными группами). В 2018 г. у 65,6% заболевших РШМ выявлен на ранних (I–II) стадиях, у 22,8% — на III и у 9,8% — на IV стадии [1].
В структуре смертности от онкологических заболеваний в России в 2018 г. РШМ составил 4,7%, среднегодовой темп прироста смертности на 100 тыс. женского населения — 2,8%. Летальность от РШМ на первом году с момента установления диагноза составила 14,6%. Средний возраст умерших от РШМ в 2018 г. — 57,8 года. Смертность от РШМ в возрастной группе от 30 до 34 лет была максимальной (23,6%) по сравнению с другими возрастными группами, а 7,1% умерших пришлись на возрастную группу до 29 лет [1].
Растет и заболеваемость внутриэпителиальным поражением плоского эпителия тяжелой степени (high-grade squamous intraepithelial lesion, HSIL), число таких больных в 2008 г. (без учета больных РШМ) составило 2593 человека, в 2018 г. — 4490 (19,4% и 25,6% от числа заболевших РШМ соответственно). Вероятно, истинная распространенность HSIL намного больше, так как в статистических отчетах в РФ регистрируется только CIS, которая в основном диа-гностируется как находка в препаратах конизации, проведенной по поводу CIN II–III [2].
При РШМ стадия устанавливается до начала лечения и не изменяется после начала специальной терапии. К сожалению, несмотря на использование многочисленных методов лабораторного и инструментального обследования, точность диагностики РШМ с метастазами в регионарные лимфатические узлы (метастатический РШМ) на догоспитальном этапе далека от идеальной.
В одном ретроспективном исследовании, включающем 309 больных РШМ со стадией T1a1 с инвазией лимфоваскулярного пространства, T1a2, T1b, T2a и T2b с начальным параметральным распространением без признаков увеличения лимфатических узлов или отдаленных метастазов при дооперационной визуализации, метастатическое поражение лимфатических узлов во время операции было обнаружено у 18 (6%) больных. Еще у 20 больных были обнаружены макрометастазы (8) и микрометастазы (12) по результатам послеоперационного стадирования. Таким образом, у 12% больных РШМ на догоспитальном этапе не была установлена точная стадия заболевания [3].
В другом исследовании 234 больных местнораспространенным РШМ были рандомизированы в две группы: группу A (n=120), в которой пациентки получали на первом этапе хирургическое лечение (на догоспитальном этапе метастазов в лимфатические узлы не выявлено), и группу B (n=114), в которой проводилось первичное химиолучевое лечение. В группе B была проведена КТ-биопсия подозрительных парааортальных лимфатических узлов. Метастазы в тазовые и парааортальные лимфатические узлы были выявлены после хирургического вмешательства у 51 (24%) пациентки группы А (р<0,001). Всего повышение стадии РШМ за счет выявленного метастатического поражения лимфатических узлов (до III–IV стадии) констатировано у 39 (33%) пациенток из 120 в группе A и у 9 (8%) из 114 в группе B (p<0,001) [4].
Таким образом, несмотря на проведение полного клинического обследования больных РШМ, частота ошибок в выявлении метастатического поражения регионарных лимфатических узлов на догоспитальном этапе, по данным разных авторов, колеблется от 9% до 33% [2–4].
Прогностическими факторами выживаемости больных РШМ являются гистологический подтип, диаметр опухоли и состояние лимфатических узлов [5–7]. Все эти факторы проверяются, но не всегда способствуют точному определению стадии РШМ.
Выбор метода лечения определяется распространенностью опухолевого процесса, соматическим статусом пациента и наличием лечебных ресурсов. И хирургия, и лучевая терапия применяются при лечении ранней стадии заболевания [7]. Однако при метастазах удаление первичной опухоли оказывает минимальный эффект на общее течение болезни и даже может отрицательно сказаться на росте отдаленных метастазов, поскольку при удалении первичного опухолевого очага снимается эффект подавления и торможения роста метастатических очагов [8].
В 2018 г. изменилась система стадирования РШМ по FIGO (International Federation of Gynecology and Obstetrics — Международная федерация акушерства и гинекологии), которая стала включать обязательную оценку состояния тазовых и парааортальных лимфатических узлов с отражением их статуса как IIIC1 (метастазы в тазовых лимфатических узлах (ранее IIIb)) и IIIC2 (метастазы в парааортальных лимфатических узлах (ранее IV)), поскольку наличие регионарных и отдаленных метастазов влечет за собой изменение лечебной тактики [7]. Пересмотренная система стадирования не требует обязательного использования определенной техники визуализации, биопсии лимфатического узла или хирургической оценки степени распространенности опухолевого процесса. В условиях ограниченных ресурсов врачи могут продолжать клиническую оценку стадии, как и раньше.
Для определения стадии РШМ возможно использовать любые методы визуализации и/или результаты патоморфологического исследования. Оценивать забрюшинные лимфатические узлы рекомендовано с помощью визуальных методов исследования и/или патологических результатов, и, если установлены метастазы в лимфатические узлы, случай обозначается как стадия IIIC (с обозначением метода, использованного для выделения стадии: r (инструментальные методы диагностики) и p (патоморфологическое исследование)).
Для рутинных исследований, которые должны быть использованы на основании клинических данных и как стандарт медицинской помощи, отдельных рекомендаций нет [7].
Клинические рекомендации Минздрава России по РШМ (2020 г.) [9] основаны на пересмотренной классификации FIGO (2019 г.) [7] и TNM (2016 г.) [10]. Определено, что стадия РШМ устанавливается до начала специальной терапии, поскольку это необходимо для выбора метода и составления плана лечения. Стадия РШМ не изменяется после начала специального лечения. В случаях, когда есть затруднения в точном определении стадии, следует устанавливать более раннюю. Морфологические находки у пациенток, подвергнутых хирургическому лечению, должны быть отмечены отдельно, но не изменяют установленную стадию [9].
Таким образом, принимая во внимание вышесказанное, получается, что количество первично выявленных больных РШМ I–II стадии после проведения хирургического стадирования на порядок ниже за счет повышения количества больных метастатическим РШМ (III–IV стадии), установленным после хирургического лечения.
Проведение хирургического лечения на первом этапе показано больным с РШМ стадии не более IIA1. При планировании лечения больных IB1–IIА1 стадий РШМ следует избегать комбинации хирургического лечения и лучевой терапии, поскольку применение комбинации этих методов достоверно увеличивает частоту осложнений. К тому же значительно повышается стоимость самого лечения [7, 9].
В последние годы пересмотрен стандарт хирургического лечения больных РШМ с нереализованным репродуктивным потенциалом, которым возможно проведение органосохраняющего лечения — радикальной трахелэктомии с радикальной лимфодиссекцией, а также активно обсуждается вопрос о замене лимфодиссекции биопсией сторожевого лимфатического узла. У этих больных чрезмерная радикальность лечения может привести к таким нежелательным осложнениям, как увеличение длительности операции, интраоперационное кровотечение, выраженный болевой синдром в послеоперационном периоде, лимфоцеле (20%), лимфедема (10–15%) и, реже, повреждение нервов или сосудов, без прямой выгоды для безрецидивной и общей выживаемости [4, 11–13]. Следовательно, при отборе пациенток на органосохраняющее лечение выявление метастатического поражения лимфоузлов таза на догоспитальном этапе является одним из основных критериев исключения.
Всем пациенткам с РШМ в целях оценки их общего состояния, определения тактики и алгоритма лечения, оценки прогноза заболевания рекомендуется выполнять: клинический анализ крови, биохимический анализ крови с показателями функции печени, исследование свертывающей системы крови (уровень убедительности рекомендаций С, уровень достоверности доказательств 5). При этом такие обязательные методы исследования, как аспирационная биопсия эндометрия, биопсия шейки матки, цервикогистероскопия, раздельное диагностическое выскабливание стенок полости матки и цервикального канала, кольпоскопия, УЗИ малого таза, также относятся к уровню убедительности рекомендаций С (уровень достоверности доказательств 5).
Такие методы обследования, как МРТ/КТ малого таза, сочетанная позитронно-эмиссионная и компьютерная томография (ПЭТ КТ) отнесены к уровню убедительности рекомендаций В (уровень достоверности доказательств 1).
К уровню убедительности рекомендаций В (уровень достоверности доказательств 3) относится гистологическое исследование биопсийного материала. Гистологическое исследование хирургически удаленного опухолевого препарата имеет уровень убедительности рекомендаций С (уровень достоверности доказательств 5) [7].
К сожалению, даже у онкологов, работающих с больными на одинаковых этапах оказания онкологической помощи, имеются различные диагностические возможности, что в конечном итоге может определять дальнейшую судьбу пациента.
Связь между опухолью и организмом осуществляется через циркуляцию крови и лимфы. Кровь определенным образом реагирует на появление и развитие злокачественной опухоли, а изменения ее показателей должны помочь клиницистам заподозрить наличие злокачественного процесса и его распространенность, как помогает оценить состояние организма при иных заболеваниях.
К лабораторным критериям прогрессии опухоли, по данным многих исследований, относятся анемия, повышение скорости оседания эритроцитов (СОЭ), гиперкоагуляция, воспаление и их маркеры.
Анемия — наиболее частая гематологическая аномалия у онкологических больных, которую, к сожалению, во многих случаях не распознают и не лечат. Хотя анемия может проявляться в широком спектре симптомов, затрагивающих почти все органы, считается, что она в значительной степени способствует развитию усталости — одного из наиболее распространенных симптомов у онкологических больных. Кроме того, появляется все больше свидетельств того, что анемия является независимым фактором, отрицательно влияющим на реакцию опухоли на лечение и выживаемость пациенток [14].
У больных РШМ анемия встречается часто, а ее происхождение имеет сложный генез, часто сочетается с крово-течением, недостатком железа, воспалительными реакциями и инфекцией. Частота первичной анемии (уровень гемоглобина <120 г/л) коррелирует с клинической стадией и варьирует от публикации к публикации, составляя от 25% для I стадии до 33% для II стадии, и может приближаться к 40% при III стадии. Анемия коррелирует с выживаемостью больных РШМ и, по-видимому, является одним из самых сильных прогностических факторов выживаемости после клинической стадии и размера опухоли [15].
Ускорение СОЭ — фактор, связанный с увеличением степени распространенности опухолевого процесса и доказанно ухудшающий прогноз заболевания [16].
В исследованиях ряда авторов доказано, что у онкологических больных обычно наблюдаются аномалии в лабораторных тестах коагуляции, указывающие на длительно существующее субклиническое состояние гиперкоагуляции. Результаты лабораторных исследований демонстрируют, что процесс образования и разрушения фибрина параллелен развитию злокачественного новообразования, поскольку фибрин и другие продукты свертывания крови важны как для тромбообразования, так и для прогрессии опухоли [17].
Укорочение активированного частичного тромбопластинового времени (АЧТВ) и увеличение концентрации фибриногена, усиление функциональной активности тромбоцитов в виде повышения степени агрегации, увеличение маркеров внутрисосудистого свертывания крови растворимых фибрин-мономерных комплексов (РФМК), повышение концентрации D-димера — характерные и регулярно встречающиеся аномалии гемостаза у больных злокачественными заболеваниями [18, 19].
Кроме того, опухолевые клетки продуцируют и выделяют прокоагулянтные и фибринолитические белки, а также воспалительные цитокины. Большинство из этих механизмов, помимо активации ими системы гемостаза, также способствуют росту опухоли [17].
Учитывая вышесказанное и принимая во внимание разную стоимость методов обследования с одинаковым уровнем убедительности рекомендаций и достоверности доказательств, считаем правильным проанализировать возможности рутинных методов лабораторной диагностики, доступных всем без исключения врачам первичного звена, занимающимся обследованием больных РШМ на догоспитальном этапе, для оценки степени распространенности опухолевого процесса и определения правильной тактики дальнейшего лечения.
Цель исследования: поиск и оценка новых возможностей рутинных методов лабораторной диагностики (общий анализ крови, исследование крови на гемостаз, определение уровня D-димера, биохимических маркеров обмена железа и воспаления) для повышения точности дооперационного стадирования (степени распространенности) у больных с HSIL и РШМ.
Материал и методы
Проведено ретроспективное одноцентровое сравнительное исследование, в которое вошло 410 пациенток в возрасте от 18 до 82 лет (медиана 42 [34; 51] года) с верифицированным диагнозом HSIL и РШМ, обратившихся для лечения в поликлинику МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России. Пациенток подбирали по архивным записям и при очном обследовании прослеживали результаты диагностики с момента установки клинического диагноза и после получения результатов хирургического стадирования.
У пациенток, которым не проводилось хирургическое стадирование, учитывали результаты гистологического заключения и стадию заболевания, установленную после проведения протокольного обследования с использованием методов инструментальной и лабораторной диагностики.
Пациентки были поделены на группы в зависимости от стадии заболевания и метода лечения. До начала лечения объем обследования всех пациенток включал: клинический анализ крови (гемоглобин (Hb), эритроциты (RBC), средний объем эритроцита (MCV) и среднее содержание гемоглобина в эритроците, СОЭ и количество тромбоцитов), коагулограмму (фибриноген, АЧТВ, тромбиновое время (ТВ), протромбиновое время (ПТВ), агрегация тромбоцитов с аденозиндифосфатом (АДФ), активность антитромбина III, плазминоген, РФМК, D-димер), определение биохимических маркеров обмена железа (сывороточное железо (СЖ), ферритин, трансферрин) и воспаления (С-реактивный белок (СРБ), лактатдегидрогеназа (ЛДГ)).
Минимальное обязательное инструментальное обследование при HSIL включало УЗИ органов малого таза и регионарных лимфатических узлов. При РШМ I–IV стадии обязательным было проведение УЗИ малого таза и брюшной полости, МРТ малого таза и КТ брюшной полости с контрастированием, ряду больных проведена ПЭТ КТ.
Статистический анализ результатов проводили средствами языка Питон (Python 3.8). Для расчетов были использованы встроенные функции из модулей Statsmodels и Scipy. Количественные показатели оценивали на предмет соответствия нормальному распределению, для этого использовали критерий Шапиро — Уилка. Проверка на нормальность распределения показала, что данные в исследовании не имеют нормального распределения, поэтому в дальнейшем расчеты проводили методами непараметрической статистики. В качестве меры центральной тенденции выборки использовали медиану, первый и третий квартили (Me [Q1; Q3]). При сравнении нескольких выборок количественных данных использовали критерий Краскела — Уоллиса. В случае обнаружения статистически значимых различий между группами дополнительно проводили парное сравнение совокупностей при помощи критерия Манна — Уитни. С целью изучения взаимосвязи между явлениями, представленными количественными данными, рассчитывали коэффициент корреляции Спирмена (Rs). На заключительном этапе была проведена множественная линейная регрессия для получения модели предсказания стадии РШМ. Различия в исследовании считались статистически значимыми при р<0,05.
Минимальный объем выборки при уровне значимости 5% для сохранения статистической мощности 80% составляет 385 участников. Выборка в 410 пациенток является достаточной для того, чтобы выявить статистически значимые различия в оценке отдельных показателей крови на разных стадиях РШМ [20].
Результаты и обсуждение
В таблице 1 представлены основные показатели клинического анализа крови у больных HSIL и РШМ.
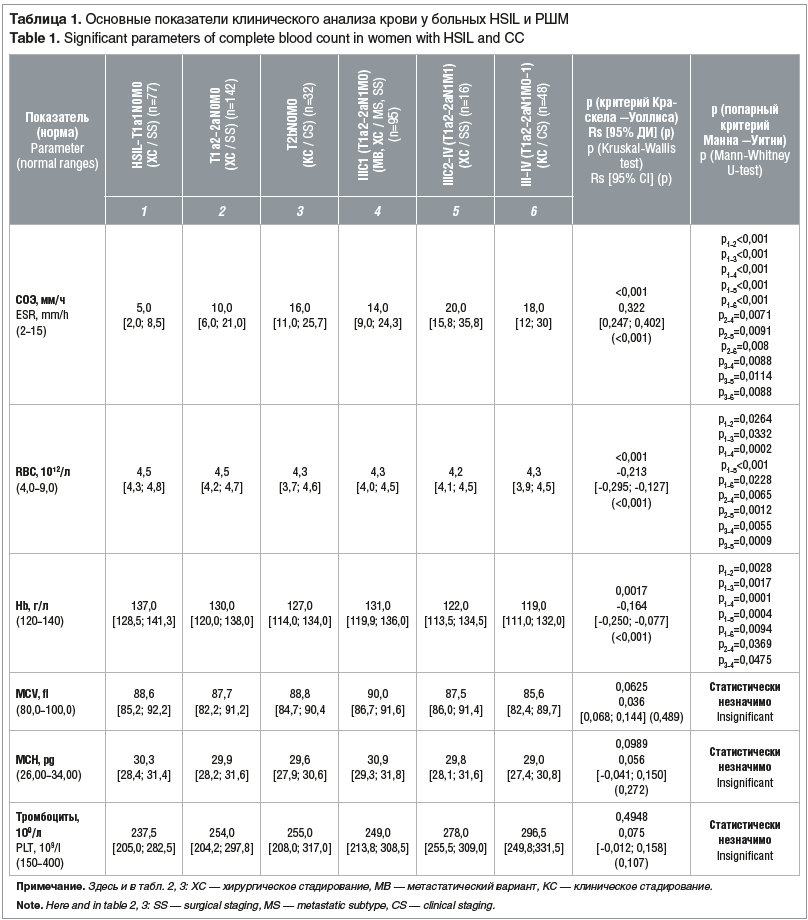
Как видно из представленных в таблице 1 данных, СОЭ статистически значимо повышается с увеличением местного распространения РШМ (Rs=0,322, p<0,001). Особенно следует обратить внимание на повышение СОЭ у больных РШМ с клинической стадией IIB (T2bN0M0), IIIC1 (T1а2-2aN1M0), IIIC2–IV (TIа2-2aN1M1) и III–IV (T1а2-2a-bN1M0-1).
Уровень Hb также характеризуется статистически значимой (Rs=-0,164, р<0,001) отрицательной линейной зависимостью от стадии заболевания: по мере снижения содержания Hb происходит увеличение местного распространения РШМ и появляются отдаленные метастазы, но нет зависимости от наличия метастазов в регионарных лимфатических узлах.
Медианы уровня Hb оставались в пределах референсных значений при всех стадиях РШМ. Однако количество больных РШМ с анемией и тяжесть анемии увеличивались пропорционально степени распространения опухолевого процесса и наличию метастазов в регионарных лимфатических узлах. Так, из 77 обследованных с HSIL–T1а1N0M0 анемия 1-й степени тяжести (Hb 109–119 г/л) выявлена у 11 (14,2%) пациенток. У 46 (26,4%) из 174 пациенток с местнораспространенным РШМ (стадии IA2–IIB) имела место анемия 1–2-й степени тяжести (Hb 85–119 г/л). Из 159 больных метастатическим РШМ (IIIC1–IV) анемия 1–3-й степени тяжести (Hb 60–119 г/л) наблюдалась у 57 (35,8%) больных (р<0,001).
Показатель RBC находился в пределах референсных значений у больных РШМ всех стадий. При этом отмечена статистически значимая обратная связь между стадией РШМ и RBC (Rs=-0,213, р<0,001), что говорит о снижении показателя RBC при повышении стадии РШМ.
Анализ значений биохимических маркеров обмена железа и воспаления у больных HSIL и РШМ (табл. 2) показал, что в целом биохимические маркеры обмена железа и воспаления оказались неинформативными для оценки степени распространенности опухолевого процесса (критерий Краскела — Уоллиса показал отсутствие статистической значимости (р>0,05) при анализе всех биохимических маркеров).
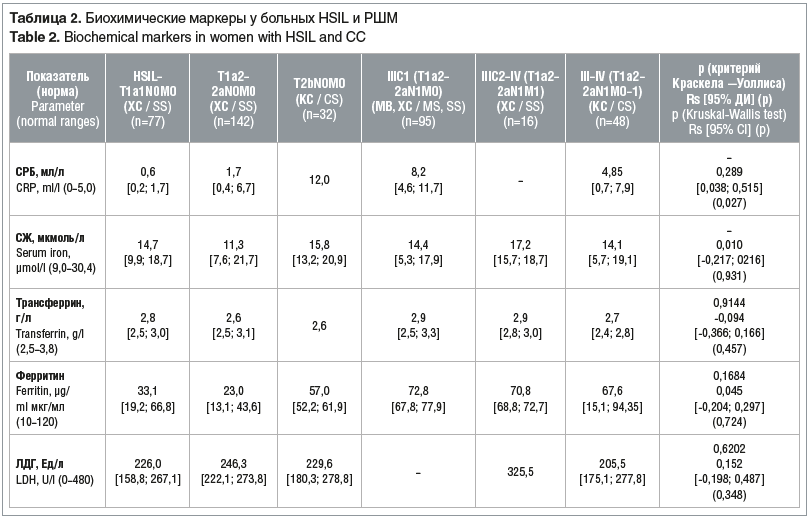
Средние показатели уровня СЖ у больных HSIL и РШМ стадии A1 (T1а1N0M0) статистически значимо не различались при местнораспространенном и метастатическом вариантах РШМ. Несмотря на то, что медиана СЖ оставалась в пределах референсных значений во всех группах, у 17 (22,1%) больных HSIL и РШМ стадии IA1 (T1а1N0M0), 58 (33,3%) — стадии IA2–IIB (T1а2-T2bN0M0), 29 (27,6%) — стадии IIIC1 (T1а2-T2aN1M0) и 24 (50,0%) — стадии IIIC2–IV (T1а2-Т2a-bN1M1) отмечено снижение уровня СЖ ниже референсных значений, что говорит о влиянии опухолевого процесса на обмен железа.
При исследовании уровня СРБ не удалось выявить статистическую значимость различий показателя между стадиями на основе критерия Краскела — Уоллиса из-за малого количества данных по обследованным в некоторых группах больных. Однако коэффициент корреляции Спирмена показал слабую положительную связь между повышением уровня СРБ и степенью распространения РШМ (0,289, p=0,027). Полученные данные говорят о том, что выход опухолевого процесса в параметрий и наличие метастазов в лимфатических узлах таза сопровождаются выраженным воспалением, что и подтверждается значимым увеличением СРБ у пациенток со стадиями IIB (T2bN0M0) и IIIС1 (T1а2-2aN1M0).
В таблице 3 приведены медианы значений основных показателей гемостаза, которые могут быть использованы для диагностики метастазов в регионарные лимфатические узла таза у больных HSIL и РШМ.
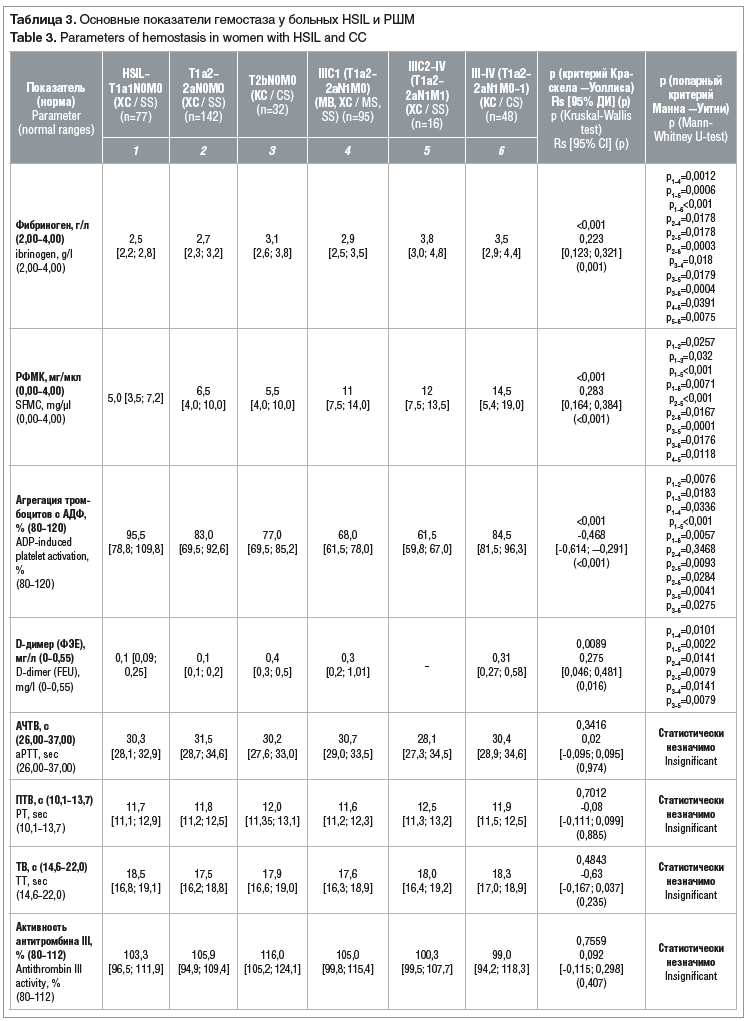
Установлено, что у больных метастатическим РШМ статистически значимо (Rs=0,223, р<0,001) повышается уровень фибриногена (медиана 2,9 при IIIC1 и медиана 3,8 при IIIC2–IV стадиях РШМ) по сравнению с показателями больных с начальными (до IIА) стадиями, где медианы равны 2,5 и 2,7 (HSIL–IA1 и IA2–IIA соответственно). При этом следует учитывать, что значения фибриногена остаются в рамках референсных. Таким образом, уровень фибриногена следует рассматривать скорее в комплексе с другими показателями крови, чем отдельно.
Также была получена прямая положительная статистически значимая зависимость (Rs=0,283, р<0,001) между повышением уровня РФМК и степенью распространенности РШМ: с увеличением стадии РШМ растет уровень РФМК от 5,0–6,5 при начальных стадиях до 14,5 при III–IV стадии (см. табл. 3).
Статистически значимой (р<0,001) оказалась обратная умеренная связь (Rs=-0,468) между снижением агрегации тромбоцитов с АДФ и повышением стадии РШМ, особенно при имеющихся регионарных метастазах: 95% при HSIL–IA1 (T1a1N0M0), 83% при IA2–IIa (T1а2-T2aN0M0), 68% при IIIС1 (T1а2-T2aN1M0), 61,5% при IIIC2–IV (T1а2-T2a-bN1M1). Особенно следует обратить внимание на снижение агрегации тромбоцитов с АДФ ниже референсных значений, выявленное при стадиях T2bN0M0, IIIC1 (T1а2-2aN1M0), IIIC1–IV (TIа2-2a-bN1M1).
Уровень D-димера также можно считать маркером метастатического процесса. Так, в ходе исследования была обнаружена прямая (Rs=0,275) статистически значимая (p=0,016) зависимость между его уровнем и стадиями HSIL–IA (T2aN0M0), при которых медиана уровня D-димера составляет 0,1 (интервал 0,1–0,2). Максимальные значения уровня D-димера (1,01) также выявлены при IIIC1 (T1а2–T2aN1M0) стадии РШМ (интервал 0,2–1,01) и при стадии III–IV (T1а2-2aN1M0-1) при клиническом стадировании у пациенток, не получивших хирургического лечения, — медиана составила 0,31 (интервал 0,27–0,58). При местнораспространенном РШМ (стадия IIB (T2bN0M0)) медиана уровня D-димера составила 0,4 (интервал 0,3–0,5). При этом следует учитывать, что значения D-димера остаются в рамках референсных. Таким образом, уровень D-димера так же, как и уровень фибриногена, следует рассматривать в комплексе с другими показателями крови.
Такие показатели гемостаза, как АЧТВ, ТВ, и ПТВ, активность антитромбина III и плазминоген, не показали статистически значимых различий при разных стадиях РШМ, а значит, их нельзя использовать для повышения точности диагностики.
На заключительном этапе была проведена множественная линейная регрессия (МЛР), по результатам которой получена формула для расчета точности предсказания стадии РШМ:
Стадия РШМ (округлить до целого) = (4,003 + 2,301 × × (D-димер) + 0,327 × (фибриноген) + 0,047 × (РФМК) — — 0,041 × (агрегация тромбоцитов с АДФ)).
По результатам расчета по формуле будут получены значения от 1 до 6. Эти значения соответствуют следующим клиническим стадиям заболевания: 1 — HSIL-T1а1N0M0, 2 — T1а2-2aN0M0, 3 — T2bN0M0, 4 — IIIC1 (T1а2-2aN1M0), 5 — IIIC1–IV (TIа2-2aN1M1), 6 — III–IV (T1а2-2aN1M0-1).
Из формулы следует, что максимальное влияние на предсказание стадии оказывает значение уровня D-димера (β=2,301, р<0,001). Далее следуют уровень фибриногена (β=0,327, р<0,001), РФМК (β=0,047, р<0,001) и агрегация тромбоцитов с АДФ (β=-0,041, р<0,001).
Выделенные в ходе проведения МЛР-анализа предикторы (D-димер, фибриноген, РФМК и агрегация тромбоцитов с АДФ) объясняют лишь 70,2% изменчивости переменной «cтадия РШМ». Общая точность предсказания построенной модели составляет 74,3%. Наиболее точно полученная модель предсказывает стадии IA2–IIA (T1а2-2aN0M0) (84%), стадию IIB (T2bN0M0) (78%) и стадию IIIС1 (T1а2-2aN1M0) (76%).
Уровень показателей возможности построенной модели можно объяснить недостаточным объемом данных. В дальнейшем, при получении большего объема данных, возможна корректировка полученной модели точности предсказания стадии РШМ.
Ограничения настоящего исследования связаны с неполнотой имеющейся базы данных по анализам крови у пациенток.
Заключение
Таким образом, определено несколько рутинных показателей периферической крови (Hb, RBC, СOЭ, фибриноген, РФМК, D-димер, агрегация тромбоцитов с АДФ), изменение уровня которых в пределах или выше/ниже референсных значений отражает системное влияние злокачественной опухоли на организм и которые являются значимыми маркерами наличия метастазов в регионарные лимфатические узлы, не диагностированных при клиническом обследовании больных РШМ.
Исследование этих показателей возможно в любой лаборатории России, экономически оправдано и входит в стандартные протоколы обследования больных РШМ. Комплексная оценка этих показателей у первичных больных позволит заподозрить наличие метастатического процесса, потребовать более тщательного и обоснованного обследования в целях повышения точности догоспитальной диагностики и выбора правильной тактики лечения. Указанные показатели периферической крови целесообразно учитывать при постановке окончательного диагноза, так как они доказали свою статистическую значимость как критерии степени распространенности РШМ.
Сведения об авторах:
Стуклов Николай Игоревич — д.м.н., профессор кафедры госпитальной терапии с курсами эндокринологии, гематологии и клинической лабораторной диагностики Медицинского института РУДН; 117198, г. Москва, ул. Миклухо-Маклая, д. 8; руководитель курса гематологии; главный научный сотрудник отделения высокодозной химиотерапии с блоком трансплантации костного мозга МНИОИ им. П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России; 125284, Россия, г. Москва, 2-й Боткинский проезд, д. 3; ORCID iD 0000-0002-4546-1578.
Сушинская Татьяна Валентиновна — к.м.н., старший научный сотрудник отдела опухолей репродуктивных и мочевыводящих органов МНИОИ им. П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России; 125284, Россия, г. Москва, 2-й Боткинский проезд, д. 3; ORCID iD 0000-0001-8812-9105.
Епифанова Светлана Викторовна — к.м.н., врач-рентгенолог отделения рентгеновской диагностики и томографии ФГБУ «ЦКБ с поликлиникой УДП РФ»; 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 15; ORCID iD 0000-0002-7591-5120.
Щепкина Елена Викторовна — к.соц.н., директор по статистике, ООО «Техдепартамент»; 141407, Россия, г. Химки, ул. Германа Титова, д. 2; ORCID iD 0000-0002-2079-1482.
Кузнецов Антон Игоревич — студент факультета «Системы управления, информатика и электроэнергетика» МАИ; 125993, Россия, г. Москва, Волоколамское шоссе, д. 4; ORCID iD 0000-0003-2182-5792.
Контактная информация: Сушинская Татьяна Валентиновна, e-mail: talgi65@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.07.2021.
Поступила после рецензирования 30.07.2021.
Принята в печать 24.08.2021.
About the authors:
Nikolay I. Stuklov — Dr. Sc. (Med.), professor of the Department of Hospital Therapy with the Courses of Endocrinology, Hematology, & Clinical Laboratory Diagnostics, Medical Institute of the Russian University of Peoples’ Friendship; 8, Miklukho-Maklaya str., Moscow, 117198, Russian Federation; Head of the Course of Hematology; principal researcher, P. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre; 3, 2nd Botkinskiy pass., Moscow, 125284, Russian Federation; ORCID iD 0000-0002-4546-1578.
Tatyana V. Sushinskaya — C. Sc. (Med.), senior researcher, P. Hertsen Moscow Oncology Research Institute — Branch of the National Medical Research Radiological Centre; 3, 2nd Botkinskiy lane, Moscow, 125284, Russian Federation; ORCID iD 0000-0001-8812-9105.
Svetlana V. Epifanova — C. Sc. (Med.), radiologist of the Department of X-ray Diagnostics & Tomography, Central Clinical Hospital and Polyclinic of the Department for Presidential Affairs; 15, Marshal Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0002-7591-5120.
Elena V. Shchepkina — C. Sc. (Soc.), Director for Statistics, LLC «Techdepartament»; 2, German Titov str., Khimki, 141407, Russian Federation; ORCID iD 0000-0002-2079-1482.
Anton I. Kuznetsov — student of the Faculty «Control Systems, Informatics, & Electricity», Moscow Aviation Institute (National Research University); 4, Volokolamskoe road, Moscow, 125993, Russian Federation; ORCID iD 0000-0003-2182-5792.
Contact information: Tatyana V. Sushinskaya, e-mail: talgi65@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 09.07.2021.
Revised 30.07.2021.
Accepted 24.08.2021.
.
Информация с rmj.ru





