Введение
Значительное место в структуре хронической патологии ЛОР-органов занимают воспалительные заболевания полости носа и околоносовых пазух (ОНП) [1]. Наиболее распространенным хроническим заболеванием в оториноларингологии, учитывая статистические показатели, является полипозный риносинусит (ПРС). В России около 1 млн 500 тыс. человек больных ПРС, в то время как в США этот показатель составляет 30–35 млн человек. [2]. По данным Европейского соглашения по полипозному риносинуситу (The European Position Paper on Rhinosinusitis and Nasal Polyps 2020, EPOS 2020), полипозом носа и ОНП страдают 2–4% населения Европы. С каждым годом отмечается тенденция к увеличению роста заболеваемости ПРС, что, вероятно, связано, с влиянием неблагоприятных факторов внешней среды. Для ПРС характерно длительное рецидивирующее течение, он играет активную роль в формировании многочисленных осложнений, что отрицательно влияет на качество жизни пациентов [3].
Несмотря на многочисленные исследования, до сих пор нет единой теории патогенеза данного процесса. Предполагается, что ПРС является гетерогенным, многофакторным воспалительно-гиперпластическим заболеванием слизистой оболочки полости носа и ОНП [1, 4–5]. Основными причинами перехода воспалительного процесса в хроническую форму служат постоянное воздействие на слизистую оболочку полости носа и ОНП триггерных патогенов, таких как вирусы, грибы, бактериальные клетки, а также происходящие изменения барьерной функции слизистой оболочки носа и ОНП (цилиарная дискинезия, муковисцидоз, атопия, нарушение метаболизма арахидоновой кислоты и т. д.). Все перечисленные факторы способствуют образованию и росту полипов [4].
По морфологической характеристике полипы представляют собой бледно-серые выпячивания видоизмененной слизистой оболочки, отечные, волокнистые, со слабовыраженным сосудистым рисунком, плотноэластической консистенции, не кровоточащие при дотрагивании, исходящие, как правило, из средних или верхних носовых ходов [6]. Известно, что на тяжесть течения заболевания влияет наличие сопутствующих заболеваний. Доказано, что организм пациентов с непереносимостью нестероидных противовоспалительных препаратов (НПВП), бронхиальной астмой, атопией находится в состоянии хронического системного воспаления и ПРС у них имеют более агрессивное течение [7]. Также на течение воспалительного процесса и его поддержание влияют функциональные нарушения различных типов клеток, таких как макрофаги, дендритные и стволовые клетки [8], а по другим данным, воспалительная среда влияет на клеточную активность и дифференцировку [9].
Цель исследования: изучение морфологических особенностей полипозной ткани по данным цитологического и гистологического исследования.
Материал и методы
Исследование проводилось на базе ЛОР-клиники ГБУЗ МО МОНИКИ им. М.Ф. Владимирского в 2017–2018 гг. Под наблюдением находились 78 пациентов с диагнозом ПРС, из них 50 мужчин и 28 женщин в возрасте от 25 до 74 лет. Длительность заболевания варьировала в пределах от 1 года до 25 лет.
На момент исследования все больные имели развернутую клиническую картину ПРС, отвечающую следующим критериям:
наличие в полости носа полипозной ткани, обтурирующей общий носовой ход полностью или не менее чем на 50%;
жалобы на длительное затруднение носового дыхания, образование обильного количества слизи в полости носа, ее стекание по задней стенке глотки.
Критериями включения в исследование были: двусторонний ПРС, возраст от 25 до 75 лет, добровольное согласие на участие в исследовании.
Критерии исключения: возраст старше 75 лет, наличие острой воспалительной патологии, тяжелых хронических заболеваний, в том числе в стадии обострения, заболеваний, которые могли повлиять на результат исследования, односторонний полипозный процесс, онкологические
заболевания, заболевания крови, туберкулез, ВИЧ-инфекция и другие иммунодефицитные состояния, беременность и лактация у женщин. Проводились консультации терапевта, эндокринолога, невролога для исключения тяжелой сопутствующей соматической патологии (гипертоническая болезнь, изменение функции щитовидной железы, сахарный диабет и т. д.).
Материалом для цитологического исследования служили соскобы с поверхности полипов полости носа и ОНП, а также мазки-отпечатки с поверхности среза удаленных полипов, материалом для гистологического исследования — кусочки удаленной полипозной ткани. Полученный эксфолиативный материал наносили на сухие обезжиренные предметные стекла, высушивали на воздухе, окрашивали азур-эозиновой смесью по Паппенгейму и исследовали при световой микроскопии. В работе использовали микроскоп фирмы KarlZeiss с выводом изображения на экран монитора. Для гистологического исследования биоптаты фиксировали в 10% растворе нейтрального формалина в течение 22 ч, обезвоживали в этаноле возрастающей концентрации в течение 27 ч, затем помещали в ксилол на 3 ч. Далее кусочки исследуемых тканей пропитывали парафином в течение 3–5 ч при постоянной температуре +60 °C. Срезы толщиной 5–6 мкм окрашивали гематоксилином и эозином по Гроту, заключали в бальзам и покрывали покровным стеклом. С целью формализации описания объектов исследования была проведена группировка цитоморфологических признаков, характеризующих респираторный эпителий полости носа и ОНП при ПРС. Определены следующие цитологические показатели: реснитчатые клетки, бокаловидные клетки, клетки базального слоя респираторного эпителия, выраженность межклеточных контактов, наличие ядрышек в ядрах эпителиоцитов, многоядерные клетки, признаки гиперсекреции эпителиоцитов, наличие элементов плоскоклеточной метаплазии и парагиперкератоза, дистрофические изменения в эпителиальных клетках, наличие фибробластов, количество лейкоцитов в поле зрения, число нейтрофилов, гистиоцитов, лимфоцитов и эозинофилов, а также наличие бактериальной микробиоты.
Поскольку полученные данные носят бинарный характер (признак либо выявлен, либо нет) и относятся к связанным выборкам, анализ проводился с использованием точного критерия Мак-Немара.
Результаты и обсуждение
Как известно, элементы слизистой оболочки полости носа и ОНП цитоморфологически можно разделить на две группы: эпителиальные клетки и элементы стромы [10]. Основными компонентами цитограмм материала, полученного со слизистой оболочки полости носа и ОНП больных с ПРС, были группы и скопления клеток респираторного эпителия. Среди них встречались как незрелые элементы, так и функционально активные клетки с признаками дифференцировки. К незрелым клеткам относили клетки округлой или полигональной формы, имеющие небольшие размеры (до 10 мкм), гиперхромные ядра и узкий ободок цитоплазмы [10]. К функционально активным (дифференцированным) респираторным эпителиоцитам относили клетки с ресничками и бокаловидные клетки. В качестве примера на рисунках 1 и 2 представлены фрагменты цитограмм со слизистой оболочки полости носа пациентов с ПРС.
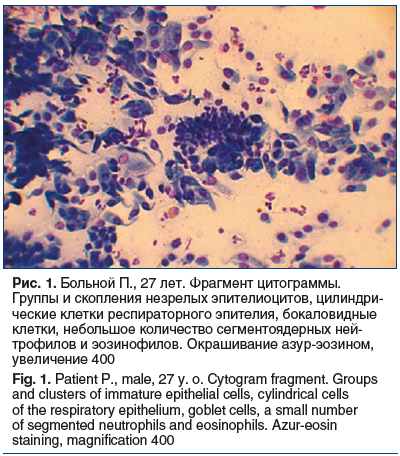
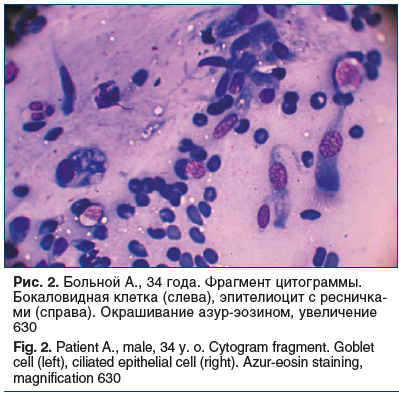
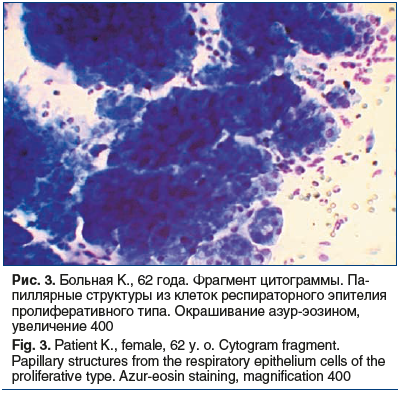
Характерной особенностью цитологической картины при ПРС является формирование клетками респираторного эпителия сосочкоподобных (папиллярных) структур (рис. 3).
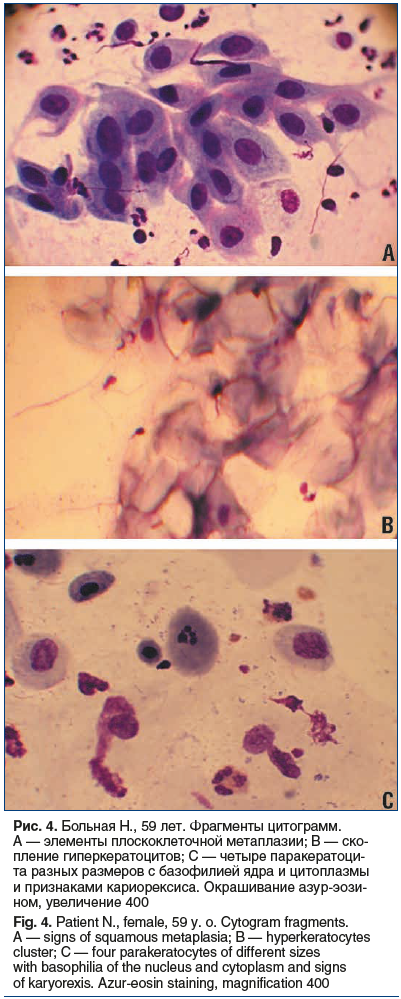
В цитограммах слизистой оболочки полости носа и ОНП обследованных больных ПРС помимо функционально активных эпителиоцитов встречались незрелые эпителиальные клетки, элементы парагиперкератоза, а также элементы плоскоклеточной метаплазии (рис. 4).
Среди элементов стромы в цитограммах слизистой оболочки полости носа и ОНП больных ПРС встречались нейтрофилы, эозинофилы, лимфоциты, плазматические клетки, фибробласты и гистиоциты в различном количестве и соотношении. На рисунке 5 представлен фрагмент цитограммы слизистой оболочки полости носа больного ПРС.

Исследования показали, что клеточный состав материала, полученного при соскобе с поверхности полипа до начала лечения, отличается от цитограмм мазков-отпечатков с поверхности среза удаленного полипа. Сравнительные результаты представлены в таблице 1.
В мазках-отпечатках с поверхности среза удаленного полипа отмечали значительно больше эпителиальных клеток, формирующих папиллярные структуры, чаще обнаруживали плотные группы и скопления незрелых клеток базального слоя респираторного эпителия, а также фибробластов.
При сравнении двух вариантов цитограмм (соскоб с поверхности полипа и мазок-отпечаток с поверхности среза удаленного полипа) одного и того же больного ПРС установлено, что в операционном материале содержится больше эозинофилов. Примечательно и то, что в препаратах с удаленных полипов эозинофилы располагаются в эпителиальных структурах или в непосредственной близости с ними, что свидетельствует об инфильтрации слизистой оболочки этими клетками и подтверждает их активное участие в патогенезе заболевания. Представленные цитологические характеристики полипозной ткани подтверждаются ранее опубликованными данными ряда авторов [11–13].
Учитывая полученные в ходе исследования данные (см. табл. 1), можно утверждать, что мазки-отпечатки выявляют больше характерных признаков ПРС, чем соскобы.
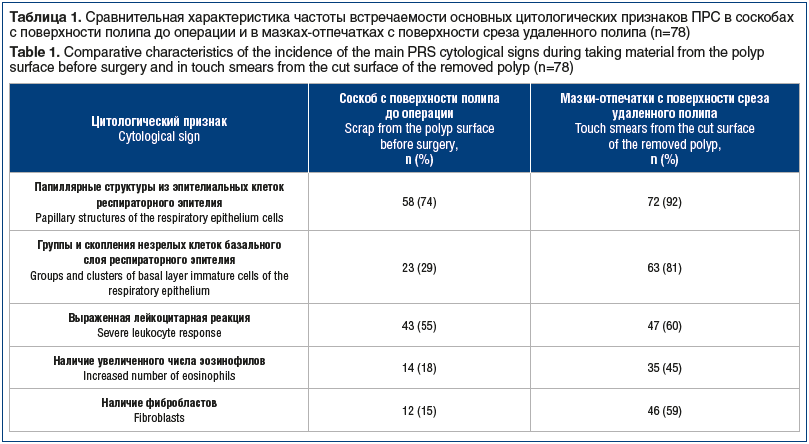
По признаку наличия папиллярных структур эпителиальных клеток респираторного эпителия выявлено, что у большинства пациентов (n=50) они присутствуют при каждом из видов исследования, однако мазки-отпечатки дополнительно выявляют 22 случая наличия подобных структур. У 4 пациентов наличия папиллярных структур не выявлено, а у 2 пациентов они выявлены только методом соскоба, но не мазков-отпечатков. Выявленные различия статистически значимы, p=0,001. По признаку наличия групп и скоплений незрелых клеток базального слоя респираторного эпителия выявлено, что у небольшого числа пациентов (n=16) они присутствуют при каждом из видов исследования. Мазки-отпечатки дополнительно выявили 47 случаев наличия групп и скоплений этих клеток. У 8 пациентов наличия незрелых клеток не выявлено вовсе, а у 7 пациентов они выявлены только методом соскоба, но не мазков-отпечатков. Выявленные различия статистически значимы, p=0,001. По признаку наличия лейкоцитарной реакции выявлено, что не определяется статистически значимого различия между выявлением этого паттерна в мазках-отпечатках и соскобах (p=0,388). У половины пациентов (n=39) лейкоцитарная реакция выявляется как соскобами, так и мазками-отпечатками, еще у 27 пациентов она не была выявлена в принципе. Мазки-отпечатки дополнительно выявляют 8 случаев описываемой реакции, а у 4 пациентов она выявлена только методом соскоба, но не мазков-отпечатков.
По признаку увеличения числа эозинофилов выявлено, что у большинства пациентов (n=40) они не определяются никаким из исследуемых методов получения цитологического материала. Мазки-отпечатки выявили 24 случая увеличенного числа эозинофилов, а у 3 пациентов оно выявлялось только методом соскоба, но не мазков-отпечатков. Выявленные различия статистически значимы, p=0,001.
По признаку наличия фибробластов было обнаружено, что у большинства пациентов (n=46) они были выявлены методом мазков-отпечатков, и только в 11 случаях — методом соскоба. У 30 пациентов фибробласты не были выявлены ни одним из методов, а в оставшихся 2 случаях подтверждались только методом соскоба, но не мазков-отпечатков. Выявленные различия статистически значимы, p=0,001.
В ходе исследования нами был проведен сравнительный анализ данных цитологического и гистологического исследования. Гистологические виды полипозной ткани обследованных пациентов представлены в таблице 2.
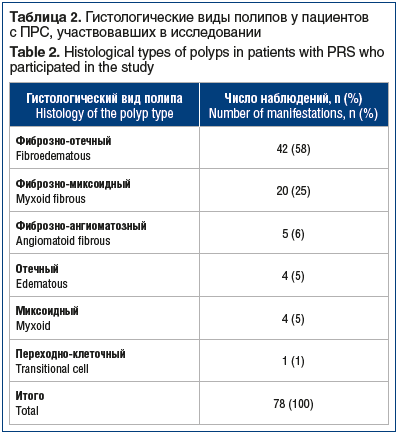
Дифференцировать гистологические виды полипов по клеточному составу мазков со слизистой оболочки полости носа и ОНП не представлялось возможным. Однако при сопоставлении данных гистологического и цитологического исследований материала больных ПРС установлено: а) при полипах с фиброзным компонентом в мазках-отпечатках со слизистой оболочки полости носа и ОНП, наряду с признаками пролиферации клеток респираторного эпителия, выражены признаки сопутствующего хронического воспаления; б) отечные и миксоидные полипы чаще сочетаются с аллергическим состоянием (мазки-отпечатки этих вариантов удаленных полипов содержали большее количество эозинофилов и лимфоцитов по сравнению с другими видами полипов).
Выводы
По методу забора материала для цитологического исследования наиболее информативными являются мазки-отпечатки с поверхности среза удаленного полипа, которые помогают выявлять больше морфологических характеристик полипозной ткани.
Анализ цитоморфологических признаков респираторного эпителия полости носа и ОНП при ПРС свидетельствует о структурной перестройке (ремоделировании) слизистой оболочки при этом заболевании. Пролиферация эпителиальных клеток сопряжена с активизацией компонентов стромы — фибробластов и лейкоцитов. На светооптическом уровне выявлены черты компенсаторно-приспособительных изменений, способствующих сохранению морфофункционального единства всех клеток слизистой оболочки, противодействующих патологическому процессу.
Полученные результаты помогают понять механизмы структурно-функциональной перестройки в слизистой оболочке полости носа и ОНП при ПРС, что является вкладом в развитие современной концепции клеточных механизмов пролиферации, а также имеет практическое значение.
Сведения об авторах:
Захарова Наталья Михайловна — к.м.н., заведующая клинико-диагностической лабораторией ГБУЗ МО «СГБ имени Семашко Н.А.»; 142200, Россия, г. Серпухов,
ул. 2-я Московская, д. 8/19; ORCID iD 0000-0002-1277-4439.
Шабалова Ирина Петровна — д.м.н., профессор кафедры клинической лабораторной диагностики ФГБОУ ДПО РМАНПО; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-7838-6279.
Егоров Виктор Иванович — д.м.н., главный научный сотрудник, заведующий отделом головы и шеи, заведующий кафедрой оториноларингологии, заслуженный врач РФ, член правления Российской ассоциации оториноларингологов, член профильной комиссии по оториноларингологии Минздрава России; ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-8825-5096.
Шачнев Константин Николаевич — сотрудник клинико-диагностического центра; ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, 61/2; ORCID iD 0000-0002-4703-7463.
Савушкина Елизавета Юрьевна — аспирант кафедры факультета усовершенствования врачей ГБУЗ МО
МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-9681-1304.
Ветчинникова Ольга Николаевна — д.м.н., профессор кафедры трансплантологии, нефрологии и искусственных органов ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID
iD 0000-0002-1888-8090.
Кондаков Антон Кириллович — врач-радиолог/рентгенолог ЦКБ РАН; 117593, Россия, г. Москва, Литовский бульвар, д. 1А; ORCID iD 0000-0002-9300-8655.
Контактная информация: Савушкина Елизавета Юрьевна, e-mail: lizasavushkina@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.07.2021.
Поступила после рецензирования 28.07.2021.
Принята в печать 20.08.2021.
About the authors:
Natalia M. Zakharova — C. Sc. (Med.), Head of the Clinical and Diagnostic Laboratory, Serpukhov City Hospital named after N.A. Semashko; 8/19, 2-nd Moskovskaya str., Serpukhov, 142200, Russian Federation; ORCID iD 0000-0002-1277-4439.
Irina P. Shabalova — Dr. Sc. (Med.), Professor of the Department of Clinical Laboratory Diagnostics, Russian Medical Academy of Continuous Professional Education; 2/1, bld. 1, Barricadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-7838-6279.
Viktor I. Egorov — Dr. Sc. (Med.), Chief Researcher, Head of the Department of Head and Neck, Head of the Department of Otorhinolaryngology, Honored Doctor of the Russian Federation, member of the Board of the Russian Society of Otorhinolaryngologists, member of the Commission specialized on Otorhinolaryngology of the Ministry of Health of the Russian Federation; M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkina str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-8825-5096.
Konstantin N. Shachnev — an officer of the Clinical and Diagnostic Center; M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkina str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-4703-7463.
Elizaveta Yu. Savushkina — postgraduate student of the Department of the Faculty of Advanced Training for Doctors, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkina str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-9681-1304.
Olga N. Vetchinnikova — Dr. Sc. (Med.), Professor of the Department of Transplantology, Nephrology and Artificial Organs, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkina str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-1888-8090.
Anton K. Kondakov — radiologist, Central Clinical Hospital of the Russian Academy of Sciences; 1A, Litovsky Boulevard, Moscow, 117593, Russian Federation; ORCID iD 0000-0002-9300-8655.
Contact information: Elizaveta Yu. Savushkina, e-mail: lizasavushkina@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 05.07.2021.
Revised 28.07.2021.
Accepted 20.08.2021.
.
Информация с rmj.ru





