Введение
Несмотря на значительные достижения медицины, сердечно-сосудистые заболевания (ССЗ) продолжают оставаться основной причиной смертности во всем мире [1, 2]. Актуальной задачей является поиск и изучение новых сердечно-сосудистых биологических маркеров, способных помогать ранней диагностике заболеваний сердца, служить инструментом оценки эффективности лечения, выступать в роли прогностического маркера и критерия стратификации риска [3–6].
В настоящее время интерес ученых сосредоточен на изучении секретонеурина (secretoneurin, SN) в качестве кардиоваскулярного биологического маркера [7–9]. SN показал потенциал в прогнозировании неблагоприятных аритмических событий и прогрессирования сердечной недостаточности (СН) [7, 8]. Основные эффекты SN опосредованы кальций/кальмодулин-зависимой протеинкиназой II (CaMKII) [7, 8]. CaMKII регулирует обработку кальция внутри клетки [7, 8]. Как известно, кальций играет центральную роль в процессах возбуждения/сокращения и внутриклеточной сигнализации [10]. В связи с этим изучение данного маркера может предоставить многообещающие результаты у больных ССЗ.
Цель данного обзора литературы: анализ исследований, посвященных изучению SN в роли нового диагностического и прогностического маркера при сердечно-сосудистой патологии.
Методология поиска источников
В статье представлен обзор актуальных публикаций. Мы провели анализ литературных источников, включавший все релевантные публикации до 27.07.2023, в базах данных PubMed/MEDLINE, РИНЦ, Google Scholar, Science Direct. При поиске статей использовали следующие ключевые слова: биологические маркеры, сердечно-сосудистые заболевания, cекретонеурин, biological markers, cardiovascular diseases, secretoneurin. В обзор включены 35 источников: актуальные экспериментальные, лабораторные, клинические исследования и обзоры.
Строение и функции SN
Секретонеурин представляет собой пептид из 33 аминокислот, содержащийся в нейроэндокринной ткани и миокарде [8, 9, 11]. SN содержит последовательность YTPQ-X-LA-X(5)-EL, которая составляет его центральное ядро [8, 11]. Паралоги SNa и SNb были идентифицированы в телеостах, N-конец и середина SNa идентичны последовательности млекопитающих [10]. Данная идентичность для SNb не характерна [9]. SN относится к семейству секретогранин/хромограниновых пептидов [9]. SN продуцируется протеолитическим расщеплением белка-предшественника, секретогранина II (SgII, хромогранин C, 617 аминокислот) [8, 12]. Обработка SgII является видо- и тканеспецифичной; таким образом, иногда образуются более крупные иммунореактивные фрагменты SN в дополнение к свободным SN [8, 12]. Пропротеин конвертаза субтилизин кексин, вероятно, играет центральную роль в генерации SN из SgII [8]. Гранин необходим для сортировки белка и упаковки гормонов в регулируемом секреторном пути [8]. В кислой среде с высоким содержанием кальция SgII может быть обработан ферментами в секреторной везикуле [8]. Секреторные везикулы, которые несут SN, сливаются с клеточной мембраной, а SN высвобождается через кальций-зависимый экзоцитоз [8]. После высвобождения из клетки он связывается с рецептором SN аутокринным, паракринным или нейроэндокринным способами [8].
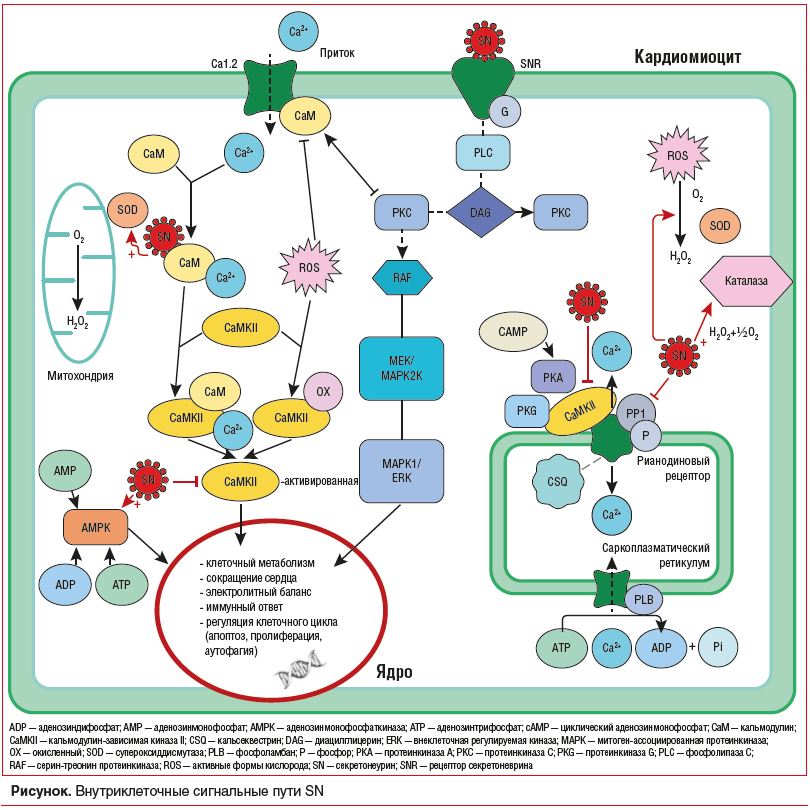
Секретонеурин был обнаружен у человека в сыворотке крови, моче, спинномозговой жидкости, пульпе зуба и афферентных нервных волокнах [8, 13, 14]. Иммунореактивность SN была отмечена в немиелинизированных волокнах, которые передают преимущественно ноцицептивные импульсы [13]. Все биологические эффекты SN до конца не изучены [8]. Имеются данные о том, что SN-рецептор является G-связанным мембранным рецептором [15]. На рисунке представлены сигнальные пути SN.
Показано, что миокардиальная экспрессия предшественника SN была увеличена у мышей с катехоламинергической полиморфной желудочковой тахикардией (КПЖТ), а сверхэкспрессия SN ослабляла аритмическую индукцию во время стресс-тестирования изопротеренолом [16]. Введение SN снижало частоту и размеры искр Ca2+ в кардиомиоцитах во время провокации изопротеренолом, а также снижало частоту волн Ca2+, отсроченную постдеполяризацию и спонтанные потенциалы действия [16]. Кроме того, SN снижал частоту ранней постдеполяризации [16]. Таким образом, продукция SN повышается в условиях нарушения регуляции Са2+ кардиомиоцитами и обеспечивает компенсаторную защиту от аритмий [16].
Секретонеурин индуцирует повышенную экспрессию эндотелиальной синтазы оксида азота (eNOS) и кальмодулина (CaM) [17]. В этом отношении SN может играть защитную роль при ишемической болезни сердца, усиливая эндотелий-зависимую релаксацию [17].
Секретонеурин улучшал неоваскуляризацию у мышей аполипопротеин E (Apo E) (-/-) и индуцировал пролиферацию эндотелиальных клеток; введение SN не влияло на площадь атеросклеротических бляшек [18].
C. Kahler et al. [19] продемонстрировали, что SN запускает селективную миграцию моноцитов и фибробластов человека in vitro, что говорит о его участии в воспалительных реакциях. Также SN стимулирует специфическую миграцию гладкомышечных клеток (ГМК). Кроме того, SN инициирует синтез дезоксирибонуклеиновой кислоты и рост ГМК. Обе функциональные активности SN ингибировались специфическими анти-SN иммуноглобулинами. Таким образом, результаты данного исследования говорят о том, что SN функционирует как регуляторный пептид, модулирующий миграцию и пролиферацию ГМК, что в сочетании с другими факторами может усугублять и ускорять развитие атеросклеротического процесса.
Было обнаружено, что SN уменьшает изопротеренол-индуцированную гипертрофию миокарда путем подавления продукции активных форм кислорода, индуцирования активности супероксиддисмутазы (SOD) и каталазы. Известно, что эти эффекты опосредованы аденозинмонофосфатом и путем киназы, регулируемой внеклеточным сигналом (ERK) / митоген-активируемой протеинкиназы (MAPK) [20]. SN активирует аполипопротеин C3, который может способствовать уменьшению гипертрофии [21]. Генная терапия SN изопротеренол-индуцированной гипертрофии на модели животных привела к значительному снижению уровня натрийуретических пептидов, соотношения массы сердца к массе тела и, что удивительно, интерстициального фиброза [11].
K. Albrecht-Schgoer et al. [22] исследовали влияние генной терапии SN на модели инфаркта миокарда (ИМ) у крыс. SN in vivo улучшал функцию левого желудочка (ЛЖ), уменьшал его ремоделирование и образование рубцов. В пограничной зоне инфаркта SN индуцировал ангиогенез, о чем свидетельствует увеличение плотности капилляров и артерий. In vitro SN стимулировал пролиферацию, ингибировал апоптоз и активировал протеинкиназу B альфа (AKT) в эндотелиальных клетках. Кроме того, SN увеличивал связывание фактора роста эндотелия сосудов (VEGF) с эндотелиальными клетками, которое блокировалось гепариназой. Это указывает на то, что SN стимулирует связывание VEGF с гепарансульфатом протеогликанов. Кроме того, SN увеличивал связывание VEGF с его корецептором нейропилином 1. В эндотелиальных клетках SN также стимулировал рецептор фактора роста фибробластов 3 (FGF3R) и рецептор инсулиноподобного фактора роста 1 (IGF1R), а в ГМК наблюдалась стимуляция IGF1R и FGF3R.
В своей работе J. Lee et al. [23] сравнивали ангиогенную активность нейропептида Y, SN и субстанции P в экспериментах in vitro и in vivo. Оценка регенеративной активности в модели хронической ишемии сердца показала, что все три вещества обеспечивали улучшение функции сердца и усиление его структурной регенерации.
Согласно данным V. Trudeau et al. [11] SN оказывает регулирующее влияние на нейровоспаление, высвобождение нейротрансмиттеров и обладает терапевтическим потенциалом для индукции ангиогенеза. Рецептор SN, вероятнее всего, связан с G-белком, участвует в передаче сигналов эволюционно консервативного внутриклеточного пути Notch и пути гуанилатциклазы.
R. Kirchmair et al. [24] предположили, что SN может действовать как ангиогенный фактор, и проверили эти эффекты in vivo с использованием модели неоваскуляризации роговицы мыши и in vitro путем оценки образования капиллярных трубок. In vivo индуцированная SN новая сосудистая сеть характеризовалась отчетливым рисунком артериальных и венозных сосудов. Была обнаружена эндотелиальная выстилка внутренней поверхности этих сосудов; привлечение актин-позитивных периваскулярных клеток говорит о созревании сосудов. In vitro индуцированное SN образование капилляров было дозозависимым и специфичным, тем самым подтверждая, что эффекты SN проявляются непосредственно на эндотелиальных клетках. SN также стимулировал пролиферацию и оказывал антиапоптотическое действие на эндотелиальные клетки и активировал пути фосфоинозитид-3-киназы (PI3K)/AKT и MAPK, о чем свидетельствует повышенное фосфорилирование киназ, регулируемых внеклеточным сигналом (ERK1/ERK2). Эти данные показывают, что SN можно позиционировать в качестве прямого ангиогенного фактора.
Основываясь на своем ранее проведенном исследовании, которое продемонстрировало, что SN активируется в условиях гипоксии и усиливает ангиогенез, W. Schgoer et al. [25] проанализировали терапевтический потенциал SN при тяжелой ишемии конечностей у мышей c диабетом. In vitro исследователи обнаружили, что SN способен стимулировать пролиферацию, хемотаксис, снижать апоптоз в эндотелиальных клетках пупочной вены человека (HUVEC), культивируемых в условиях гипергликемии. Кроме того, SN активировал ERK, eNOS и особенно AKT, а также рецептор эпидермального фактора роста в HUVEC. Таким образом, SN улучшает неоваскуляризацию при диабете за счет стимуляции ангиогенеза и артериогенеза.
Наночастицы SN восстанавливали кровоток при ишемии задних конечностей у мышей в течение 1 нед., в то время как контрольные частицы не показали данного эффекта. Тестирование in vitro также выявило ангиогенный, антиапоптотический и пролиферативный эффекты наночастиц SN [26].
Секретонеурин усиливает регенерацию костей за счет увеличения образования кровеносных сосудов и костного мозга [27].
Определение SN в крови
В настоящее время наиболее частым методом определения SN в крови является иммуноферментный анализ (ИФА, enzyme-linked immunosorbent assay, ELISA). P.L. Myhre et al. [28] определяли референтные пределы SN у здоровых людей (средний возраст 36 лет). Медиана концентраций SN в плазме крови составила 38 пмоль/л у женщин и 33 пмоль/л у мужчин.
K. Aakre et al. [29] изучали вариации внутри субъекта (CVI), межиндивидуальные вариации (CVG), контрольные значения изменений (RCV) и индекс индивидуальности (II) SN. Средний возраст участников (среди них 53% – женщины) составил 36 лет. Медианные концентрации SN, так же как в исследовании P.L. Myhre et al. [28], составили 38 пмоль/л (женщины) и 33 пмоль/л (мужчины), р<0,001. CVI и CVG составили 9,8% (доверительный интервал (ДИ) от 8,7 до 11,0%) и 20,0 (ДИ от 15,4 до 28,0%) соответственно, RCV 38,7% (ДИ от 35,5 до 42,7%) и -27,9 (ДИ от -29,9 до -26,2), а II 0,60 (ДИ 0,42–0,78). Таким образом, SN имеет довольно низкие CVI, CVG, RCV и II, что указывает на то, что он может быть полезным в качестве диагностического и прогностического лабораторного биологического маркера.
Роль SN при ССЗ
A. Ottesen et al. [16] оценивали уровни циркулирующего SN у пациентов после реанимационных мероприятий при остановке сердца, обусловленной желудочковой тахикардией (n=155). Уровни SN у данной категории пациентов были повышены. В отличие от предшественника мозгового натрийуретического пептида (NT-proBNP) и высокочувствительного тропонина Т (hs-TnT) уровни циркулирующего SN снижались после проведения реанимационных мероприятий.
Согласно данным P.L. Myhre et al. [28] концентрации SN у пациентов с острым коронарным синдромом (ОКС) были статистически значимо выше, чем у пациентов без ОКС. Концентрации SN также статистически значимо были выше у невыживших пациентов. После поправки на возраст, пол, артериальное давление (АД), перенесенный ранее ИМ, фибрилляцию предсердий и СН повышенная концентрация SN показала себя как предиктор летального исхода.
H. Rosjo et al. [30] измеряли концентрации SN в плазме крови у пациентов с хронической СН при рандомизации (n=1224) и спустя 3 мес. (n=1103). Средний возраст составил 67 лет, 80% из них были мужчинами. Медиана (квартиль 1–3) концентрации SN составила 42,6 (35,0–62,8) пмоль/л при рандомизации и 42,0 (34,5–53,1) пмоль/л через 3 мес., что было выше, чем концентрации SN у здоровых добровольцев. Более высокие концентрации SN при рандомизации были связаны с более низким индексом массы тела (ИМТ), более низким систолическим АД, более низкой расчетной скоростью клубочковой фильтрации (рСКФ), более высокими концентрациями BNP и наличием диагноза хронической обструктивной болезни легких. При медиане наблюдения 3,9 года умерло 344 (27,0%) пациента. После поправки на возраст, пол, фракцию выброса левого желудочка, ИМТ, функциональный класс, ишемическую этиологию, частоту сердечных сокращений, АД, рСКФ, билирубин, BNP при рандомизации SN также был связан со смертностью (HR 2,60 (95% ДИ 1,1–6,70), p=0,047).
A. Ottesen et al. [31] изучали уровни циркулирующего SN у 143 пациентов, госпитализированных по поводу острой СН. Уровни SN были сильно связаны с летальностью (медиана наблюдения 776 дней; HR 4,63; 95% ДИ от 1,93 до 11,11; p=0,001).
G. Christensen et al. [32] определяли концентрации SN в крови у 209 пациентов с острой дыхательной недостаточностью (ОДН). Концентрации SN при госпитализации были выше у умерших, чем у выживших больных, как при ОДН, связанной с ССЗ (медиана 148 (квартиль 1–3, 117–203) пмоль/л против 108 (87–143) пмоль/л, p<0,001), так и при ОДН, не связанной с ССЗ (139 (115–184) пмоль/л против 113 (91–139) пмоль/л, p<0,001). У пациентов с ОДН, связанной с ССЗ, концентрации SN при поступлении в отделение реанимации и интенсивной терапии (ОРИТ) были связаны с 90-дневной смертностью (OR 1,97 (95% ДИ 1,04–3,73, p=0,04)) после поправки на установленные критерии риска, включая NT-proBNP. AUC SN для прогнозирования смертности у пациентов с ОДН, связанной с ССЗ, составила 0,72 (95% ДИ 0,65–0,79), а AUC NT-proBNP — 0,64 (0,56–0,73). Напротив, концентрации SN при поступлении в ОРИТ не обладали дополнительной прогностической ценностью для установленных показателей риска у пациентов с ОДН, не связанной с ССЗ (AUC 0,67 (0,60–0,75)).
J. Brynildsen et al. [33] анализировали уровни SN у 619 пациентов, перенесших операцию на сердце (аортокоронарное шунтирование, операции на клапанах, грудном отделе аорты и др.). За 961 день наблюдения умерло 59 больных (9,5%). Уровни SN были выше среди невыживших по сравнению с выжившими как до (168 (квартиль 1–3, 147–206) пмоль/л против 160 (131–193) пмоль/л; p=0,039), так и после кардиохирургического вмешательства (173 (129–217) пмоль/л против 143 (111–173) пмоль/л; p<0,001). Уровни SN снижались у выживших, тогда как исследователи не наблюдали значительного снижения уровней SN у невыживших. Пациенты с самыми высокими послеоперационными уровнями SN имели худший исход по сравнению с пациентами с более низкими уровнями SN (p<0,001).
J. Brynildsen et al. [34] оценивали значения SN у 57 пациентов с умеренным и тяжелым аортальным стенозом (АС) (контрольная группа — 10 здоровых добровольцев того же возраста и пола). Медиана (квартиль 1–3) концентрации SN составила 141 (121–163) пмоль/л у пациентов с АС и 132 (106–148) пмоль/л в контрольной группе (p=0,17). Более низкий предполагаемый клиренс креатинина и использование диуретиков были связаны с повышением концентрации SN. Пятнадцать (26%) пациентов умерли в течение 3,5 года наблюдения. Концентрации SN были выше у невыживших, чем у выживших: 156 (133–209) пмоль/л против 140 (116–155) пмоль/л (p=0,007). AUC SN для прогнозирования смертности составила 0,74 (95% ДИ 0,60–0,88) по сравнению с 0,73 (0,59–0,87) hs-TnT и 0,67 (0,51–0,82) NT-proBNP. Пороговое значение SN>204 пмоль/л у данной категории больных предсказывало летальность.
У критически больных пациентов, поступивших в ОРИТ с сепсисом, уровни SN в плазме крови предсказывали наступление летального исхода в дополнение к классическим факторам риска [35].
Заключение
Исследования, направленные на изучение новых биологических маркеров, должны помочь в ранней диагностике и выборе более эффективной терапии пациентам с кардиологической патологией. Анализ лабораторных биологических маркеров прочно занял свою нишу в онкологии, однако применение их при ССЗ пока находится в стадии становления. В настоящее время имеются доступные современные технологии для верификации новых биомаркеров, вследствие чего целесообразна разработка мультибиомаркерной модели диагностики и прогнозирования течения ССЗ. Проведенные к настоящему времени исследования, посвященные SN, указывают на потенциально значимую диагностическую и прогностическую ценность данного маркера у пациентов с сердечно-сосудистой патологией. Положительное влияние SN на состояние сердца и сосудов позволяет рассматривать данный маркер в качестве терапевтической мишени. Комбинация SN с другими биологическими маркерами, в частности BNP и его предшественником, возможно, повысит его прогностическое значение. Тем не менее вопросы, связанные с серийным тестированием данного маркера, в том числе и в условиях мультимаркерной панели, нуждаются в дальнейшем изучении.
Информация с rmj.ru