Содержание статьи
Ранняя диагностика артериальной гипертензии у лиц молодого
возраста
М. И. Шупина, кандидат медицинских наук
Г. И. Нечаева, доктор медицинских наук, профессор
А. Н. Повстяная, кандидат медицинских наук
А. А. Семенкин, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМА МЗ РФ, Омск
В настоящее время на фоне чрезвычайно высокой распространенности артериальной
гипертензии (АГ) среди населения прослеживается устойчивая тенденция к
увеличению доли лиц молодого возраста в структуре АГ. Распространенность АГ
среди молодых людей до 30 лет варьирует от 3,4% до 40,7% [1–6, 12]. Возраст
дебюта АГ, считавшейся ранее свойственной только взрослым, значительно
понизился, и АГ регистрируется в более ранних возрастных группах.
АГ не только одно из самых распространенных, но и одно из наименее
диагностируемых заболеваний. Особенностью, затрудняющей диагностику АГ на ранних
стадиях у молодых людей, является транзиторный характер повышения артериального
давления (АД). Практическому врачу не всегда удается зарегистрировать АД в
моменты его повышения у молодых людей с преходящими и кратковременными подъемами
АД. Между тем известно, что редкие эпизоды повышения АД могут привести к
внезапным сердечно-сосудистым осложнениям [6, 12].
Другой важной особенностью начальных этапов АГ является длительный
бессимптомный период, в связи с чем молодые люди долгое время не знают о наличии
заболевания, редко обращаются к врачу и не склонны к самостоятельному контролю
АД, даже в периоды плохого самочувствия. Однако именно в период, когда
наблюдается низкая готовность пациентов к обследованию и выполнению врачебных
рекомендаций, диагностика и лечение эссенциальной АГ особенно эффективны.
Неспецифичность клинических проявлений АГ у молодых и отсутствие адекватных
алгоритмов диагностики, ориентированных на этот возраст, затрудняют врачебную
оценку симптомов заболевания. В этих условиях многократно возрастает роль
вероятностных методов оценки клинических данных.
Целью настоящего исследования было на основе изучения клинико-функциональных
особенностей течения артериальной гипертензии, вегетативного статуса,
морфофункционального состояния сердечно-сосудистой системы выявить наиболее
информативные диагностические критерии начальной стадии артериальной гипертензии
у лиц молодого возраста.
Материалы и методы исследования
На базе территориальной поликлиники № 1 г. Омска, клиники Омской
государственной медицинской академии выполнено исследование типа
«случай–контроль», в которое включено 114 пациентов с транзиторным повышением АД
до I степени при динамическом наблюдении и отсутствием выявляемых при
стандартных клинических обследованиях поражений органов-мишеней (группа 1); 53
пациента с АГ со стабильным повышением АД I–II степени и наличием поражений
органов-мишеней (группа 2) и 32 молодых человека, не имеющих при динамическом
наблюдении повышения АД (контрольная группа). Группы были сопоставимы по полу,
возрасту (информационная статистика Кульбака, 2I = 2,61–8,72; p = 0,0781).
Критерии включения: мужчины и женщины в возрасте от 18 до 27 лет; пациенты с
повышенным уровнем АД I–II степени; информированное согласие пациента
участвовать в исследовании.
Критерии исключения: симптоматическая артериальная гипертензия; беременность;
использование гормональных контрацептивов, нестероидных противовоспалительных
препаратов и других медикаментозных средств, способствующих повышению АД;
обострение хронических или появление острых воспалительных заболеваний в
процессе исследования; нежелание пациента участвовать в исследовании.
Комплексное клиническое обследование включало сбор жалоб, анамнеза, оценку
факторов риска АГ, определение веса, роста, окружности талии. Диагноз АГ
устанавливали в соответствии с рекомендациями Всероссийского научного общества
кардиологов (ВНОК) (2003, 2007) — при уровне систолического артериального
давления (САД) ≥ 140 м рт. ст. и/или диастолического артериального давления (ДАД)
≥ 90 мм рт. ст. [7, 8]. Исключение симптоматических форм АГ осуществлялось в
соответствии с рекомендациями Комитета экспертов ВНОК [7].
Суточное мониторирование АД (СМАД) проводилось амбулаторно в режиме
«типичного рабочего дня» при помощи монитора «Bplab» (ООО «Петр Телегин», Нижний
Новгород) по стандартной методике [9]. Эхо-кардиография (ЭхоКГ) и допплер-ЭхоКГ
проводились из общепринятых позиций в положении на аппарате «Ultramark-9 HDI ATL»
(США). В исследовании применялись одномерный, двухмерный методы ЭхоКГ,
допплер-ЭхоКГ и метод цветного допплеровского картирования внутрисердечных
потоков.
Для оценки состояния вегетативного статуса выполнялась динамическая запись
кардиоинтервалограмм (КИГ) при выполнении клиноортостатической пробы (КОП) [10]
с использованием комплекса для автоматизированной интегральной оценки
функционального состояния сердечнососудистой системы «Кардиометр-МТ» (ТОО «МИКАРД»,
СПб). Динамическая регистрация КИГ осуществлялась следующим образом: после
10-минутного отдыха в положении лежа измерялись частота сердечных сокращений (ЧСС)
и АД и проводилась запись КИГ-1 (исходная). Сразу же после перехода в
вертикальное положение измерялись ЧСС и АД и регистрировалась запись КИГ-2 в
положении стоя, и продолжалось измерение АД и ЧСС через минутные интервалы в
течение 10 мин. Затем пациента вновь просили лечь. Запись КИГ-3 осуществлялась
сразу после возвращения в горизонтальное положение, АД и ЧСС измеряли до тех
пор, пока они не достигали исходного значения. В каждом из трех массивов
кардиоциклов рассчитывали базовые (мода, амплитуда моды, вариационный размах) и
вторичные показатели: индекс вегетативного равновесия (ИВР); вегетативный
показатель ритма (ВПР); показатель активности процессов регуляции (ПАПР); индекс
напряжения регуляторных систем (ИН). Вегетативная реактивность оценивалась по
отношению ИН в положении стоя к ИН в положении лежа [10, 11, 14].
Биометрический анализ осуществлялся с использованием пакетов SAS 6.12, SPSS
10 и Statistica 6 при консультировании руководителя центра «Биостатистика»,
доцента кафедры статистики Томского государственного университета, канд. техн.
наук В. П. Леонова.
Средние выборочные значения количественных признаков приведены в тексте в
виде M ± SD, где М — среднее выборочное, SD — стандартное отклонение. В случае
наличия ненормального распределения значений в ряду указывалась медиана (V0,5),
25-й процентиль (V0,25) и 75-й процентиль (V0,75).
В исследовании применялись методы дисперсионного, дискриминантного и
кластерного анализов, анализ таблиц сопряженности. При анализе таблиц
сопряженности оценивались значения статистики Пирсона Хи-квадрат (χ2),
достигнутый уровень значимости (р) и фи-коэффициент (φ) — показатель силы связи.
Вклады в связь дискретных признаков изучали по величине Δχij2
отдельных клеток таблиц сопряженности. Для сравнения числовых данных более чем
двух групп использовался критерий Краскела–Уоллиса (Н) и непараметрический
дисперсионный анализ. При построении прогностических вероятностных моделей
использовали многофакторный логистический регрессионный анализ (методики со
свободным членом (B0), без свободного члена, с последовательным включением и
исключением независимых переменных) [13]. Построение порядка 100 уравнений
логистической регрессии осуществлялось с использова нием 170–254 признаков. В
каждом из вариантов уравнения пошаговый алгоритм отбирал предикторы с указанием
процента верного предсказания — значения (Concordant) и величины коэффициента
связи (Somers’D). Приемлемый уровень значимости для статистики Вальда полученных
в ходе регрессионного анализа свободного члена и коэффициентов уравнения
логит-регресии составлял от 5% до 15%. Достигнутые уровни значимости теста
согласия Hosmer and Lemeshow во всех итоговых уравнениях составляли 0,7–0,9, что
свидетельствовало о высокой степени адекватности созданных моделей реальным
данным. Во всех процедурах статистического анализа критический уровень
значимости р принимался равным 0,05.
Результаты и обсуждение
Диагностика АГ во 2-й группе не представляла трудностей. Средние значения
офисного САД/ДАД составили соответственно 148,61 ± 6,79/96,32 ± 5,33 мм рт. ст.
У пациентов данной группы наблюдалось стабильное повышение уровня АД: в 42,3%
случаев — постоянно в течение суток, в 27,5% — с ежедневными его подъемами по
3–5 часов от одного до нескольких раз в сутки, а в 30,2% случаев — до суток и
более. Поэтому подтвердить повышение АД при повторных измерениях было не сложно:
в среднем в 9 из 10 измерений регистрировалось АД ≥ 140/90 мм рт. ст. У 58,5%
пациентов уровень офисного АД соответствовал АГ II степени. Особенностью группы
явилась довольно высокая частота структурных изменений миокарда левого желудочка
(ЛЖ): в 34,0% случаев выявлена концентрическая гипертрофия ЛЖ. Таким образом,
стабильное повышение АД, наличие поражений органов-мишеней указывали на то, что
у пациентов данной группы был пропущен начальный этап развития болезни.
Диагностика АГ у пациентов 1-й группы, напротив, представляла чрезвычайно
сложную задачу. Так, средние значения клинического САД и ДАД находились в
диапазоне ниже 140/90 мм рт. ст. (137,64 ± 6,68/88,78 ± 4,70 мм рт. ст.). Однако
в анамнезе у всех пациентов отмечались эпизоды повышения АД до уровня II
степени: в 38,5% случаев с частотой до 1–2 раз в неделю, в 31,6% — до 1–2 раз в
месяц и в 29,9% — 1 раз в 2–6 месяцев. Причем у большинства молодых людей
(56,1%) АД повышалось кратковременно, до 1–2 часов, в 36,0% случаев — до 2–6
часов и только в 7,9% случаев — до суток.
Поскольку результаты клинических измерений повышенного АД в этой группе
пациентов отличались низкой воспроизводимостью, для подтверждения повышения АД ≥
140/90 мм рт. ст. потребовались многократные офисные измерения с длительным
(более двух недель) интервалом. В итоге лишь в 4 офисных измерениях из 10 у
представителей группы 1 регистрировалось повышение уровня АД. Вместе с тем
несмотря на то, что в 6 случаях из 10 уровень АД у них находился в диапазоне от
оптимального до высокого нормального, средние значения офисного САД и ДАД были
значимо выше, чем у здоровых сверстников контрольной группы (116,55 ± 5,94/73,92
± 5,62 мм рт. ст.; р < 0,0001).
Таким образом, своевременная диагностика АГ у пациентов этой группы стала
возможной исключительно благодаря многократным офисным измерениям АД и довольно
продолжительному периоду наблюдения. В то время как стандартный подход,
ограничивающийся трехкратными измерениями АД с интервалом между измерениями не
менее недели, не обеспечивал достаточной воспроизводимости результатов
клинических измерений АД у молодых пациентов с неустойчивым повышением уровня
АД. Очевидно, именно поэтому пациенты данной категории чаще всего остаются без
наблюдения, а заболевание у них выявляется уже на стадии поражения
органов-мишеней.
Анализ таблиц сопряженности позволил установить наличие связи между
стабильностью повышения АД и длительностью АГ. Для общей группы значение χ2
составило 89,74 (р = 0,0001), для группы юношей χ2 = 48,33 (р =
0,006), для группы девушек χ2 = 52,39 (р = 0,0001). В группе 1
эпизоды повышения АД регистрировались в течение последних 3 лет (V0,25
= 2,0, V0,75 = 9,0), а во 2-й группе — 7 лет (V0,25 = 4,0,
V0,75 = 12,5) (p = 0,041).
Оценка субъективной симптоматики свидетельствовала об отсутствии каких-либо
жалоб у значительной части пациентов 1-й и 2-й групп (33,9% и 31,7%
соответственно). В случае если жалобы имели место, то сводились к головной боли
различной локализации (44,4% и 47,2%; р = 0,47), головокружению (9,1% и 10,5%; р
= 0,06), учащенному сердцебиению (6,3% и 5,7%; р = 0,89), дискомфортным
ощущениям в области сердца (4,3% и 2,5%; р = 0,054). В 2,0% и 2,4% случаев
отмечались только общие жалобы — слабость, усталость, тяжесть во всем теле.
Лишь 29,9% и 34,6% молодых пациентов обеих групп предполагали связь
субъективных ощущений с повышением АД, независимо от того, измерялось при этом
АД или нет. Во всех остальных случаях наиболее частой причиной жалоб было
названо эмоциональное напряжение (удельный вес в структуре причин — 58,6% и
56,1%), интенсивная или умеренная физическая нагрузка (4,6% и 5,1%), перемена
погоды (3,8% и 2,2%), умственное напряжение (3,1% и 2,0%).
Таким образом, вследствие неспецифичности субъективной симптоматики, низкой
информированности о факторах, способствующих развитию АГ, молодые пациенты с АГ
не склонны измерять уровень АД в периоды ухудшения самочувствия, что затрудняет
раннюю диагностику заболевания у лиц молодого возраста.
Анализ факторов риска (ФР) показал отсутствие статистически значимых различий
между представителями 1-й, 2-й и контрольной групп по распространенности
курения, низкой физической активности, избыточного употребления поваренной соли,
частого употребления алкоголя. Пациентов с нарушениями углеводного обмена среди
обследованных лиц не было. Дислипидемия выявлена лишь во 2-й группе (45,3%).
Отягощенная по ранним сердечно-сосудистым заболеваниям наследственность в
группах 1 и 2 встречалась одинаково часто (79,5%). Полученные данные
свидетельствовали о низкой информативности ФР для ранней диагностики АГ у лиц
молодого возраста.
Вместе с тем при анализе многочисленных таблиц сопряженности установлено
наличие значимой связи ФР со стабилизацией повышения АД. Так, на формирование
лабильной АГ оказывали влияние такие факторы, как курение (χ2 =
355,6; φ = 0,67; р < 0,0001), в том числе пассивное (χ2 = 46,7; φ =
0,30; р < 0,0001), занятия физкультурой менее 1 раза в неделю (χ2 =
189,1; φ = 0,62; р < 0,0001), АГ у матери (χ2 = 32,4; φ = 0,21; р <
0,0001), АГ у отца (χ2 = 26,2; φ = 0,28; р < 0,0001), частота
употребления алкоголя более 1 раза в неделю (χ2 = 29,8; φ = 0,22; р <
0,0001), мужской пол (χ2 = 23,7; φ = 0,22; р = 0,003), повышение АД у
матери во время беременности (χ2 = 16,8; φ = 0,29; р = 0,008).
На формирование стабильной АГ оказывали влияние: полное освобождение от
физкультуры в учебном заведении (χ2 = 242,6; φ = 0,69; р < 0,0001),
избыточная масса тела (χ2 = 147,3; φ = 0,57; р < 0,0001), курение (χ2
= 113,4; φ = 0,41; р < 0,0001), ожирение у матери (χ2 = 16,1; φ =
0,29; р = 0,0011), наличие инсультов по линии матери (χ2 = 7,7; φ =
0,20; р = 0,042), наличие инсультов по линии отца (χ2 = 7,6; φ =
0,21; р = 0,023), пиелонефрит у матери во время беременности (χ2 =
9,1; φ = 0,20; р = 0,028), низкая масса тела при рождении (χ2 = 7,7;
φ = 0,19; р = 0,052).
Комплексная оценка суточных профилей АД подтвердила стически значимое
повышение уровня САД и ДАД в течение суток и отдельные временные интервалы
(табл. 1).
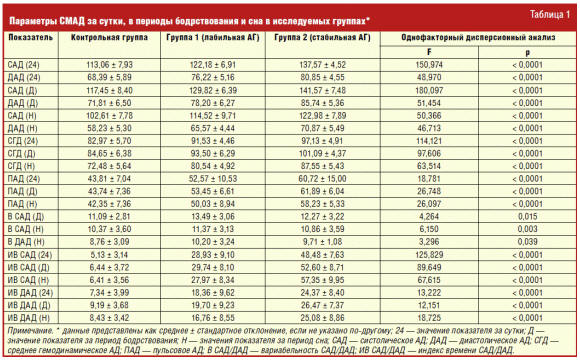
Подтвердить наличие АГ в день мониторирования у пациентов 1-й группы удалось
лишь в 78,1% случаев. Более того, средние значения САД и ДАД ни в течение суток,
ни в периоды бодрствования и сна не превышали критических значений «нормы».
Таким образом, для ранней диагностики АГ у молодых пациентов в условиях редких
эпизодов повышения АД оценки одних только усредненных значений основных
показателей СМАД недостаточно. В связи с этим нами проведен комплексный анализ
всех компонентов суточного профиля АД.
Существенное повышение среднего гемодинамического давления (СГД) и пульсового
артериального давления (ПАД) у пациентов 2-й группы подтверждало наличие у них
стабильной АГ. Между тем в группе 1, несмотря на малое количество эпизодов
повышения АД в день мониторирования, СГД также превышало допустимые значения, в
том числе и в сравнении с контрольной группой. Подобная тенденция к повышению
СГД обусловлена качественно новой перестройкой гемодинамики на начальных стадиях
АГ за счет неадекватного снижения тонуса периферических сосудов. Значения ПАД в
различные периоды мониторирования у пациентов группы 1 находились в пределах
41–52 мм рт. ст. и лишь в 31,4% случаев были повышенными, что указывало на
вероятность очень раннего развития осложнений у данного контингента больных.
Кроме того, в группе 1 наблюдалось повышение вариабельности АД в дневные (САД,
ДАД) и ночные (ДАД) часы по сравнению с контрольной группой, что
свидетельствовало о повышенной активности симпатического звена вегетативной
нервной системы (ВНС) в группе молодых лиц с ранней стадией АГ. Значительная
доля молодых людей 1-й и 2-й групп имела прогностически неблагоприятный вариант
циркадного профиля САД (54,4 и 62,3% соответственно) и ДАД (50,9 и 69,8%
соответственно), что свидетельствовало о наличии неблагоприятного ритма
функционирования симпатического отдела ВНС.
Количественная оценка эпизодов повышения АД актуальна у лиц с лабильной
гипертензией. Так, если в 2-й группе индекс времени САД не только превышал
уровень 25%, а в большинстве случаев был больше 50%, подтверждая тем самым
наличие стабильной АГ, то в группе 1 значения показателей нагрузки давлением
колебались в диапазоне 18–34%, едва превышая критические 25% у подавляющего
большинства пациентов. Очевидно, что при сочетании низкого индекса времени САД (ДАД)
с нормальными средними значениями САД (ДАД) в любые периоды мониторирования
доказать наличие АГ у пациента по сложившимся алгоритмам анализа СМАД
практически нереально. Поэтому диагностика АГ у лиц молодого возраста должна
опираться как на данные офисных измерений АД, так и результаты СМАД. Тем не
менее, при сравнении показателей нагрузки САД группы 1 со здоровыми сверстниками
было отмечено существенное их увеличение в дневные (в 5 раз) и в ночные (в 4
раза) часы. Нагрузка ДАД в дневные и ночные часы в группе 1 была выше в среднем
в 2 раза. Таким образом, многократное увеличение гипербарической нагрузки на
органы-мишени при незначительном, на первый взгляд, подъеме средних значений САД
и ДАД в этой группе пациентов наиболее ярко демонстрирует суть «скрытых»
изменений в функционировании сердечнососудистой системы на ранних этапах АГ в
молодом возрасте. Суточный профиль группы 2 характеризовался более высоким
уровнем нагрузки давлением во все периоды мониторирования, превышая значения
контрольной группы в 8–9 раз.
Результаты СМАД свидетельствуют, что диагностически значимое превышение
рекомендуемых норм отмечается лишь у больных со стабильной АГ I–II степени, то
есть при высокой нагрузке давлением на органы-мишени. У лиц же с транзиторным
повышением АД средние значения САД и ДАД в день мониторирования могут оставаться
неизмененными. Вместе с тем могут существенно изменяться такие показатели, как
СГД, ПАД, ИВ. Поэтому при постановке диагноза АГ требуется комплексная оценка
всех параметров суточного профиля АД, что позволит врачам первичного звена,
специализированных отделений стационаров вскрывать суть имеющихся расхождений
заключений СМАД и результатов клинических измерений АД у молодых людей с редкими
эпизодами повышения АД и определять тактику ведения молодых пациентов. Тем не
менее, несмотря на высокую информативность параметров СМАД, у пациентов с
лабильной АГ далеко не всегда возможно выявить характерные сдвиги в день
мониторирования.
Исследование показателей КИГ в состоянии покоя у молодых пациентов с АГ 1-й и
2-й групп выявило преобладание симпатикотонии в исходном вегетативном тонусе при
сопоставлении с группой контроля. По всем параметрам, отражающим исходный
вегетативный тонус (Мо1 и Мо3, ЧСС1 и ЧСС3, ВПР, ПАПР и ИН при 1-й и 3-й записях
КИГ) пациенты 2-й группы статистически значимо отличались от контрольной группы
(табл. 2). Средние значения указанных параметров КИГ в группе 1 занимали
промежуточное положение между группами здоровых и пациентов с АГ, имеющих
поражение органов-мишеней (ПОМ), и не имели статистически значимых отличий от
контрольной группы.
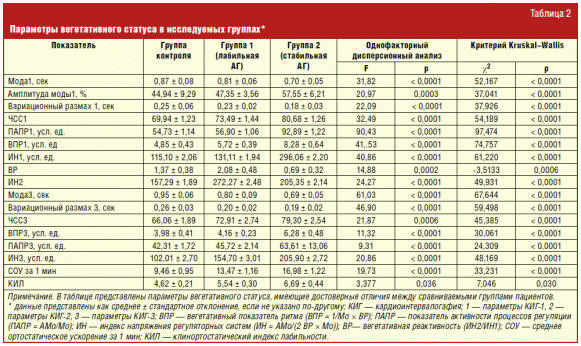
Анализ выявил уменьшение средних значений Мо1 и Мо3 в 1-й и особенно во 2-й
группе обследованных по сравнению с контрольной группой. Показатели моды во 2-й
группе отражали преобладание симпатикотонии как наиболее вероятного уровня
функционирования систем регуляции синусового узла в покое у молодых пациентов со
стабильной АГ, имеющих ПОМ [14–16]. Средние значения моды в группе контроля и
1-й группе были характерны для вегетативного равновесия. Более высокие значения
ВПР1, ВПР3, ПАПР1 и ПАПР3 у молодых людей 2-й группы свидетельствовали об
уменьшении парасимпатических влияний и относительном преобладании уровня
симпатической активности у этих пациентов. Значительное повышение ИН1 и ИН3 во
2-й группе по сравнению с контролем отражало высокую степень напряжения
регуляторных систем организма в состоянии покоя у молодых пациентов со
стабильной АГ и ПОМ (табл. 2). Средние значения расчетных показателей КИГ (ВПР,
ПАПР и ИН) в 1-й группе отражали ту же тенденцию
к увеличению симпатических влияний и напряжению систем регуляции на
функциональной стадии АГ [17]. Но поскольку эти изменения не столь значительно
выражены в дебюте заболевания у молодых людей, по средним значениям исследуемых
параметров сложно достоверно отличить этих пациентов от здоровых (табл. 2).
Различие в характере вегетативной реактивности (ВР), отражающей
направленность и степень изменения состояния ВНС в момент перехода организма из
одного состояния в другое, представляет особый интерес. Статистически значимо
выше оказались средние значения ВР в контрольной группе по сравнению с
пациентами 2-й группы (табл. 2). Причем у большинства здоровых молодых людей
обнаруживалась нормальная ВР, хотя отмечалась гиперсимпатическая и даже (5%) —
асимпатическая (рис. 1). Для 2-й группы пациентов была характерна тенденция к
истощению ВР: в 52,2% случаев наблюдалась асимпатическая и лишь в 26,5% —
гиперсимпатическая. С одной стороны, обнаруженную склонность к снижению ВР у
молодых пациентов со стабильным течением АГ можно объяснить исходно высоким
уровнем активности ВНС (закон «начального значения» Уайлдера [10]. С другой —
постепенно формирующимся истощением механизмов вегетативной регуляции при
развитии АГ, в условиях длительно существующего перенапряжения. Вероятно,
исчерпание резервов быстрой вегетативной регуляции функций, в том числе
регуляции изменений сосудистого тонуса, и способствует стабилизации АД, а также
возрастанию роли более медленных гуморальных влияний на работу
сердечно-сосудистой системы (ССС) [19–21].
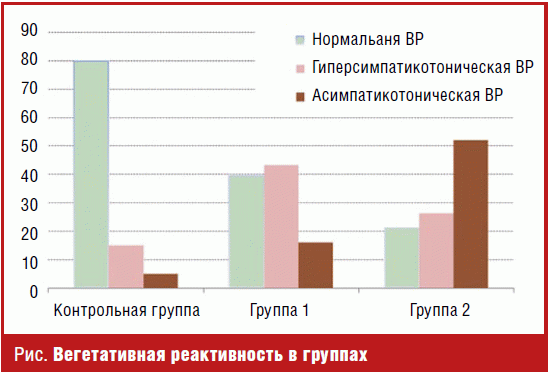
Среди молодых пациентов 1-й группы выявлена тенденция к гиперсимпатической ВР
(43,5%), средние значения ВР в этой группе оказались значительно выше, чем в
контрольной и 2-й группах (табл. 2). Причем в 34,4% пациентов 1-й группы имели
крайне высокие значения показателя ВР в пределах 7–8, чего не наблюдалось в
других группах. Нормальная ВР регистрировалась в 39,4% случаев (рис. 1).
Полученные данные согласуются с результатами других исследований, выявлявших
повышенную реактивность САС в ответ на ее стимуляцию, характерную для пациентов
с лабильной гипертонией на ранней стадии ГБ [18, 20, 21].
При сравнительном анализе показателей КИГ примечательно, что ни по одному из
показателей КИГ-2 (в ортоположении), а также КИГ-4 (после пробы с физической
нагрузкой) не выявлено достоверных отличий в сравниваемых группах.
Нетренированность и склонность к гиподинамии современной молодежи приводит к
замедленному восстановлению вегетативного равновесия после физической нагрузки и
длительно сохраняющейся застойности симпатического возбуждения у пациентов всех
трех групп обследования, что объясняет отсутствие достоверных различий в
показателях КИГ-4.
Показатели эхокардиографии. Вклад повышенного кровенаполнения сердца в генез
АГ у молодых людей нашел подтверждение в статистически значимом увеличении
показателей центральной гемодинамики (КДО, УО и МО) (табл. 3). Однако у
пациентов с начальными проявлениями АГ наблюдались более высокие значения
ударного и сердечного индексов по сравнению с контрольной группой и группой со
стабильной АГ. И хотя периферическое сосудистое сопротивление кровотоку в группе
1 имело тенденцию к снижению, по сравнению с контрольной группой это снижение не
было адекватным применительно к высоким объемам сердечного выброса. Выявленные
изменения свидетельствовали о преобладании гиперкинетического типа
кровообращения, характерного именно для ранней стадии АГ у лиц молодого
возраста.
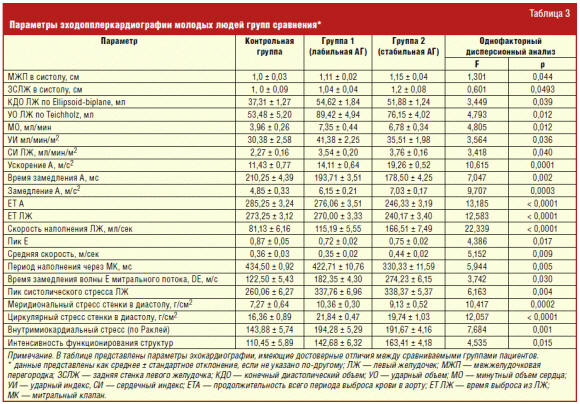
Увеличение сердечного выброса у лиц с начальными проявлениями АГ было
обусловлено возрастанием влияний симпатической нервной системы на ССС и
проявлялось повышением ЧСС и глобальной сократимости миокарда ЛЖ в виде
статистически значимого увеличения скоростных показателей аортального потока и
изменения фазовой структуры систолы ЛЖ в сторону укорочения периода изгнания (ET).
Причем критическим уровнем, подтверждающим наличие лабильной АГ у молодых людей,
явились снижение ЕТ ЛЖ < 260 мс.
Анализ допплеровских показателей митрального потока выявил снижение доли
кровотока в раннюю фазу диастолического наполнения ЛЖ. В обеих группах пациентов
с АГ наблюдалось значимое увеличение времени изоволюметрического расслабления (IVRT),
снижение пика скорости (Е), укорочение времени ускорения раннего диастолического
наполнения (АТе), а также изменение показателя активной релаксации — отношения
времени изоволюметрического расслабления к продолжительности всей диастолы (IVRT/ЕТ).
При этом значения конечного диастолического давления в ЛЖ и критерий Е/А не
отличались от данных контрольной группы. Уменьшение вклада фазы раннего
диастолического наполнения ЛЖ указывает на недостаточную релаксацию миокарда ЛЖ
и снижение податливости его стенок, формирующихся в условиях укорочения диастолы
на фоне возрастания ЧСС при избыточном ино-и хронотропном влиянии симпатического
отдела и снижении охранительной функции парасимпатического отдела ВНС. Таким
образом, диастолическая дисфункция у молодых лиц с АГ характеризовалась
нарушением начальной, наиболее энергозависимой части диастолы, обусловленной
процессами активного расслабления миокарда.
Следствием недостаточного расслабления сердечной мышцы в фазу диастолы у
молодых людей с АГ явилось значимое увеличение показателей миокардиальных
стрессов. Причем у пациентов группы 1 увеличение значений диастолических
циркулярного и меридионального стрессов стенки ЛЖ было более существенным, чем у
пациентов со стабильной АГ. Это свидетельствовало о возрастании напряжения,
воздействующего на негипертрофированную стенку ЛЖ, работающего в условиях
компенсаторной гиперфункции. Соответственно, при формировании гипертрофии ЛЖ
снижение силы, воздействующей на единицу площади поперечного сечения миокарда,
сопровождается уменьшением миокардиальных стрессов, что имело место у пациентов
группы 2. Увеличение пика систолического стресса ЛЖ, наряду с увеличением
циркулярного и меридионального диастолических стрессов, отражает формирующийся
энергодефицит, десинхронизацию процессов напряжения и расслабления в
кардиомиоцитах и срыв адаптации ССС у пациентов с АГ. Это может служить пусковым
моментом в развитии процессов ремоделирования миокарда и структурной перестройки
сосудов, приводящих к закреплению АГ.
В результате анализа комплекса параметров выделены признаки, отражающие
вектор изменений на ранней стадии АГ. Хотя значения выявленных показателей
отличаются более стабильными характеристиками, чем уровень АД, но ни один
признак сам по себе не позволяет своевременно поставить диагноз АГ. Более того,
увидеть этот вектор можно лишь при сравнении среднегрупповых значений. Однако в
практической деятельности врачу приходится работать с индивидуальными
комбинациями параметров каждого пациента, что обусловливает необходимость оценки
взаимосвязи признаков и симптомов в совокупности.
С целью такой оценки и прогнозирования стадии АГ проведен многофакторный
логистический регрессионный анализ [13]. Процент верного прогнозирования стадии
АГ варьировал от 99,9% до 95,9%, в зависимости от числа обследованных в группах
и числа введенных предикторов, по которым можно проследить динамику
предсказательной ценности каждого признака (предиктора). Пошаговым логистическим
анализом из 234 предикторов (уровней АД, показателей СМАД, КИГ, ЭхоКГ и т. д.),
участвующих в построении уравнений, алгоритм отобрал 2 группы признаков,
обеспечивающих высокую степень прогнозирования начальной стадии АГ (табл. 4).
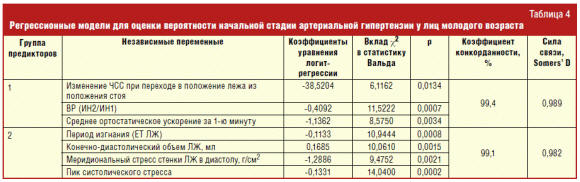
В первую группу предикторов вошли показатели, с первого шага логистического
уравнения обеспечивающие 99,4% правильного прогнозирования начальной стадии АГ и
характеризующие независимый от других факторов вектор изменчивости вегетативной
регуляции: изменение ЧСС при переходе в положение лежа из положения стоя,
показатель вегетативной реактивности, рассчитанный на основе КИГ по отношению
ИН2/ИН1, а также параметр анализа первой минуты после изменения положения тела
при проведении клиноортостатической пробы — среднее ортостатическое ускорение за
1 минуту. Ценность выделенной группы предикторов тем более велика, что в нее
вошли параметры из разных видов анализа, но характеризующие одну единственную
категорию — вегетативную реактивность, имеющую специфичную для ранней стадии АГ
у молодых людей динамику: повышается в группе с лабильным течением АГ и
снижается в группе со стабильно высоким уровнем АД. Повышение показателя ВР
отражает высокую лабильность вегетативной регуляции и гиперсимпатическую
вегетативную реактивность у молодых людей с начальной стадией АГ.
Во вторую группу предикторов вошли период изгнания крови из левого желудочка
(ЕТ ЛЖ), КДО, меридиональный стресс в диастолу и пик систолического стресса,
характеризующие компенсаторную гиперфункцию ЛЖ в условиях повышенного
кровенаполнения сердца на ранней стадии АГ. Укорочение периода изгнания
способствует осуществлению сердечного выброса за более короткий интервал
времени. Это достигается за счет интенсификации напряжения негипертрофированной
сердечной мышцы. Пик систолического стресса и диастолический меридиональный
стресс и является той самой мерой напряжения, которую испытывает еще
негипертрофированная стенка миокарда ЛЖ в диастолу при работе сердца с
повышенной функциональной нагрузкой.
Для прогнозирования стабилизации АГ у молодых людей из 234 предложенных
предикторов алгоритм также отобрал две группы признаков, сохранивших свою
предсказательную ценность во всех уравнениях логистической регрессии. Наиболее
значимыми (из 1-й группы предикторов) прогностическими факторами (Concordant =
99,3%; Somers’D = 0,986) явились: высокий уровень «соматизации тревоги» (р =
0,028) и величина показателя адекватности процессов регуляции (р = 0,004),
свидетельствующего о преобладании симпатических влияний над парасимпатическими в
исходном вегетативном тонусе у молодых пациентов при стабилизации АГ. Во второй
группе (Concordant = 96,0%; Somers’D = 0,920) клинически значимыми были
предикторы: толщина задней стенки левого желудочка (р = 0,0056); величина УО (р
= 0,0030), изменение показателя активной релаксации миокарда ЛЖ (IVRT/ЕТ; р <
0,0001).
В других итоговых уравнениях логистической регрессии для пациентов с АГ имели
значение предикторы, обеспечивающие 89,3–98,4% верного прогнозирования
стабильной АГ: гипертрофия левого желудочка (р < 0,0001), величина САД (р <
0,0001), величина ДАД (р < 0,0001), возраст первого повышения АД (р = 0,0012),
отношение E/A (р = 0,0011), давность АГ (р = 0,0056), индекс массы тела (р =
0,0002), возраст первого повышения АД (р = 0,021), длинная ось левого предсердия
в диастолу (р = 0,0011), общее периферическое сосудистое сопротивление (р =
0,0021), вспыльчивость (р = 0,0259), семейный анамнез по заболеваниям ССС (р =
0,0441).
Таким образом, для ранней диагностики артериальной гипертензии в первую
очередь необходима, наряду с известными специфическими факторами риска, оценка
параметров СМАД, вегетативных, гемодинамических факторов, обеспечивающих в
совокупности высокую вероятность верного прогноза течения заболевания, что
крайне важно у лиц с транзиторным повышением АД.
В ряде клинических ситуаций, когда невозможна достаточно уверенная оценка
совокупности параметров и постановка диагноза АГ у молодого пациента,
целесообразно для принятия клинического решения использовать установленные в
исследовании информативные предикторы. Нами разработана компьютерная программа
для расчета риска АГ и вероятности ее стабилизации у молодых людей, содержащая
решения, основанные на приведенном подходе. Данную программу легко можно
использовать как при первичном кардиологическом скрининге без проведения
углубленного обследования (уже при первом посещении врача), так и для уточнения
диагноза и стадии АГ.
Совокупность указанных диагностических инструментов составляет содержание
предложенных нами усовершенствований вторичного уровня системы профилактики АГ и
позволят предотвратить заболевание или, по меньшей мере, отодвинуть его дебют на
более поздний возраст.
Литература
-
Оганов Р. Г., Масленникова Г. Я. Смертность от
сердечно-сосудистых и других хронических неинфекционных заболеваний среди
трудоспособного населения России // Кардиоваскулярная терапия и профилактика.
2002. № 3. С. 4–8. -
Кисляк О. А., Петрова Е. В., Чиркова Н. Н. Особенности
эссенциальной артериальной гипертензии в подростковом возрасте // Сердце.
2006. Т. 5. № 4. С. 16–19. -
Marco M., Chinali M., Roman M. et al. Predictors of Four-Year
Incident Arterial Hypertension From Initial Prehypertension: The Strong Heart
Study // Circulation. 2007. № 116. P. 833–835. -
Yu D., Huang J., Hu D. et al. Prevalence and risk factors of
prehypertension among Chinese adults // J Cardiovasc Pharmacol. 2008. № 52
(4). P. 363–368. -
Агеев Ф. Т., Фомин И. В., Мареев В. Ю., Беленков Ю. Н. и др.
Распространенность артериальной гипертонии в Европейской части Российской
Федерации. Данные исследования ЭПОХА, 2003 г. // Кардиология. 2004. № 11. С.
50–54. -
Александров А. А., Розанов В. Б. Профилактика артериальной
гипертензии с детства: подходы, проблемы, перспективы // Кардиоваскулярная
терапия и профилактика. 2004. № 3. С. 5–9. - Диагностика и лечение артериальной гипертензии. Рекомендации Российского
медицинского общества по артериальной гипертонии и Всероссийского научного
общества кардиологов (4-й пересмотр) // Системные гипертензии. 2010; 3: 5–26. - Guidelines for the Management of Arterial Hypertension The Task Force for
the Management of Arterial Hypertension of the European Society of
Hypertension and of the European Society of Cardiology // J Hypertens. 2007;
25: 1105–1187. -
Рогоза А. Н. Суточное мониторирование артериального давления //
Сердце. 2002. Т. 1, № 5. С. 240–245. -
Баевский Р. М., Кириллов О. И., Клецкин С. З. Математический
анализ изменений сердечного ритма при стрессе. М.: Наука. 1984. 221 с. - Вегетативные расстройства: клиника, лечение, диагностика / Под ред. А. М.
Вейна. М.: МИА, 2000. 752 с. -
Bakx J. C., van den Hoogen H. J., van den Bosch W. J. et al.
Development of blood pressure and the incidence of hypertension in men and
women over 18-year period: results of the Nijmegen Cohort Study // J Clin
Epidemiol. 1999. № 52. Р. 431–438. -
Леонов В. П. Логистическая регрессия в медицине и биологии.
Биометрика. [Электронный ресурс] URL: http://www.biometrica. tomsk.ru. -
Shengxu L., Chen W., Sathanur R. et al. Childhood Blood Pressure
as a Predictor of Arterial Stiffness in Young Adults // The Bogalusa Heart
Study Hypertension. 2004. № 43. Р. 541–546. -
Guyentol P. G. The sympathetic controlof blood pressure // Nat
Rev Neuroscience. 2006. № 7. Р. 335–346. -
Osborn J. W., Jacob F., Guzman P. A neural set point for the
long-term control of arterial pressure: beyond the arterial baroreceptor
reflex // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2005. № 288. Р.
846–855. -
Brooks V. L., Haywood J. R., Johnson A. K. Translation of salt
retention to central activation of the sympathetic nervous system in
hypertension // Clin. Exp. Pharmacol. Physiol. 2005. № 32. Р. 426–432. -
Kosh M., Hausberg M., Barenbrock M. et al. Studies of cardiac
sympathovagal balance and large artery distensibility in patients with
untreated essential hypertension // J Hum Hypertens. 1999. № 13. Р. 315–9. -
Guzzetti S., Piccaluga E., Casati R. et al. Sympathetic
predominance inessential hypertension: a study employing spectral analysis of
heart rate variability // J Hypertens. 1988. № 6. Р. 711–717. -
Piccirillo G., Munizzi M. R., Fimognari. et al. Heart rate
variability in hipertensive subjects // Int J Cardiol. 1996. № 53. Р. 291–298. -
Singh J. P., Larson M. G., Tsuji H. et al. Reduced heart rate
variability and new onset hypertension: insight into patogenesis of
hypertension: the Framingham Heart Study // Hypertension. 1998. № 32. Р.
293–297.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru



