Пути снижения гастроинтестинального риска при назначении нестероидных противовоспалительных средств
Т. Л. Лапина, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Нестероидные противовоспалительные средства (НПВС) остаются чрезвычайно востребованными для лечения боли и воспаления, а также для антиагрегантной терапии. Главным ограничением при приеме НПВС служит их повреждающее действие на слизистую оболочку желудочно-кишечного тракта. Смертельно опасные осложнения гастропатии, индуцированной НПВС, — желудочно-кишечное кровотечение, перфорация язвы — представляют важную проблему.
Анальгетический и противовоспалительный эффект НПВС обусловлен неселективным ингибированием фермента циклооксигеназы. Циклооксигеназа (ЦОГ; англ. cyclooxygenase, аббревиатура — COX; синоним — простагландинсинтетаза) — фермент, катализирующий синтез простаноидов, в том числе простагландинов, простациклина и тромбоксана. Простаноиды — важнейшие медиаторы воспаления, боли, терморегуляции, но их физиологические эффекты этим не исчерпываются, они имеют большое значение для регулирования функций сосудов, почек, костной ткани, желудочно-кишечного тракта и других органов и тканей. Фармакологическое ингибирование ЦОГ в первую очередь облегчает симптомы воспаления и боль [1–3].
Известны три изоформы ЦОГ, наибольшее значение имеют ЦОГ-1 и ЦОГ-2. Обе изоформы катализируют одну и ту же химическую реакцию. ЦОГ-1 обнаруживается во всех тканях, и ее экспрессия не зависит от воспаления: одни и те же уровни мРНК и собственно ЦОГ-1 определяются в эксперименте в нормальных тканях и при их воспалении. Оказалось, что активность ЦОГ-1 возрастает в опухолях и имеет существенное значение для туморогенеза. ЦОГ-2 не определяется в нормальных тканях. Экспрессия ЦОГ-2 тесным образом связана с воспалением, так как индуцируется медиаторами воспаления — липополисахаридами, интерлейкином-1, тумор-некротизирующим фактором-α в клетках и тканях (моноцитах, макрофагах, остеокластах, эндотелии сосудов и проч.) [1–3].
Повреждение слизистой оболочки желудочно-кишечного тракта при приеме НПВП вызвано снижением синтеза простагландинов за счет ингибирования ЦОГ-1. Такие простагландины, как PGE2 и PGE1, синтезируемые благодаря ЦОГ-1, экспрессируемой слизистой оболочкой, снижают секрецию кислоты париетальными клетками желудка, увеличивают местный кровоток, стимулируют слизеобразование и секрецию бикарбонатов. Таким образом, простагландины служат ключевыми веществами, обеспечивающими защиту гастродуоденальной слизистой облочки от повреждения [1–3].
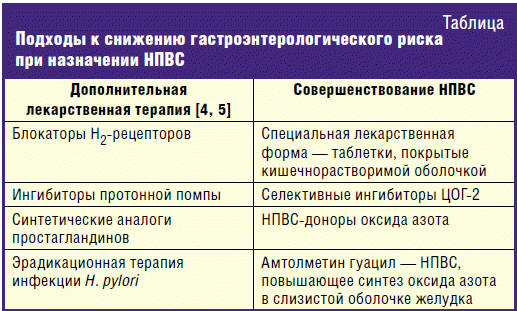
Для того чтобы избежать или минимизировать негативное воздействие НПВС на гастродуоденальную слизистую оболочку, используется два принципиальных подхода: 1) совершенствуются сами НПВС, с целью сделать их более безопасными и 2) НПВС сочетают с антисекреторными средствами (ингибиторы протонной помпы) или синтетическими аналогами простагландинов (табл.).
Большой шаг вперед в повышении гастроинтестинальной безопасности НПВС был сделан благодаря внедрению селективных ингибиторов ЦОГ-2. Систематический обзор A. Rostom и соавт. был посвящен сравнению селективных ингибиторов ЦОГ-2 и неселективных НПВС при длительном применении при артрите по безопасности для желудочно-кишечного тракта. Были проанализированы рандомизированные контролируемые исследования целекоксиба, рофекоксиба, эторикоксиба, вальдекоксиба и люмиракоксиба в сравнении с плацебо и неселективными НПВС. Условием включения в метаанализ исследований было проведение эзофагогастродуоденоскопии: гастродуоденальные язвы и их осложнения были подтверждены эндоскопически. При применении коксибов по сравнению с неселективными НПВС выявлено меньшее число гастродуоденальных язв (относительный риск составил 0,26; 95-процентный доверительный интервал 0,23–0,30) и язвенных осложнений (0,39; 0,31–0,50). Симптомы со стороны желудочно-кишечного тракта также наблюдались реже и реже служили причиной отмены противовоспалительной терапии. Важным является заключение систематического обзора о том, что одновременное назначение ацетилсалициловой кислоты вместе с коксибами ликвидирует их преимущество по безопасности по сравнению с неселективными НПВС [6]. По данным еще одного систематического обзора сделано заключение, что доказательные данные по снижению гастроинтестинального риска существенно отличаются в зависимости от конкретного коксиба [7]. Значительные опасения в связи с использованием коксибов вызваны их нежелательными кардиоваскулярными эффектами: оказалось, что их применение нарушает баланс тромбоксана А и простациклина (PGI2), увеличивая возможность тромбообразования. В 2005 г. вальдекоксиб и рофекоксиб отозваны производителями, для других препаратов предложены определенные ограничения.
Интерес к оксиду азота (NO) в связи с назначением НПВС обусловлен физиологическими свойствами этой небольшой молекулы, имеющей широкий спектр разнообразных эффектов на органы и ткани. Для слизистой оболочки желудка оксид азота выступает как фундаментальный фактор защиты, который «дублирует» протективные свойства простагландинов и оказывает с ними однонаправленный эффект. Оксид азота стимулирует секрецию слизи, регулирует микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию. В эксперименте оксид азота ослабляет ульцерогенное действие повреждающих слизистую облочку агентов, способствует заживлению экспериментальной язвы, действует сочетанно с другими защитными веществами [8–10].
Амтолметин гуацил (АМГ) является предшественником толметина, чьи противовоспалительные свойства известны с 70-х годов прошлого века. АМГ — продукт комбинаторной химической технологии, объединившей толметин с аминокислотой глицином и гваяколом. Это представитель класса НПВС, который оказывает противовоспалительное, анальгезирующее и жаропонижающее действие. Он ингибирует ЦОГ-1 и ЦОГ-2, нарушает метаболизм арахидоновой кислоты и уменьшает образование простагландинов (в том числе в очаге воспаления). При этом АМГ уникален среди других НПВС, так как обладает защитным действием на гастродуоденальную слизистую оболочку [11–14]. Так как АМГ имеет в своем составе ванилиновую группу, он стимулирует капсаициновые рецепторы, а это вызывает высвобождение гастроинтестинальных пептидов, включая пептид, кодируемый геном кальцитонина (CGRP), что приводит к увеличению синтеза оксида азота. Таким образом, в самой структуре АМГ заложен защитный эффект для гастродуоденальной слизистой оболочки, который компенсирует ослабление защиты за счет снижения эндогенных простагландинов при ингибировании ЦОГ [11, 12].
В отличие от НПВС, которые служат донорами NO, повышение продукции оксида азота при приеме АМГ происходит локально в слизистой оболочке желудка. АМГ быстро гидролизуется эстеразами до толметина и толметина глицинамида: данные метаболиты не обладают способностью стимулировать синтез NO. Селективное и локальное повышение NO в слизистой оболочке желудка, а не в других тканях и органах следует оценивать как преимущество АМГ в сравнении с донорами оксида азота, который обладает широчайшим спектром трудно прогнозируемых биологических эффектов.
В экспериментальных исследованиях АМГ вводили крысам внутрижелудочно в дозе 50–300 мг/кг: не было выявлено повреждений слизистой оболочки желудка ни после краткого, ни после 14-дневного курса [15]. При световой и электронной микроскопии сосуды на фоне АМГ оставались сохранными, в то время как на фоне других НПВС наблюдается адгезия лейкоцитов к эндотелию. Этот феномен расценивают как основу для снижения кровоснабжения слизистой оболочки и ее повреждения [15, 16]. Гастропротективный эффект AМГ удалось показать у крыс и с помощью измерения трансмукозальной разницы потенциалов, которая служит маркером состоятельности функции слизистой оболочки. В отличие от других НПВС АМГ, который вводили интрагастрально, не приводил к изменению разницы потенциалов. АМГ существенно «смягчал» повреждающий эффект этанола на слизистую оболочку экспериментальных животных.
Новые грани защитных свойств АМГ продолжают изучать в эксперименте. Анализ показателей перикисного окисления липидов привел авторов недавнего исследования к выводу, что АМГ проявляет свойства антиоксиданта и защищает слизистую оболочку желудка от воздействия индометацина и этанола, а слизистую оболочку толстой кишки от 2,4,6-тринитробензосульфоновой кислоты [17].
В метаанализ, посвященной переносимости АМГ по сравнению с другими НПВС, вошло 18 клинических исследований [11]. В них эффективность и безопасность АМГ сравнивали с диклофенаком, толметином, индометацином, напроксеном, пироксикамом и ибупрофеном в основном при остеоартрозе и ревматоидном артрите [18–20]. Во всех исследованиях частота побочных эффектов и случаи преждевременного прекращения терапии были ниже в группе АМГ по сравнению с другими НПВС. Отношение шансов побочных эффектов АМГ по сравнению с другими НПВС, оцененными вместе, составило 0,2 (95-процентный доверительный интервал 0,1–0,3). Частота и выраженность повреждений гастродуоденальной слизистой оболочки по эндоскопической оценке была также ниже в группе AMГ по сравнению с другими неселективными НПВС. Отношение шансов тяжелых эндоскопических изменений на фоне АМГ по сравнению с другими НПВС оказалось 0,3 (95-процентый доверительный интервал 0,1–0,7), а умеренных и тяжелых эндоскопических изменений 0,1 (95-процентный доверительный интервал 0,1–0,4) [11].
Принципиальное значение имеет исследование безопасности и эффективности АМГ у больных ревматоидым артритом в сравнении с целекоксибом [21]. В исследование было включено 235 больных, 180 пациентов завершили исследование (85 получали АМГ 600 мг 2 раза/сут и 95 целекоксиб 200 мг/сут в течение 24 недель). Эффективность терапии ревматоидного артрита была оценена по индексу Американской коллегии ревматологов — ACR-20. Оба лекарственных препарата показали одинаковую эффективность при ее оценке на 4-й, 12-й и 24-й неделе лечения. Для оценки безопасности применяли эзофагогастродуоденоскопию (ЭГДС), оценку симптомов со стороны желудочно-кишечного тракта, ЭКГ, клинические анализы крови и мочи, оценку побочных эффектов. При анализе данных ЭГДС не было выявлено разницы в группах, применявших АМГ или целекоксиб. При оценке гастроинтестинальных симптомов также не было получено статистически значимой разницы, хотя при анализе симптома диспепсии (боль и дискомфорт в эпигастрии) через 4 недели терапии она встречалась реже при приеме АМГ. ЭКГ, клинические анализы крови и мочи также не выявили разницы на фоне сравниваемых НПВС. Профиль побочных эффектов также не выявил разницы между сравниваемыми группами. Таким образом, была продемонстрирована одинаковая эффективность и безопасность (в том числе безопасность для желудочно-кишечного тракта) АМГ и селективного ингибитора ЦОГ-2 — целекоксиба [21].
Таким образом, АМГ представляет собой НПВС, повышающее синтез оксида азота в слизистой оболочке желудка. Это свойство обеспечивает его безопасность для гастродуоденальной слизистой оболочки. Таким образом, по безопасности АМГ существенно превосходит неселективные НПВС и не уступает селективным ингибиторам ЦОГ-2. Его противовоспалительная эффективность продемонстрирована в серии клинических исследований и эквивалентна другим представителям НПВС.
Статья предоставлена фармацевтической компанией «Д-р Редди’с» и публикуется при ее поддержке.
Литература
- Rainsford K. D. Anti-inflammatory drugs in the 21 st century // Subcell. Biochem. 2007. Vol. 42. P. 3–27.
- Rao P., Knaus E. E. Evolution of nonsteroidal anti-inflammatory drugs (NSAIDs): cyclooxygenase (COX) inhibition and beyond // J Pharm Pharm Sci. 2008; 11 (2): 81 s–110 s.
- Scarpignato C., Hunt R. H. Nonsteroidal antiinflammatory drug-related injury to the gastrointestinal tract: clinical picture, pathogenesis, and prevention // Gastroenterol. Clin. North. Am. 2010. Vol. 39. P. 433–464.
- Lanza F. L., Chan F., Quigley E. et al. Guidelines for Prevention of NSAID–Related Ulcer Complications // Am J Gastroenterol. 2009; 104: 728–738.
- Malfertheiner P., Megraud F., O’Morain C. et al. Management of Helicobacter pylori infection — the Maastricht IV/Florence Consensus Report // Gut. 2012. V. 61. P. 646–664.
- Rostom A., Muir K., Dube C. et al. Gastrointestinal safety of cyclooxygenase-2 inhibitors: a Cochrane Collaboration systematic review // Clin Gastroenterol Hepatol. 2007; 5 (7): 818–828, e1–5; quiz 768.
- Chen Y. F., Jobanputra P., Barton P. et al. Cyclooxygenase-2 selective non-steroidal antiinflammatory drugs (etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, valdecoxib and lumiracoxib) for osteoarthritis and rheumatoid arthritis: a systematic review and economic evaluation // Health Technol Assess. 2008; 12 (11): 1–278.
- Ивашкин В. Т., Драпкина О. М. Клиническое занчение оксида азота и белков теплового шока. М.: ГЭОТАР-Медиа, 2011. С. 376.
- Wallace J. L., Granger D. N. The cellular and molecular basis of gastric mucosal defense // FASEB J. 1996. 10: 731–740.
- Brzozowski T. et al. Role of prostaglandins in gastroprotection and gastric adaptation // J Physiol Pharmacol. 2005; 56 Suppl 5: 33–55.
- Marcolongo R., Frediani B., Biasi G. et al. A Meta-Analysis of the Tolerability of Amtolmetin Guacil, a Novel, Effective Nonsteroidal Anti-Inflammatory Drug, Compared with Established Agents // Clin. Drug Invest. 1999; 17 (2): 89–96.
- Tubaro E., Belogi L., Mezzadri C. M. The mechanism of action of amtolmetin guacyl, a new gastroprotective nonsteroidal anti-inflammatory drug // Eur. J. Pharmacol. 2000; 387: 233–244.
- Tubaro E., Belogi L., Mezzadri C. M., Ruco L., Stopacciaro A. Studies on the gastric tolerability of the new non-steroidal anti-inflammatory drug amtolmetin guacyl // Arzneimittelforschung. 1995; 45: 1298.
- Caruso A, Cutuli V. M., De Bernardis E., Attaguile G., Amico-Roxas M. Pharmacological properties and toxicology of MED-15, a prodrug of tolmetin // Drugs Exp Clin Res. 1992; 18: 481.
- Pisano C., Grandi D., Morini G. et al. Gastrosparing effect of the new antiinflammatory drug amtolmetin guacyl in the rat: involvement of nitric oxide // Dig Dis Sci. 1999; 44 (4): 713–724.
- Wallace J. L. Non-steroidal anti-inflammatory drug gastropathy and cytoprotection: pathogenesis and mechanisms re-examined // Scand J Gastroenterol. 1992; 27 (suppl 192): 3.
- Kirkova M., Kesiova M., Konstantinova S. et al. In vivo effects of amtolmetin guacyl on lipid peroxidation and antioxidant defence systems in different models of gastrointestinal injury // Autonomic & Autacoid Pharmacology. 2007;? 27: 63–70.
- Petazzi I., Corberi G., Bonollo L. et al. Clinical study of the therapeutic activity and tolerability of artromed in comparison with piroxicam in rheumatoid arthritic patients // Drugs Exp Clin Res. 1990; 16: 31–37.
- Petazzi I., Corberi G., Bonollo L. et al. Evaluation of the time course of the algic-inflammatory symptoms in patients with osteoarthritic afflictions during and after treatment with artromed or diclofenac // Drugs Exp Clin Res. 1990; 16: 7–12.
- Petazzi I., Corberi G., Bonollo L. et al. Clinical study of the therapeutic activity and tolerability of artromed in comparison with naproxen in patients with osteoarthritis in different localizations // Drugs Exp Clin Res. 1990; 16: 25–30.
- Jajic Z., Malaise M., Nekam K. et al. Gastrointestinal safety of amtolmetin guacyl in comparison with celecoxib in patients with rheumatoid arthritis // Clin. Experiment. Rheumatol. 2005; 23: 09–818.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru