Введение
Неалкогольная жировая болезнь печени (НАЖБП) является одним из самых распространенных заболеваний печени во всем мире и, по оценкам экспертов, встречается примерно у 25% взрослого населения [1]. В Российской Федерации среди лиц, обращающихся за амбулаторной помощью (исследование DIREG 2, 2015), распространенность НАЖБП составила 37,3% [2]. Высокая встречаемость НАЖБП в популяции тесно связана с увеличением числа лиц с избыточной массой тела и ожирением. Эпидемиологические данные демонстрируют, что НАЖБП выявляется у 70% лиц с избыточной массой тела и у 90% лиц с ожирением [3]. Установлено, что у пациентов с НАЖБП очень часто выявляются один или несколько компонентов метаболического синдрома, таких как дислипидемия, артериальная гипертензия, нарушения углеводного и пуринового обмена, поэтому НАЖБП рассматривается как печеночное проявление метаболического синдрома [4].
Неалкогольная жировая болезнь печени характеризуется избыточным (>5%) накоплением липидов в гепатоцитах при исключении вторичных причин, способствующих его развитию (употребление алкоголя, прием лекарственных препаратов, вирусный гепатит, целиакия и др.) [5]. Морфологически в течении заболевания можно выделить несколько стадий: стеатоз, стеатогепатит, фиброз с возможным прогрессированием до цирроза печени и гепатоцеллюлярной карциномы [6, 7]. Кроме того, у пациентов с НАЖБП повышен риск внепеченочных осложнений, включая сердечно-сосудистые заболевания, сахарный диабет 2 типа и злокачественные новообразования [8].
Содержание статьи
Современные представления о патогенезе НАЖБП
Патогенез НАЖБП давно уже вышел за пределы «теории двух ударов», в настоящее время очевидно, что развитие и прогрессирование заболевания связано с участием большого количества механизмов, которые могут быть реализованы последовательно или параллельно. Среди ключевых патогенетических звеньев НАЖБП рассматриваются феномены инсулинорезистентности и липотоксичности, системного воспаления, митохондриальная дисфункция, дисбаланс в системе адипокинов, повышение эпителиальной кишечной проницаемости и модуляция кишечной микробиоты [9–12]. В качестве нового и потенциально привлекательного с практической точки зрения фактора сегодня обсуждается роль гипераммониемии в течении НАЖБП.
Инсулинорезистентность и липотоксичность. Инсулинорезистентность и связанная с ней липотоксичность были описаны в числе первых среди всех известных на сегодняшний день патогенетических механизмов НАЖБП [13]. Хорошо известно, что в условиях метаболических нарушений изменение внутриклеточной передачи сигналов инсулина на периферии сопряжено с усилением липолиза, прежде всего, в адипоцитах висцеральной жировой ткани и с высвобождением большого пула свободных жирных кислот (СЖК), которые через воротную вену попадают сразу в печень и используются там для синтеза триглицеридов [14]. В свою очередь, метаболизм липидов в гепатоцитах регулируется комбинацией поглощения и экспорта СЖК, липогенеза de novo и утилизации жира путем β-окисления [15]. При смещении баланса между этими путями в сторону повышенного поступления липидов начинается их накопление в паренхиме органов с последующим развитием воспаления и прогрессирования до фиброза и цирроза печени.
Митохондриальная дисфункция. Известно, что на долю печени приходится порядка 15% потребления кислорода в организме человека, а гепатоциты богаты митохондриями, которые выполняют ключевую роль в процессах тканевого дыхания и обеспечения клеток энергией посредством синтеза АТФ [16]. В экспериментальной модели НАЖБП продемонстрировано снижение синтеза АТФ на внутренней мембране митохондрий, что, по-видимому, связано с тем, что в условиях метаболических нарушений митохондрии не способны окислять большое количество СЖК [17]. Дисфункция митохондрий ассоциирована с окислительным стрессом, что способствует выработке активных форм кислорода и запуску перекисного окисления липидов (ПОЛ) [18]. В свою очередь, под действием продуктов ПОЛ происходит активация иммунных клеток с последующим высвобождением пула провоспалительных цитокинов, инициация процесса фиброгенеза в звездчатых клетках [19, 20].
Адипокины. Немаловажную роль в развитии метаболических нарушений играет дисбаланс в системе адипокинов — биологически активных молекул, продуцируемых жировой тканью, основными из которых являются лептин и адипонектин [21]. Лептин регулирует потребление пищи, расход энергии, повышает чувствительность клеток к инсулину, прежде всего на уровне печени и скелетных мышц, регулирует функцию β-клеток поджелудочной железы [22, 23]. Однако при развитии гиперлептинемии и лептинорезистентности, что отмечено у больных НАЖБП, лептин способствует выработке таких провоспалительных цитокинов, как интерлейкин (ИЛ) 2 и интерферон γ, а также подавляет выработку противовоспалительного цитокина ИЛ-4 Т-клетками [24]. Напротив, экспрессия адипонектина в жировой ткани у людей с ожирением и НАЖБП значительно ниже, чем у худых людей, и связана с более высокой степенью инсулинорезистентности и продукцией фактора некроза опухоли α [25]. Результатом указанных изменений в системе адипокинов является прогрессирование стеатоза в стеатогепатит и активация звездчатых клеток.
Гипераммониемия. Синтез мочевины является исключительной функцией печени и единственным путем удаления токсичного аммиака из организма. Нарушенная активность ферментов на этапах синтеза мочевины при НАЖБП, вероятно, вызвана эпигенетическим повреждением генов и повышенным старением гепатоцитов. Результатом повреждения на любом этапе цикла мочевины оказывается накопление аммиака в ткани печени и крови, что было продемонстрировано как на животных моделях, так и у пациентов с НАЖБП. Проблема может усугубляться параллельными изменениями в системе глутамина/глутамата [26, 27]. Избыточное содержание аммиака в печени усиливает воспаление, способствует активации звездчатых клеток и запуску фиброгенеза, который на начальных этапах является частично обратимым процессом. При гипераммониемии отмечается большое количество негативных системных эффектов на другие органы (рис. 1), наиболее значимые — когнитивные нарушения и отрицательный баланс мышечного белка, что приводит к саркопении, дисфункции иммунной системы и повышенному риску рака печени [28].
![Рис. 1. Системные эффекты гипераммониемии при НАЖБП [28] Рис. 1. Системные эффекты гипераммониемии при НАЖБП [28]](https://medblog.su/wp-content/uploads/2025/01/Primenenie-L-ornitina-L-aspartata-u-patsientov-s-nealkogolnoj-zhirovoj-boleznyu-pecheni.png)
Генетические факторы. Ген, содержащий домен пататин-подобной фосфолипазы 3 (PNPLA3) и кодирующий синтез адипонутрина, был первым геном, идентифицированным с точки зрения риска развития стеатоза и прогрессирования НАЖБП до цирроза печени [29]. Ассоциация варианта нуклеотидной последовательности rs738409 (C > G) в гене PNPLA3 с НАЖБП была воспроизведена в целом ряде крупных геномных исследований GWAS [30, 31].
Еще одним геном, ассоциированным с риском развития НАЖБП, является ген, кодирующий синтез регуляторного белка глюкокиназы (GCKR), который участвует в контроле метаболизма глюкозы. Вариант нуклеотидной последовательности rs780094 (G > A) связан с повышенным содержанием липидов в печени [31]. GCK фосфорилирует глюкозу до глюкозо-6-фосфата, который преобразуется в гликоген для хранения в гепатоците. Однако избыток диетической глюкозы, который не может быть сохранен в виде гликогена, преобразуется в жир посредством синтеза триглицеридов de novo в печени [32].
Вместе с тем современные исследования демонстрируют важную роль воздействия факторов окружающей среды, в частности физической активности и диеты, в осуществлении эпигенетической модификации генов при НАЖБП с помощью различных механизмов: модификации гистонов, экспрессии микроРНК, метилирования ДНК [33]. И именно воздействие факторов внешней среды на реализацию генетической предрасположенности является актуальной темой для будущих исследований.
Современные подходы к терапии НАЖБП
В соответствии с действующими рекомендациями особое внимание при курации пациентов с НАЖБП следует уделять модификации образа жизни и нормализации массы тела, в частности за счет повышения физической активности, изменения привычек питания [6]. При этом эксперты подчеркивают, что изменение образа жизни, по-видимому, является наиболее важным и эффективным с точки зрения профилактики развития и прогрессирования НАЖБП [34]. Показано, что соблюдение средиземноморской диеты в течение 6 мес. ассоциировано со снижением количества интрагепатического жира и улучшением метаболических показателей у пациентов с НАЖБП [35]. Снижение массы тела у пациентов с НАЖБП также способствует восстановлению функции печени и повышению чувствительности к инсулину [36]. Интересно, что снижение массы тела на 7–10% оказывает благотворное влияние на пациентов с НАЖБП независимо от состава рациона [37]. Кроме того, поддержание достаточного уровня физической активности помогает сохранять мышечную массу и силу, обеспечивает профилактику развития саркопении, которая имеет негативное прогностическое значение у пациентов с НАЖБП, особенно у людей среднего и пожилого возраста [38].
С учетом широкой распространенности НАЖБП в популяции и рисков, с которыми ассоциировано прогрессирующее течение заболевания, поиск эффективных фармакологических средств является предметом активных исследований последних десятилетий. В отечественных клинических рекомендациях рассматривается целесообразность назначения различных лекарственных средств, направленных на коррекцию тех или иных патогенетических звеньев: нормализующих углеводный и липидный обмен, способствующих коррекции массы тела, антиоксидантов и гепатопротекторов [6].
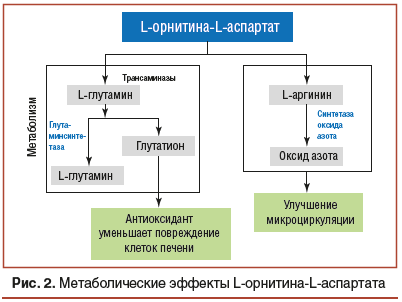
С учетом полученных данных о роли гипераммониемии в развитии и прогрессировании НАЖБП перспективным является включение в схемы терапии пациентов препарата L-орнитин-L-аспартат с доказанным гипоаммониемическим, дезинтоксикационным и гипоазотемическим эффектами. Кроме того, L-орнитин-L-аспартат обладает свойствами гепатопротектора за счет снижения уровня токсичного аммония (NH3) в плазме путем его включения в синтез мочевины и глутамина посредством активации карбамоилфосфатсинтетазы 1 L-орнитином и стимуляции аргиназы L-аспартатом [39].
В двойном слепом плацебо-контролируемом исследовании U. Staedt et al. [40] показано, что парентеральное введение L-орнитина-L-аспартата больным циррозом печени сопровождалось дозозависимым снижением уровня аммиака в плазме крови за счет увеличения скорости образования мочевины и повышения концентрации глутамата после постпрандиальной белковой нагрузки. В экспериментальном исследовании [41] назначение глутамина в течение 12 нед. приводило к ингибированию экспрессии ядерного фактора κB (NF-κB) и редукции гистологических стигм стеатогепатита. В подтверждение этому в работе [42] продемонстрировано, что гепатопротективные эффекты пероральных добавок глутамина на развитие НАЖБП, вызванной западной диетой, были связаны с защитой от ПОЛ и уменьшением выраженности воспалительных процессов в гепатоцитах.
Дополнительные эффекты L-орнитина-L-аспартата в виде улучшения микроциркуляции и синусоидальной перфузии посредством стимуляции синтеза вазоактивных медиаторов, таких как оксид азота и эндотелины, могут оказывать благоприятное влияние на процессы фиброгенеза в печеночной ткани (рис. 2). В целом ряде экспериментальных и клинических работ продемонстрировано, что улучшение микроциркуляции и перфузии гепатоцитов на фоне применения L-орнитина-L-аспартата опосредовано увеличением продукции L-аргинина — важного продукта для синтеза оксида азота [43–47]. Полученные результаты представляются основой многообещающей терапевтической стратегии в лечении НАЖБП.
Установлено также, что L-орнитин-L-аспартат обладает широким спектром эффектов, регулирующих энергетический обмен в клетках, в том числе экспрессию генов — регуляторов митохондриального биогенеза, включая восстановление деполяризованного потенциала и целостности митохондриальной мембраны, не вызывая при этом индукции продукции супероксида [48].
В многоцентровом рандомизированном клиническом исследовании, результаты которого опубликованы в 2019 г., показано, что пероральный прием L-орнитина-L-аспартата на протяжении 3 мес. статистически значимо приводит к снижению уровня аминотрансфераз и нормализации липидного спектра, а также к улучшению показателя соотношения плотность печени / плотность селезенки по данным компьютерной томографии [39]. Указанные эффекты зависели от дозы препарата и были максимально выражены в группе пациентов, получающих 9 г/сут L-орнитина-L-аспартата. В исследовании Е.В. Гараниной применение L-орнитина-L-аспартата в дозировке 9 г/сут на протяжении 8 нед. у больных НАЖБП было ассоциировано с нормализацией биохимических показателей (аланинаминотрансфераза, аспартатаминотрансфераза, γ-глутамилтранспептидаза, ферритин, С-реактивный белок, аммиак). У 69% участников уменьшилась степень стеатоза печени, а у 85% — улучшились показатели жесткости печени по данным эластометрии [49].
На российском фармацевтическом рынке представлен препарат L-орнитина-L-аспартата, зарегистрированный под торговым названием Гепа-Мерц. Он обладает широким спектром эффектов, которые позволяют с успехом использовать его в лечении заболеваний печени, осложненных гипераммониемией, и при стеатозах и стеатогепатитах различной этиологии независимо от уровня аммиака. Ключевым эффектом Гепа-Мерца, обусловливающим его гепатопротективное, противовоспалительное и антиоксидантное действие, является детоксикация аммиака путем синтеза мочевины и глутатиона. Имеющиеся данные позволяют рассматривать L-орнитин-L-аспартат (Гепа-Мерц) в качестве базового лекарственного средства для лечения больных с НАЖБП.
Заключение
Таким образом, НАЖБП является наиболее часто диагностируемой патологией в структуре хронических диффузных заболеваний печени у взрослых и представляет собой актуальную проблему в области внутренних болезней. НАЖБП тесно связана с метаболическими нарушениями. Возможность прогрессирования заболевания до цирроза печени и гепатоцеллюлярной карциномы, а также доказанный факт увеличения риска развития сердечно-сосудистых осложнений у пациентов ставят перед научным сообществом серьезную задачу по поиску эффективных фармакотерапевтических средств, обеспечивающих контроль над течением заболевания.
Не вызывает сомнения многофакторность патогенеза НАЖБП. Вместе с тем в последние десятилетия получены убедительные данные о роли гипераммониемии в развитии и прогрессировании воспалительных и фибротических процессов на фоне избыточного накопления липидов в печени. Поэтому потенциально перспективным и обоснованным с патогенетической точки зрения является включение в схему терапии пациентов с НАЖБП препаратов, влияющих на обезвреживание аммиака в организме, в частности L-орнитина-L-аспартата.
Информация с rmj.ru






