Содержание статьи
- 1 Введение
- 2 К вопросу о достоверности исследований
- 3 Профилактика привычного выкидыша
- 4 Прогестерон во время беременности
- 5 Протокол и клинические рекомендации по терапии угрозы прерывания беременности
- 6 Выводы
- 7 Профилактика преждевременных родов. Стратегии ведения
- 8 Тактика ведения пациенток при укорочении шейки матки
- 9 Выводы
- 10 Подбор дозы прогестерона. Рекомендации
Введение
В настоящее время известно множество предпосылок к угрозе выкидыша, к выкидышу, к привычному прерыванию беременности и к преждевременным родам. Потеря или досрочное прерывание беременности может быть обусловлено целым рядом причин, это: генетические поломки кариотипа родителей, эмбриона, эндокринные нарушения, пороки развития матки, истмико-цервикальная недостаточность, инфекционные факторы с персистенцией условно-патогенных микроорганизмов и/или вирусов, аутоиммунные нарушения, наследственные тромбофилии и др.
Сегодня имеется возможность пролонгировать беременность до доношенного срока. Мы способны дать плоду множество шансов для выживания, особенно после 22 нед., когда плод уже может адаптироваться и выжить, у нас для этого есть потенциал и все ресурсы. Поэтому, касаясь темы угрожающего и привычного выкидыша, обсудим многие моменты: возможности терапии угрозы прерывания беременности, профилактику привычного выкидыша, терапию преждевременных родов.
К вопросу о достоверности исследований
В настоящее время в медицинской литературе представлено большое количество данных по рассматриваемой теме, но всякий раз, обращаясь к результатам исследований, мы задаемся вопросом о степени их достоверности. Возможно, они содержат ложную информацию. Причем не имеет значения, где эти данные опубликованы, в научных журналах или на веб-сайтах. А вероятность, что нас привлекут именно альтернативные факты и недостоверные данные, довольно высока, и это может изменить наше мнение и сформировать неверную точку зрения на существующие вопросы. Некоторые исследователи публикуют единичные данные, методологически слабые исследования, результаты которых, скорее всего, будут недостоверными по причине некорректного протокола. Такие данные не подвергаются грамотной статистической обработке, что не позволяет руководствоваться ими в практической деятельности.
Таким образом, необходимость клинических исследований не подвергается сомнению, но они должны быть качественными, иначе можно прийти к неверным клиническим выводам. Ключевым вопросом является достоверность публикуемых данных.
Сегодня доказательная медицина — это система сбора, обобщения и анализа всех имеющихся знаний (гипотез, результатов исследований) о профилактике, диагностике и лечении заболеваний. Это наиболее полная и объективная картина современной медицины. Доказательная медицина — это концепция принятия врачебных и управленческих решений с учетом результатов качественных клинических исследований, клинического опыта и интересов пациента [1].
Символическая пирамида доказательной медицины — это иерархия доказательств (рис. 1) [2].
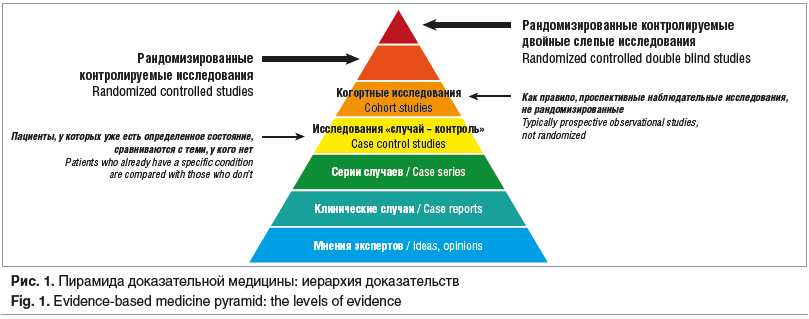
Структура пирамиды представлена несколькими ступенями. В самом низу находятся экспертные мнения и идеи одного человека. Сегодня, в эпоху доказательной медицины, одно мнение ничего не значит. На следующих ступенях располагаются отдельные клинические случаи и серии клинических случев, далее — когортные исследования и рандомизированные контролируемые исследования. Вершину пирамиды венчают двойные слепые рандомизированные плацебо-контролируемые исследования и систематические обзоры и метаанализы, которые публикуются на основании предыдущих исследований. Качество доказательств растет с увеличением ступеней пирамиды.
Согласно данным, полученным в исследованиях, формируются уровни доказательности. Таким образом, чем выше уровень исследований, тем достовернее их результаты. Однако выводы, вытекающие из метаанализов, зависят от качества анализируемых исследований. Положительным примером может служить публикация R. Romero et al. [3], представляющая собой метаанализ клинических наблюдений по использованию вагинальной формы прогестерона для профилактики преждевременных родов и неблагоприятных перинатальных исходов при одноплодной беременности и короткой шейке матки. Данная работа является обзором пяти больших исследований, включивших 1016 пациенток. Авторы провели скрининг тысяч публикаций по нескольким критериям и только пять публикаций соответствовали необходимым критериям качества. Их результаты и были затем проанализированы. Другая ситуация с метаанализами по вопросам угрожащего выкидыша. Например, в одном из недавних метаанализов основной ряд исследований был довольно беден по своей методологии, исследования не были слепыми для участников, был неясен метод рандомизации. Слабый дизайн исследования, в свою очередь, лишает его надежных выводов. Очевидно, что данные этих исследований недостаточно корректны и высока вероятность их неправильной оценки (рис. 2) [4].

Таким образом, глядя на рисунок 2, можно сказать, что сравнивать данные в этих исследованиях, это как сравнивать яблоки с грушами: и те и другие — фрукты, но фрукты совершенно разные.
Например, в одном исследовании, Gerhard (1987), женщинам в основной группе назначался прогестерон в дозе 25 мг дважды в день, пациенткам контрольной группы предписывался постельный режим. В другом исследовании, Palagiano (2004), применялся прогестерон (Крайнон 8%) в дозировке 90 мг один раз в день, в контрольной группе пациентки получали плацебо. При этом длительность первого исследования составляла несколько недель, а второго — 5 дней. Сравнивать эти исследования и делать по ним какие-либо выводы невозможно, так как априори они будут ошибочными. Мы сравниваем яблоки и груши. Это не наука, это лженаука [5].
В процессе нашей работы было оценено еще одно исследование 2019 г. Это большой метаанализ исследований эффективности прогестерона у женщин с привычным невынашиванием беременности (ПНБ) неясной этиологии, применяемого для профилактики репродуктивных потерь. В данную работу вошли 10 исследований (1684 пациентки), которые получали препараты прогестерона перорально или вагинально. Группы в исследованиях были сопоставимы по данным анамнеза и путям введения препарата. Исследование можно охарактеризовать как более качественное, и по нему могут быть сформулированы правильные выводы [6]. Данный метаанализ показал, что эффективность препарата не зависит от пути введения.
Профилактика привычного выкидыша
Cамопроизвольный выкидыш — это прерывание беременности в сроке до 22 нед. [7]. Доказано, что одна из пяти женщин, которые столкнулись с проблемой самопроизвольного выкидыша, имеет высокий уровень тревожности, подобный тому, который можно наблюдать у пациенток с психиатрической патологией. К сожалению, одна из четырех беременностей заканчивается самопроизвольным прерыванием. К несчастью, одна из трех женщин, у которых случались репродуктивные потери, имеет клиническую депрессию.
Риск выкидыша у женщин с неблагоприятным акушерско-гинекологическим репродуктивным анамнезом был оценен в метаанализе, проведенном по ряду исследований [8–10]. Оценивали количество выкидышей в анамнезе и частоту выкидышей, которая нарастает с увеличением числа репродуктивных потерь от 11,3% при отсутствии выкидышей в анамнезе до 63,9% при наличии неблагоприятного анамнеза по потерям беременности. В отдельно взятых исследованиях цифры были схожи.
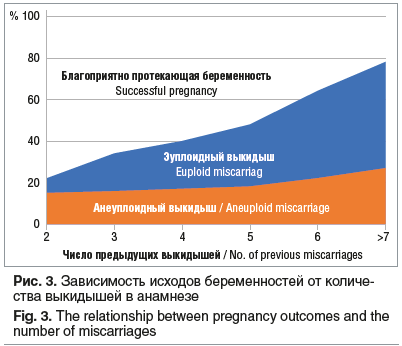
Еще одно исследование касалось генетического фактора невынашивания: оценивали кариотип эмбриона (хромосомные аномалии) по отношению к числу предыдущих выкидышей в структуре репродуктивных потерь [11]. На рисунке 3 показано соотношение благоприятно завершенных беременностей, эуплоидных выкидышей и анеуплоидных выкидышей и количества предыдущих выкидышей в анамнезе. Мы видим, что генетический фактор является основной причиной потерь при первых беременностях, но при возрастании количества потерь беременностей в анамнезе все большее количество выкидышей обусловлены другими, негенетическими причинами. Основным фактором невынашивания в этих случаях можно назвать плацентарный сосудистый фактор.
Прогестерон во время беременности
Хорошо известно, что прогестерон играет важную роль во время беременности. Он необходим для ее благоприятного течения, стимулирует рост матки и дифференцировку эндометрия, ингибирует маточные сокращения. Низкие уровни прогестерона ассоциированы с угрозой прерывания беременности и спонтанным выкидышем [12]. Сывороточные уровни прогестерона растут с увеличением срока беременности.
Как же работает прогестерон? Мы изучаем этот вопрос почти 20 лет. Биоидентичный прогестерон обладает уникальными фармакодинамическими свойствами, обеспечивающими поддержание беременности [13–21]. Его уникальным свойством является модулирование материнского иммунного ответа. Кроме того, он улучшает маточно-плацентарный кровоток, снижает тонус матки, являясь антагонистом окситоцина, ингибирует синтез простагландинов, способствует секреторной трансформации и децидуализации эндометрия, вызывая вазодилатацию и развитие экстравазатов трофобласта при его инвазии в материнскую оболочку, ремоделируя локальную сосудистую сеть.
Изучению роли прогестерона был посвящен ряд исследований [22, 23]. Одно из когортных исследований касалось определения прогестерона в крови для оценки исхода беременности у женщин с болями и кровяными выделениями. Другая работа была посвящена вопросу: действительно ли профилактическое назначение прогестерона в I триместре беременности повышает благоприятный исход у женщин с неясным генезом ПНБ? Метаанализ клинических испытаний прогестерона/прогестагенов у пациенток с ПНБ показал неоспоримую пользу прогестерона, которая была доказана.
Однако у ранее полученных данных были недостатки: качество ряда исследований было плохим, количество пациенток, принимавших участие в исследовании, — небольшим. Кроме того, применялись широкие доверительные интервалы, отсутствовал стандартизированный протокол, допускались погрешности в стратификации по возрасту и репродуктивному анамнезу женщин, использовались различные несопоставимые схемы приема препаратов прогестерона/прогестагенов. Проводя анализ, всегда помним про яблоки и груши! Таким образом, про эти исследования можно забыть.
В последние годы очень интересное и большое исследование было выполнено группой английских ученых в г. Бирмингеме. В протокол исследования PROMISE были включены женщины с ПНБ неясного генеза (основная группа, n=790), которые пытались забеременеть естественным путем. Им был назначен прогестерон в дозе 400 мг вагинально дважды в день в период с 4-й по 12-ю неделю. Женщины в группе сравнения получали плацебо. В результате исследования были получены данные по живорождению в сроках более 24 нед. С учетом того, что количество предыдущих выкидышей в основной группе варьировало от трех до шести, статистические расчеты показали, что у пациенток, принимавших прогестерон, доля живорождений после 24 нед. начиналась от 67,9% при наличии трех выкидышей в анамнезе и от 57,4% при шести выкидышах. Тенденция к увеличению положительных исходов в группе прогестерона возрастала с увеличением числа выкидышей в анамнезе. То есть чем больше количество выкидышей в анамнезе, тем более оправдано и назначение прогестерона, так как его применение повышает шанс благоприятного исхода беременности на 7,4% [23, 24].
В пользу микронизированного прогестерона говорит еще один систематический обзор и метаанализ, включающий 82 статьи (26 726 пациенток) [25]. Установлено, что на благоприятный исход беременности повлияло назначение прогестерона с первого дня после получения ооцитов в программах ВРТ. Этим обоснована оптимальность назначения прогестерона на прегравидарном этапе, что является клиническим выводом в данной работе.
Итак, когда же начинать терапию при привычном невынашивании? Гипотеза состоит в том, что прием препаратов прогестерона у женщин с ПНБ оптимально начинать с лютеиновой фазы на прегравидарном этапе, когда есть возможность повлиять на процессы имплантации. Это было с блеском подтверждено в двух рандомизированных исследованиях, опубликованных в декабре 2016 г. и в апреле 2017 г. [26, 27]. Результаты отмеченных исследований были включены в последние клинические рекомендации ESHRE (European Society of Human Reproduction and Embryology) за 2017 г. [28].
Возникает вопрос: почему так важен прогестерон? В исследовании [29] проводилась гистологическая оценка состояния эндометрия. Пациенткам выполняли биопсию эндометрия на 9–11-й день цикла после пика уровня лютеинизирующего гормона. Окраску проводили гематоксилином и эозином. У ряда пациенток выявлялись аномальные изменения эндометрия. Им назначали терапию вагинальной формой микронизированного прогестерона в дозе 200–400 мг/сут во вторую фазу менструального цикла. Повторная гистологическая оценка состояния эндометрия проводилась через месяц. На фоне терапии наблюдалась нормализация циклической трансформации эндометрия и его гистологической структуры.
Следующее исследование также подтверждает, что начало терапии прогестероном в лютеиновую фазу у женщин с ПНБ необходимо для благоприятного исхода последующей беременности [26]. Так, в подгруппах женщин, получавших вагинальную форму микронизированного прогестерона, благоприятных исходов беременности было достоверно больше: 86 из 126 против 19 из 37 в группе плацебо.
Таким образом, прогестерон важен именно во время имплантации эмбриона, он оказывает благоприятный эффект и положительное действие препарата может быть наиболее полно реализовано при его назначении именно в лютеиновую фазу еще до получения положительного теста на беременность.
Протокол и клинические рекомендации по терапии угрозы прерывания беременности
К врачам-клиницистам часто обращаются пациентки с жалобами на тянущие боли в низу живота и кровяные выделения из половых путей. Как мы можем им помочь? Был проведен метаанализ семи исследований, включивших в целом 744 женщины. Эти исследования были небольшими и не имели хорошего дизайна, но в целом показали благоприяное действие прогестинов в сравнении с плацебо.
В еще один метаанализ, проведенный совсем недавно, включены работы последних десятилетий [30]. Оценка в целом показала, что клинические эффекты прогестерона статистически значимы. В данном случае исследования были длительными и (помним о пирамиде доказательной медицины!) могут расцениваться как достоверные.
Вопрос лекарственной безопасности: какая разница между прогестероном и прогестагенами? Что касается прогестерона, то существует большое количество качественных исследований, проведенных с микронизированным прогестероном, в отношении прогестагенов информации намного меньше. Вагинальный прогестерон, который применяли пациентки, показал свою высокую эффективность и лекарственную безопасность. Сравнивая данные малых исследований с небольшой выборкой и данные крупных исследований, таких как PRISM, видим, что ни в одном из них не было указаний на отрицательные и побочные эффекты прогестерона, превосходящие такие показатели в группе плацебо. В отношении развития врожденных патологий и прерывания беременности на фоне приема препаратов прогестерона можно отметить, что неблагоприятные исходы для плода никак не зависели от того, на каком сроке пациентка начинала терапию и до какого срока она ее применяла — до 16 нед. или до 22 нед. В исследованиях безопасности прогестерона принимали участие более 5000 женщин, и не было выявлено отрицательного влияния препарата на плод на сроках от 4–6 нед. до 36 нед. по сравнению с плацебо [31].
Данные по дидрогестерону: в статье «Взаимосвязь между пероральным применением дидрогестерона во время беременности на ранних сроках и развитием врожденных пороков сердца», опубликованной в журналах Pediatric Cardiology в 2015 г. и Lancet в 2017 г., было показано, что у женщин, применявших дидрогестерон во время беременности, достоверно чаще, чем у женщин, не применявших этот препарат, рождались дети с пороками сердца (скорректированное отношение шансов 2,71; 95% ДИ 1,54–4,24; p<0,001) [31, 32]. Еще одно исследование [33] подтвердило этот вывод и показало, что при приеме во время беременности дидрогестерона достоверно чаще регистрировались не только пороки сердца (врожденная аортальная недостаточность и мальформации сердца), но и гипоспадия, расщелина позвоночника (spina bifida) и гидроцефалия (p<0,05). Авторы исследования сделали вывод, что на основании имеющихся совокупных данных можно утверждать, что применение дидрогестерона в период беременности ассоциируется с достоверно более высоким риском развития специфических врожденных мальформаций у плода, включающих прежде всего тяжелые дефекты развития сердечно-сосудистой системы. Несмотря на то что в двух ранее проведенных рандомизированных контролируемых исследованиях указано на отсутствие различий в частоте развития врожденных аномалий в случае приема дидрогестерона по сравнению с натуральным прогестероном, экспертная группа GDG считает эти данные недостаточными для однозначного утверждения и указывает на отсутствие долгосрочных исследований влияния дидрогестерона на здоровье потомства [34].
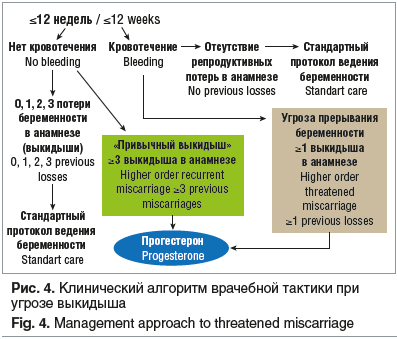
Возвращаясь к клинической практике, обратимся к клиническому протоколу [35] по ведению пациенток с клиническими проявлениями спонтанного выкидыша. На рисунке 4 представлен клинический алгоритм врачебной тактики при угрозе выкидыша. Алгоритм разработан Национальным институтом здоровья и клинического совершенствования (National Institute for Health and Care Excellence, NICE) Великобритании на основании проведенных исследований и рекомендован к применению в ежедневной практике акушеров-гинекологов в амбулаторных и стационарных условиях.
Выводы
Роль прогестерона в физиологии беременной женщины — ключевая с момента зачатия и до родов.
Выраженное биологическое действие экзогенного прогестерона поддерживает организм женщины, обеспечивая профилактику повторного выкидыша.
Вопросы оптимальной дозы, путей введения и продолжительности приема остаются предметом обсуждения.
Вагинальные капсулы микронизированного прогестерона теперь имеют уровень доказательности 1 ввиду отсутствия побочных эффектов на плод и его здоровье, наличия экономической эффективности и положительных стоимостных характеристик.
Профилактика преждевременных родов. Стратегии ведения
Мы можем делать многое для профилактики преждевременных родов (ПР). В разных странах тактика ведения и стратегии различаются, потому что причин ПР много и в разных регионах преобладают свои этиологические факторы, которые будут доминировать и вызывать осложнения, ассоциированные с беременностью. Стратегии профилактики ПР складываются в зависимости от факторов риска: анамнеза ПР, многоплодной беременности, укорочения шейки матки по данным ультразвукового исследования. Возникают вопросы: какие у нас есть инструменты для профилактики ПР, какая тактика? В настоящее время мы назначаем прогестерон, можем выполнить серкляж или установить пессарий. Главное: корректно определить показания к тому или иному методу лечения конкретно для каждой пациентки.
Обратимся к данным клинических исследований с участием женщин с ПР в анамнезе. Исследование J.M. Dodd et al. [36] включало оценку 8523 женщин с анамнезом ПР, получавших прогестерон или плацебо. Также оценивали 12 515 рожденных детей. Данная работа базировалась на 36 исследованиях. Было показано отсутствие принципиального значимого влияния схемы приема препарата, способа его введения, длительности терапии и дозы прогестерона на исходы беременности.
В исследовании A. Abdelaziz et al. [37] показано, что прогестерон обладает максимальной эффективностью именно при вагинальном способе введении по сравнению с внутримышечным, при том что и побочных эффектов в первом случае меньше.
Обратимся к недавнему мультицентровому интернациональному рандомизированному двойному слепому исследованию по оценке эффективности 17-ОПК у пациенток с привычной потерей одноплодной беременности [38]. Исследование длилось 12 лет, при этом не было достоверно показано значимой эффективности этой формы прогестерона, хотя в показаниях к применению этого препарата значится профилактика ПР. Более того, хочется отметить, что внутримышечная терапия 17-ОПК одобрена FDA у женщин с анамнезом спонтанного выкидыша при одноплодной беременности. Между тем внутримышечное введение сопровождалось болью (более чем у 30% пациенток), местными реакциями (припухлость, уплотнение в месте инъекций). Кроме того, это довольно дорогой метод лечения и экономически невыгодный для страховых компаний, а сама терапия в 3 раза повышает риск развития гестационного сахарного диабета [39–42].
Тактика ведения пациенток при укорочении шейки матки
В связи с тем, что этиологических факторов развития данного состояния довольно много, трудно поверить, что один препарат будет высокоэффективен при данной патологии. Безусловно, у ряда пациенток с короткой шейкой матки будет применяться циркляж или пессарий на начальных сроках беременности. Однако в целом укорочение шейки матки мы можем лечить с помощью препарата микронизированного прогестерона, и достаточно успешно. Mетаанализ, проведенный R. Romero et al. [3], показал, что назначение вагинальной формы прогестерона при одноплодной беременности и наличии ультразвуковых характеристик укорочения шейки матки во второй половине беременности снижает риск ПР в сроке менее 33 нед. и улучшает неонатальные исходы без каких-либо явных нарушений и патологий развития плода. Эффект вагинальной формы прогестерона оценивали также в плане неблагоприятных перинатальных и неврологических исходов. Было показано, что терапия вагинальной формой микронизированного прогестерона снижает риск респираторного дистресс-синдрома плода, являющегося основным заболеванием и причиной смертности детей, рожденных с массой от 1500 до 2500 г. Неонатальная смертность
составляла 1,4% на фоне применения прогестерона против 3,2% в группе плацебо.
Возвращаясь к сравнительному анализу микронизированного прогестерона с 17-ОПК для внутримышечного введения, авторы исследования отмечают, что еженедельные инъекции 17-ОПК не снижают частоту ПР у женщин с укорочением шейки матки (менее 30 мм) и поэтому не должны быть использованы с этой целью и по этим показаниям.
Эффективность акушерских пессариев
при укорочении шейки матки
Группа испанских ученых оценила эффективность акушерских пессариев у женщин с короткой шейкой матки [43]. Акушерский пессарий показал обнадеживающие результаты в отношении профилактики ПР при назначении по результатам ультразвукового скрининга длины шейки матки в середине беременности.
Увы, в дальнейшем исследователи были разочарованы, так как в большей выборке данный эффект повторить не удалось и результаты были противоположными: в группе пациенток с одноплодной беременностью и короткой шейкой матки на 20–24-й неделе установка пессария не снижала частоту ПР и показатели перинатальной заболеваемости и смертности соответственно. Также из неблагоприятных эффектов акушерского пессария было отмечено повышение частоты влагалищных выделений у пациенток основной группы (86,7%) по сравнению с контрольной группой (46%) [44]. (Последние европейские рекомендации по установке акушерского пессария и тактике ведения пациенток с пессарием во время беременности написаны под руководством G.C. Di Renzo [45].)
Обратимся к систематическому обзору (выполнен группой канадских ученых) работ по применению различных форм прогестерона (вагинального, перорального, внутримышечного), использованию пессариев для профилактики ПР в группе риска — у пациенток с одноплодной беременностью [46]. Только вагинальная форма прогестерона показала свою эффективность для профилактики и предотвращения ПР у женщин с одноплодной беременностью, имевших в анамнезе ПР. В целом отмечено снижение рисков ПР у женщин с укорочением шейки матки менее 25 мм и анамнезом ПР при приеме вагинальной формы прогестерона.
А как же женщины с двойней? R. Romero et al. [47] в метаанализе оценивали применение вагинальной формы прогестерона у женщин с двойней. Заключение таково, что назначение вагинальной формы прогестерона при отсутствии клинической симптоматики у женщин с двойней и ультразвуковыми данными укорочения шейки матки в II триместре снижает риски ПР на сроках 30–35 нед. беременности, неонатальную смертность и некоторые показатели неонатальной заболеваемости, а также демонстрирует отсутствие неблагоприятного влияния на показатели здоровья ребенка.
Вопросу установки акушерских пессариев у женщин с двойней и укорочением шейки матки было посвящено мультицентровое исследование, проведенное группой испанских ученых [48]. Показана некоторая эффективность пессария при двойне, но доказательства в целом недостоверны.
В заключение стоит подумать о перспективах и применении на практике вышеизложенной информации. Совместно с русской группой исследователей нами опубликованы результаты комбинированного лечения предлежания плаценты у пациенток с высоким риском преждевременных родов [49]. Рандомизированное контролируемое исследование включало 217 пациенток с предлежанием плаценты, из которых 81 пациентке был назначен прогестерон и установлен пессарий Dr. Arabin, 136 получали только прогестерон. Миграцию плаценты отслеживали по результатам допплеровского исследования на сроках после 24 нед. Получены следующие результаты:
Пациентки с пессарием Dr. Arabin на фоне приема прогестерона имели троекратное снижение частоты кровотечений во время беременности (11,3%) по сравнению с контрольной группой (33,1%).
Миграция плаценты выявлялась в 1,8 раза чаще в группе женщин с пессарием (48,1%), чем в контрольной группе (26,4%).
ПР в сроке до 34 нед. случались в 2,7 раза реже в группе женщин с пессарием, чем у женщин контрольной группы.
Применение пессария Dr. Arabin способствовало открытию угла матки кпереди на 7,4°, что сопровождалось снижением индекса резистентности в дугообразных артериях на сроке 32–33 нед. в сравнении с контрольной группой.
Выводы
Назначение микронизированного прогестерона в лютеиновую фазу менструального цикла женщинам с анамнезом репродуктивных потерь будет благоприятно сказываться на планировании последующей беременности.
Микронизированный прогестерон имеет положительное влияние при угрозе прерывания беременности и анамнезе спонтанного выкидыша.
При выявлении укорочения шейки матки на любом сроке беременности будет правильно назначить микронизированный прогестерон в качестве терапии для снижения риска ПР и улучшения перинатальных исходов.
Пациенткам с анамнезом ПР рекомендуется лекарственная поддержка препаратом микронизированного прогестерона.
Женщинам с двойней и укорочением шейки матки должен быть рекомендован микронизированный прогестерон для снижения риска ПР и улучшения неонатальных исходов.
Остается важный вопрос: в какие сроки должна быть начата терапия микронизированным прогестероном, чтобы получить наиболее благоприятный результат в случае угрожающего выкидыша? Согласно данным крупного исследования PRISM в среднем 6–9 нед. беременности —
оптимальный срок для начала терапии. Это рекомендации для женщин вне зависимости от указания в анамнезе на репродуктивные потери.
Подбор дозы прогестерона. Рекомендации
Прогестерон в дозе 800 мг/сут в настоящее время рекомендован беременным женщинам с анамнезом репродуктивных потерь в I триместре беременности и с жалобами на кровяные выделения с момента их появления до 16–20 нед.
Кровяные выделения из половых путей в I триместре беременности при наличии в анамнезе двух и более выкидышей считаются фактором риска ПР. При наличии угрозы прерывания беременности разумно продолжить прием вагинальной формы прогестерона в дозе 200 мг/сут до 36 нед.
У пациенток с ПНБ назначение вагинальной формы микронизированного прогестерона рекомендуется на прегравидарном этапе во вторую фазу менструального цикла за 2–3 мес. до оплодотворения с продолжением во время беременности в дозе 800 мг/сут до 16–20 нед. гестации.
При наличии ультразвуковых критериев укорочения шейки матки при одноплодной беременности или у женщин с двойней рекомендуется назначение вагинальной формы прогестерона в дозе 200 мг/сут до 36 нед.
Таким образом, в заключение нужно отметить: никогда не сравнивайте яблоки и груши. Целесообразно применение в клинической практике микронизированного прогестерона, он подтверждает свою эффективность и безопасность с 1990-х годов. И сегодня мы знаем, как помочь разным категориям пациенток с проблемой невынашивания беременности.
Сведения об авторах:
Ди Ренцо Дж.К. — д.м.н., профессор Университета Перуджи; 06123, Италия, Перуджа, Университетская пл., д. 1; ORCID iD 0000-0003-4467-240X.
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Маркова Элеонора Александровна — к.м.н., ассистент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-9491-9303.
Контактная информация: Маркова Элеонора Александровна, e-mail: markova.eleonora@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 20.08.2020, поступила после рецензирования 14.09.2020, принята в печать 07.10.2020.
About the authors:
Gian Carlo Di Renzo — MD, PhD, FRCOG (hon) FACOG (hon) FICOG (hon) Past General Secretary of FIGO University of Perugia; 1, piazza Universitá, Perugia, 06123, Italy; ORCID iD 0000-0003-4467-240X.
Yuliya E. Dobrokhotova — Doct. of Sci. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-7830-2290.
Eleonora A. Markova — Cand. of Sci. (Med.), assistant of the Department of Obstetrics & Gynecology of Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-9491-9303.
Contact information: Eleonora A. Markova, e-mail: markova.eleonora@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 20.08.2020, revised 14.09.2020, accepted 07.10.2020.
.
Информация с rmj.ru





