Цель исследования: установить уровень эффективности комплексной терапии при подготовке к беременности женщин, больных РВВК, которая включает системный антимикотический препарат в сочетании с иммуномодулирующим препаратом Галавит®.
Материал и методы: проведено сравнительное исследование результатов лечения 113 женщин, больных РВВК, у которых после окончания курса предложенной терапии в течение 6 мес. произошло оплодотворение с рождением ребенка: в I группе (n=56) был назначен итраконазол; во II группе (n=57) — итраконазол + иммуномодулирующая терапия препаратом аминодигидрофталазиндиона натрия (Галавит®). Диагностика инфицированности различными видами Candida spp. проводилась путем прямой микроскопии, посева с выделением чистой культуры и окончательной идентификации возбудителя.
Результаты исследования: установлено, что комплексная терапия РВВК с применением одновременно системного антимикотика (итраконазол) и иммуномодулятора (Галавит®) (II группа) выше на 21,8±4,1% по клинической и на 12,6±3,5% по микробиологической эффективности по сравнению с применением только антимикотика (I группа). Во время беременности в I группе обострения РВВК наблюдались у 81,7% женщин, а во II группе — только у 28,3%. Наличие ультразвуковых маркеров внутриутробной инфекции выявлено у 56,7% беременных I группы и у 18,3% — II группы. Осложненные роды с преждевременным излитием околоплодных вод, аномалиями родовой деятельности в I группе зарегистрированы в 43,3% случаев, во II группе — в 28,3%. Наличие признаков реализации внутриутробной инфекции отмечено у 31,7% новорожденных в I группе и у 13,3% — во II группе.
Ключевые слова: рецидивирующий вульвовагинальный кандидоз, антимикотики, иммунотропная терапия, преконцепционная подготовка, Галавит®.
Для цитирования: Боровиков И.О., Аветисян А.С. Преконцепционная подготовка больных рецидивирующим вульвовагинальным кандидозом с использованием иммуномодулирующей терапии // РМЖ. Мать и дитя. 2018. №1. С. 4-10
Preconception preparation of patients with reccurent vulvovaginal candidiasis with the use of immunomodulation therapy
I.O. Borovikov, A.S. Avetisian
Kuban state medical university, Krasnodar, Russian Federation
The article considers the experience of preconception preparation of patients with recurrent vulvovaginal candidiasis (RVVC). The paper describes clinical features of recurrent forms of candidiasis in women and the variant of treatment of this pathology in women planning pregnancy with a combination of systemic antimitotic and immunomodulating therapy with the assessment of the clinical and microbiological efficacy.
Aim: assesssment of the efficacy of complex therapy with the use of a combination of systemic antimitotics and immunotropic medication Galavit® in preparation for pregnancy of women affected by recurrent vulvovaginal candidiasis.
Patients and Methods: a comparative study was conducted including the results of treatment of 113 women affected by RVVC with pregnancy started within 6 months after the therapy and ended with the birth of a child: Group I (n=56) — Itraconazole; Group II (n=57) — Itraconazole + immunomodulation therapy with aminodihydrophthalasindione sodium (Galavit®). Diagnosis of infecting with Candida spp. was carried out by direct microscopy, seeding with the isolation of pure culture and the final identification of the pathogen.
Results: it is established, that complex use of systemic antimitotic (itraconazole) and immunomodulator (Galavit) in the therapy of RVVC has 21,8±4,1% higher clinical and 12,6±3,5% higher microbiological efficacy. In 81.7% of women in Group I vulvovaginal candidiasis worsened during pregnancy, while in Group II, where a combination of Galavit® and antimycotic was used for pregravid preparation, only 28.3% of pregnant women had an exacerbation of VVC. The presence of ultrasound markers of intrauterine infection was detected in 56.7% of the pregnant women in Group I and in 18.3% in the Group II. Complicated births with premature discharge of amniotic fluid, abnormalities of labor in Group I were registered in 43.3% of cases, in group II — in 28.3%. The presence of signs of intrauterine infection was observed in 31.7% of the newborns in Group I and in 13.3% of newborns in Group II.
Key words: recurrent vulvovaginal candidiasis, antimitotic, immunotrops therapy, preconception preparation, Galavit®.
For citation: Borovikov I.O., Avetisian A.S. Preconception preparation of patients with reccurent vulvovaginal candidiasis with the use of immunomodulation therapy. Russian journal of Woman and Child Health. 2018;1(1):4–10.
В статье рассмотрен опыт преконцепционной подготовки пациенток с рецидивирующим вульвовагинальным кандидозом. Представлены клинические особенности рецидивирующих форм кандидоза у женщин, и предложен вариант лечения.
Содержание статьи
Введение
В настоящее время имеется тенденция к смене структуры заболеваний урогенитальной зоны: начинают превалировать заболевания, вызванные микроорганизмами, патогенные потенции которых ранее мало учитывались [1–3]. В первую очередь это касается бактериального вагиноза и вульвовагинального кандидоза (ВВК), удельный вес которых среди всех инфекций урогенитального тракта у женщин составляет 20–70% [2, 4, 5] и продолжает расти [3, 6–8]. Особую опасность представляет инфекция, вызываемая грибами рода Candida во время гестации [9, 10]. В результате инфицирования женщин, готовящихся к беременности и рождению ребенка, отмечаются невынашивание, преждевременный разрыв плодных оболочек, внутриутробное инфицирование плода [9–12]. Механизмы иммунологической защиты при ВВК, несмотря на большое количество исследований, изучены не в полной мере [13–15]. Считается, что рецидивирование ВВК связано с вторичным иммунодефицитом, сопровождающимся изменением гуморального и клеточного иммунитета [14, 16]. Несмотря на широкий спектр антимикотиков, в настоящее время эффективное лечение кандидозов остается сложным вопросом (из-за быстрого развития резистентности). Добавление в комплекс терапии при рецидивирующем ВВК (РВВК) иммуномодуляторов повышает ее эффективность, но не решает проблемы радикально, что в первую очередь объясняется отсутствием знаний о механизмах направленного воздействия иммунопрепаратов, с их зачастую чисто эмпирическим подбором [14–16].
При немалом разнообразии препаратов с иммуномодулирующим эффектом пристального внимания заслуживает российский препарат Галавит® (ООО «Сэлвим»), действующий направленно на клеточные и опосредованно на гуморальные звенья иммунитета, а также обладающий противовоспалительным, антиоксидантным и регенераторным действием [17–19]. Основным его действующим компонентом является аминодигидрофталазиндион натрия (5-амино-1,2,3,4-тетрагидрофталазин-1,4-диона натриевая соль), изменяющий функциональную активность макрофагов [17]. Особое значение данный препарат имеет при хронических воспалительных заболеваниях, сопровождающихся вторичной иммунодефицитной недостаточностью [17–19]. Особенностью Галавита является его избирательное воздействие на фагоцитарные клетки с модуляцией их функционально-метаболической активности [17]. Галавит®, корректируя иммунную защиту, способствует более эффективной элиминации возбудителя, снижению тяжести и длительности заболевания, а также частоты рецидивирования.
Цель исследования: оценка клинико-микробиологической эффективности комплексной терапии при подготовке к беременности женщин, больных РВВК, системным антимикотическим средством в сочетании с иммуномодулирующим препаратом Галавит®.
Материал и методы
Исследования проводились на кафедре акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России, в женских консультациях г. Краснодара (с сентября 2015 г. по сентябрь 2017 г.). Обследование женщин проводилось согласно приказу Минздрава России № 572н от 12.11.2012. Наблюдались и были обследованы 120 женщин в возрасте от 20 до 35 лет (средний возраст 27,1±4,2 года) с РВВК, у которых после окончания курса терапии в течение 6 мес. произошло оплодотворение с последующим успешным вынашиванием плода и рождением ребенка (сравнительное открытое рандомизированное исследование). Диагноз РВВК устанавливался на основании анамнестического и клинико-микробиологического обследования. Диагностика инфицированности Candida spp. проводилась методами прямой микроскопии, культуральным методом с идентификацией возбудителя (на автоматизированной системе «API20CAux», Франция) и определением чувствительности Candida spp. к антимикотикам (стрип-тест Etest, Франция; согласно критериям NCCLS). Для оценки эффективности терапии все больные РВВК (n=120) методом случайной выборки были разделены на 2 репрезентативные группы: в I группе (60 больных) была назначена традиционная антимикотическая терапия итраконазолом (200 мг 1 р./сут в течение 3-х дней); во II группе (60 больных) — комплексная терапия итраконазолом в сочетании с иммуномодулирующим препаратом Галавит® (ректальные суппозитории, содержащие 100 мг аминодигидрофталазиндиона натрия) по 1 свече 1 р./сут в течение 10 дней (курсовая доза — 1000 мг).
Антимикотическую терапию начинали через 48 ч после первого введения Галавита.
Клиническая эффективность терапии оценивалась по динамике симптомов заболевания, количеству рецидивов ВВК при годичном мониторинге (произошло значительное уменьшение (на ≥50%) тяжести исходных симптомов). Оценка клинических проявлений проводилась до начала терапии, через 14, 30 и 90 дней после ее окончания. С учетом однородности исследуемых групп была использована интегральная субъективно-объективная балльная оценка клинических признаков (без определения достоверной доли каждого признака): 0 баллов — отсутствие симптома, 1 балл — средняя степень выраженности симптома, 2 балла — выраженная симптоматика. Это дало возможность динамически оценить интенсивность каждого признака и общей клинической картины. Регистрация индивидуальной интегральной субъективно-объективной балльной оценки проводилась согласно методам вариационной статистики по формуле:
![]()
где БИ — интегральная балльная оценка отдельного пациента,
Б1, Б2, Бn — балльная оценка каждого признака.
Фагоцитарную активность нейтрофильных лейкоцитов периферической крови определяли по модифицированному методу И.В. Нестеровой (1992) . Концентрацию цитокинов (интерлейкина (ИЛ)-1β, ИЛ-8, фактора некроза опухоли α (ФНО-α), интерферона-γ, ИЛ-4 и ИЛ-10) в сыворотке крови и в слизи определяли твердофазным иммуноферментным методом (Caltag Laboratories, США).
Во время беременности оценивались симптомы ВВК, признаки внутриутробной инфекции (ультразвуковые маркеры, послеродовая инфекция у новорожденного), течение родов (аномалии родовой деятельности, преждевременный разрыв плодных оболочек, наличие гипоксии плода, исход родов).
Статистическая обработка полученных результатов проводилась методом вариационной статистики с использованием пакетов прикладных программ Statistica 7.0 и SPSS 16.0 for Windows с определением непараметрических критериев χ2 и Фишера с поправкой Йетса для качественных признаков, критерия Манна — Уитни и критерия Стьюдента для количественных признаков. Различия между исследуемыми группами считали достоверными при p<0,05.
Результаты и обсуждение
Анализ полученных данных не выявил прямой зависимости заболеваемости РВВК от социальных причин. Средний возраст менархе составил 12,9±0,6 года. Средний возраст полового дебюта — 18,2±1,2 года. Беременности в анамнезе имели 37,2% пациенток (из них рожавших — 29,8%), артифициальные аборты — 21,3% (рис. 1).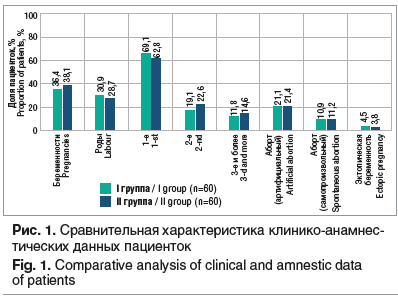
В клинике РВВК наиболее характерными жалобами были патологические выделения из половых путей, зуд, жжение, диспареуния. Объективно были выявлены характерные патологические изменения слизистой вульвовагинальной зоны: отечность, инфильтрация тканей, рыхлый белый налет, выделения творожистого или молочного характера и др. (рис. 2).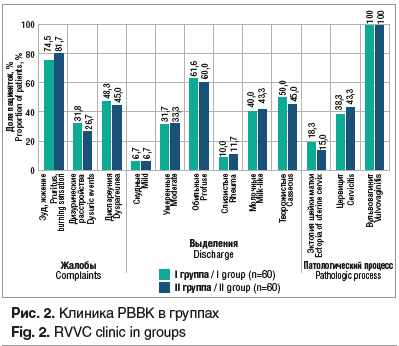
В вагинальных мазках обнаруживался мицелий или собственно клетки дрожжевых грибов. У большинства пациенток наблюдались определенные психосоматические расстройства, повлекшие за собой ухудшение качества жизни.
Микробиологическое исследование показало значительное преобладание грибов вида Candida albicans (самостоятельно и в ассоциациях — 89,8%), на втором месте — Candida glabrata (8,8%), в меньшем количестве — Candida parapsilosis и Candida tropicalis (самостоятельно и в ассоциациях — 2,1% и 3,6% соответственно) (табл. 1).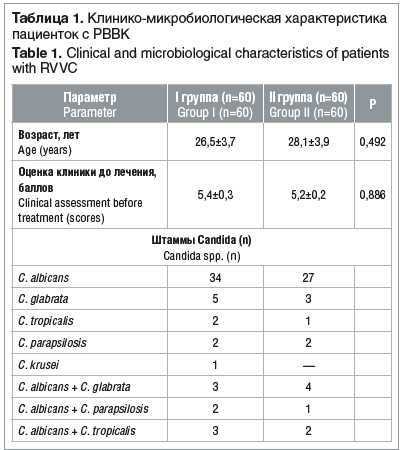
При определении in vitro чувствительности 107 изолятов дрожжей к 6 азолам (значения МПК90) чувствительность для C. albicans составила 0,25–4,0, а для non-albicans — 0,13–4,0 мкг/мл, количество резистентных штаммов — соответственно 0–6,5 и 0–46,2%. Выделенные штаммы C. albicans оказались наиболее чувствительными к буконазолу и итраконазолу (согласно критериям NCCLS). Чувствительность C. albicans к клотримазолу составила: 93,4% для C. albicans и в среднем 80,4% для non-albicans. Наименьшая чувствительность дрожжей рода Candida была зарегистрирована к флуконазолу — 85,5% у C. albicans и 59,2% для non-albicans (табл. 2). Такой состав выделенных штаммов определил выбор итраконазола в качестве антимикотика.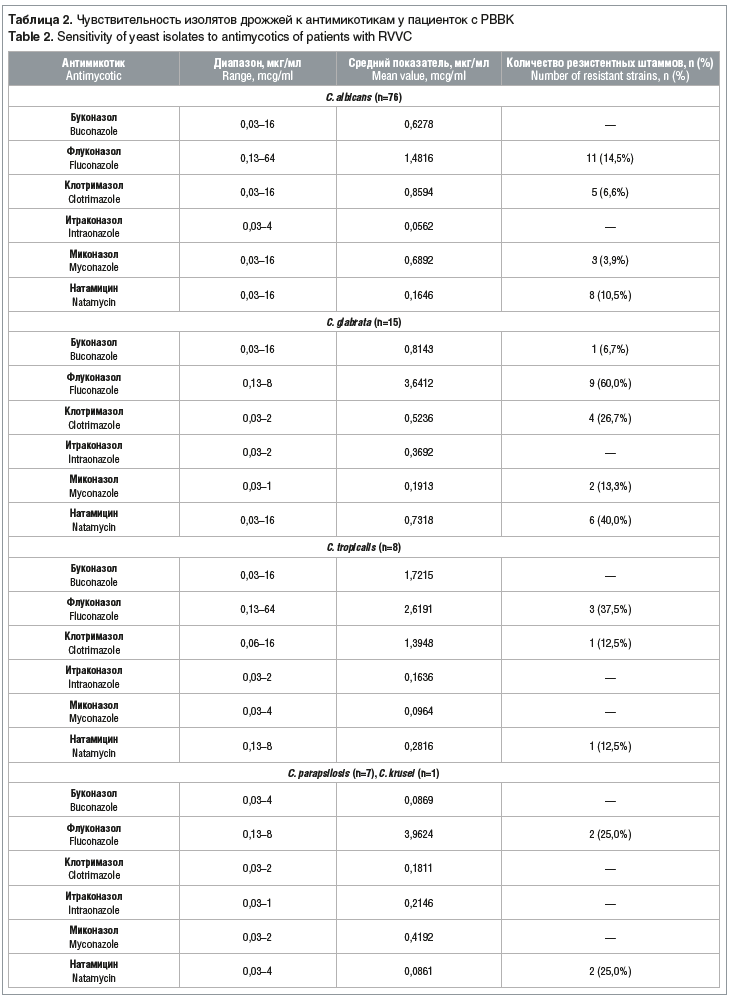
В ходе исследования 3 пациентки (2 во II группе и 1 в I группе) досрочно завершили исследование, не желая продолжать лечение. Одна женщина из I группы прекратила терапию вследствие побочных эффектов. Две пациентки (по одной из обеих групп) не явились на контрольное обследование. Таким образом, в итоге в исследовании в I группе осталось 56 женщин, во II группе — 57.
Микробиологическая эффективность на 14-й день наблюдения во II группе составила 92,9% против 80,3% в I группе. Через 30 дней различия между группами достигли 25,2% и в течение последующих 3-х мес. мониторинга оставались на этом уровне (рис. 3).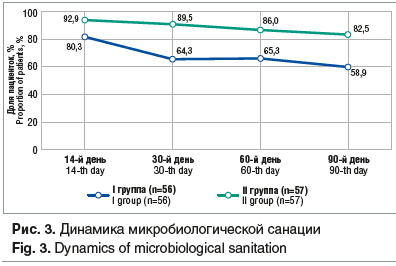
Отмечается с большой долей вероятности, что наблюдаемые рецидивы ВВК были истинными, т. к. при микробиологическом исследовании выявлялись аналогичные исходному состоянию штаммы грибов рода Candida. Но достоверные выводы по этому вопросу сделать не представляется возможным как из-за немногочисленности выборки (113 больных), так и из-за абсолютного доминирования в регионе грибов вида Candida albicans.
Таким образом, отмечается достаточно высокая микробиологическая эффективность лечения с системным применением итраконазола (I группа), но при использовании предлагаемого метода с включением иммуномодулирующего препарата, содержащего аминодигидрофталазиндион натрия (Галавит®) (II группа), она достигла практически максимально возможных результатов.
Клиническая эффективность. Частота клинического излечения на двухнедельном сроке мониторинга в I группе составила 64,2%, во II группе — 86,0%, улучшение зафиксировали 19,6% пациенток I группы и 8,8% — II группы (табл. 3). То есть неэффективность лечения составила 16,2–5,2%.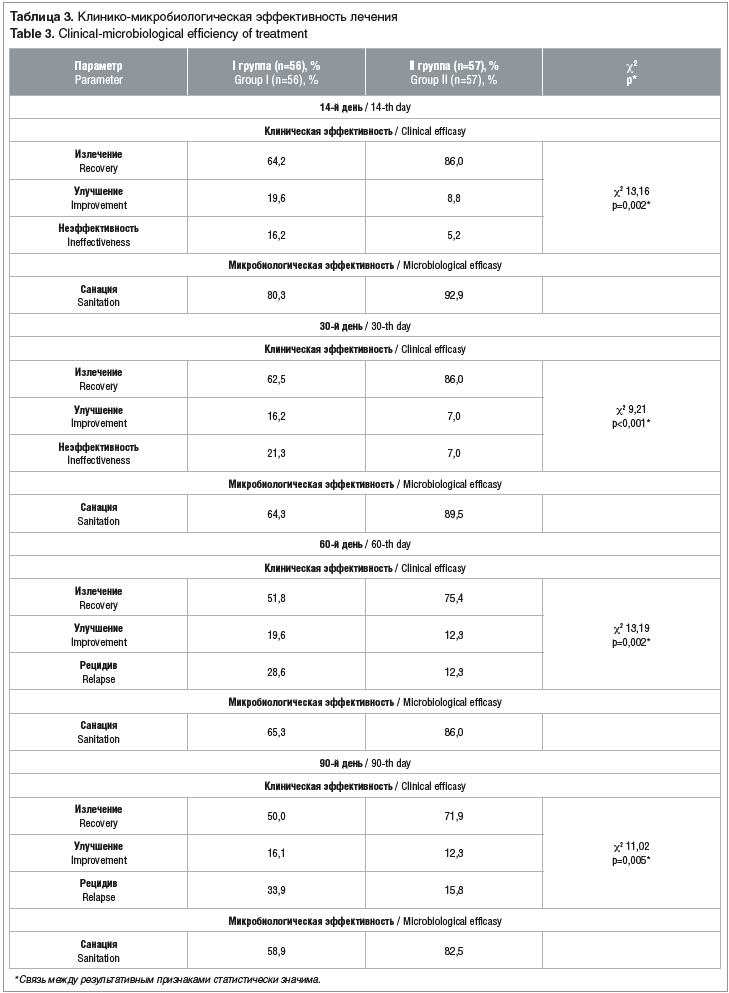
Через 30 дней полное устранение симптоматики ВВК (излечение) зафиксировали 62,5% женщин I группы и 86,0% — II группы. При этом частота рецидивов ВВК (неэффективность терапии) составила в I группе 21,3%, во II группе — 7,0%. Через 60 и 90 дней тенденция не изменилась: в I группе рецидивы ВВК составили 28,6% и 33,9% соответственно, во II группе — 12,3% и 15,8%.
Интегральная суммарная балльная оценка клинической картины показала, что на сроке наблюдения в двух группах достоверно (P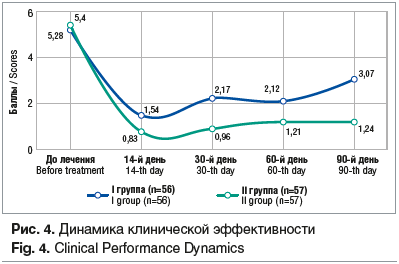
Таким образом, даже при отсутствии данных по микробиологической эффективности терапии можно дать достоверно более высокую оценку эффективности предлагаемого метода лечения (II группа). В последующие 2 мес. наблюдения отмечено существенное возрастание (до 2,17±0,22 балла, т. е. в 1,5 раза) клинических признаков ВВК у больных I группы (в основном за счет жалоб на зуд и жжение в области половых органов — в 1,8 раза; р
хотя и возросла, но незначительно (до 0,96±0,07 балла, р>0,05). Такое соотношение клинических признаков сохранялось в течение всего времени наблюдения.
Иммунологическая эффективность. Применение Галавита вызвало временное повышение концентрации лимфоцитов и микробицидной активности нейтрофильных гранулоцитов с повышением процента формазанпозитивных клеток в стимулированном NBT-тесте. То есть изменение бактерицидной активности микрофагов, с одной стороны, связано с динамикой стимулированного NBT-теста, а с другой — интенсивность спонтанного NBT-теста положительно коррелирует с концентрацией ИЛ-1β периферической крови. Применение препарата, содержащего аминодигидрофталазиндион натрия, у пациенток II группы вызывает активацию лимфоидных клеток с достоверным (р
Основными клетками, способными к фагоцитозу и элиминации грибов рода Candida, являются клетки мононуклеарно-фагоцитарной системы. Включение в терапию РВВК Галавита обеспечивает активацию макрофагальной ферментной системы с повышением активности миелопероксидазы и снижением активности кислой фосфатазы и неспецифической эстеразы. Кроме того, концентрация ИЛ-1β в цервиковагинальной слизи женщин во II группе в ходе лечения увеличилась в 24 раза, интерферона-γ — более чем в 37 раз по сравнению с исходной, концентрация ИЛ-4 снизилась в 14 раз.
Таким образом, выявлена достоверно более высокая клинико-микробиологическая и иммунологическая эффективность предлагаемого метода лечения с местным применением иммуномодулятора, содержащего аминодигидрофталазиндион натрия (Галавит®).
Беременность и роды. Как было отмечено выше, в данное исследование были включены только те больные РВВК, у которых в течение 6 мес. после лечения наступила беременность. Проведен динамический мониторинг всех пациенток, прошедших предложенную преконцепционную подготовку. Удалось выяснить, что в I группе во время беременности обострения ВВК наблюдались у 81,7% беременных, а во II группе, в которой применялся Галавит®, — только у 28,3% женщин. Ультразвуковые маркеры внутриутробного инфицирования отмечены у 56,7% беременных I группы и у 18,3% — II группы. Осложненные роды с преждевременным разрывом плодных оболочек, аномалиями родовой деятельности в I группе были в 43,3% случаев, во II группе — в 28,3%. Признаки послеродовой реализации внутриутробной инфекции выявлены у 31,7% новорожденных I группы и у 13,3% — II группы.
Заключение
Применение этиологически обоснованной системной антимикотической терапии на фоне патогенетически обоснованной иммуномодулирующей терапии Галавитом позволяет повысить клинико-микробиологическую эффективность лечения больных РВВК и провести более успешную преконцепционную подготовку.
About the authors: Borovikov Igor O. — MD, PhD, Department of Obstetrics and Gynecology. Avetisian Alina S. — clinical resident, Department of Obstetrics and Gynecology. Kuban State Medical University, Ministry of Health of Russia. 4, Sedina str., Krasnodar, 350063, Russian Federation. Contact information: Igor O. Borovikov, e-mail: bio2302@mail.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. Конфликт интересов отсутствует. Received 20.08.2018.
Литература
1. Прилепская В.Н., Байрамова Г.Р. Вульвовагинальный кандидоз. Клиника, диагностика, принципы терапии. М.: ГЭОТАР-Медиа. 2010;80 с. [Prilepskaja V.N., Bayramov G.R. Vulvovaginal candidiasis. Clinic, diagnostics, principles of therapy. M.: GEOTAR-Media. 2010;80 p. (in Russ.)].
2. Радзинский В.Е., Ордиянц И.М. Вульвовагинальный кандидоз. Новые подходы к лечению. Вопросы гинекологии, акушерства и перинатологии. 2015;4(4):113–119. [Radzinsky V.E., Ordijanc I.M. Vulvovaginal candidiasis. New approaches to treatment. Issues of Gynecology, Obstetrics and Perinatology. 2015;4(4):113–119 (in Russ.)].
3. Серов В.Н., Тютюнник В.Л. Вульвовагинальный кандидоз: особенности течения и принципы лечения. Фарматека. 2015;15(110):38–43. [Serov V.N., Tyutyunnik V.L. Vulvovaginal candidiasis: peculiarities of the current and principles of treatment. Farmateka. 2015;(110):38–43 (in Russ.)].
4. Bodey G. Candidiasis: Pathogenesis, Diagnosis and Treatment. NY: Raven Press. 2013;164.
5. Антоньев А.А., Бульвахтер А.А., Глазкова Л.К. Кандидоз кожи и слизистых оболочек. М.: Медицина, 2009. 231 с. [Antonev A.A., Bulvahter A.A., Glazkov L.K. Candidiasis skin and mucous membranes. M.: Medicine, 2009 (in Russ.)].
6. Nyirjesy P., Seeney S., Groby M. Chronic fungal vaginitis: the value of cultures. Am. J. Obstetr. Gynecol. 2015;173(3):820–823.
7. Байрамова Г.Р. Вульвовагинальный кандидоз. Рациональная фармакотерапия. Гинекология. 2016;3:7–10. [Bayramov G.R. Vulvovaginal candidiasis. Rational pharmacotherapy. Gynecology. 2016;3:7–10 (in Russ.)].
8. Анкирская А.С., Муравьева В.В. Микробиологическая характеристика инфекции влагалища, вызванной грибами рода Candida. Заболевания, передаваемые половым путем. 2011;2:12–14. [Ankirskaja A.S., Muravyev V.V. Microbiological characteristics of vaginal infection caused by fungi Candida. Sexually transmitted diseases. 2011;2:12–14 (in Russ.)].
9. Радзинский В.Е., Ордиянц И.М. Профилактика послеродовых инфекций у беременных с кандидозным вагинитом. Гинекология. 2006;4:51–53. [Radzinsky V.E., Ordijanc I.M. Prevention of postpartum infections in pregnant women with candidiasis vaginitis. Gynecology. 2006;4:51–53 (in Russ.)].
10. Alteras I., Arieli J. The incidence of Candida albicans in the last day of pregnancy and the first days of newborn. Mycopathologia. 2010;5:85–87.
11. Пестрикова Т.Ю., Юрасова Е.А., Котельникова А.В. Вульвовагинальный кандидоз: современный взгляд на проблему. РМЖ. Акушерство и гинекология. 2017;26:1965–1970. [Pestrikova T.U., Jurasova E.A., Kotelnikov A.V. Vulvovaginal candidiasis: A modern look at the problem. RMJ. Obstetrics and Gynecology. 2017;26:1965–1970 (in Russ.)].
12. Серов В.Н. Проблемы вульвовагинального кандидоза в гинекологической практике. РМЖ. 2014;6:418–422. [Serov V.N. Problems of vulvovaginal candidiasis in gynecological practice. RMJ. 2014;6:418–422 (in Russ.)].
13. Kennedy M., Sobel J. Vulvovaginal Candidiasis Caused by Non-albicans Candida Species: New Insights. Curr. Infect. Dis. Rep. 2013;12(6):465–470.
14. Ashman R., Papadimitriou J. Production and function of cytokines in natural and acquired immunity to Candida albicans infection. Microbiol Rev. 2015;59(4):646–672.
15. Сергеев А.Ю. Иммунитет при кандидозе. Иммунопатология, аллергология и инфектология. 2009;1:91–99. [Sergeyev A.Y. Immunity in Candidiasis. Immunopathology, Allergy and Infectiology. 2009;1:91–99 (in Russ.)].
16. Прилепская В.Н., Байрамова Г.Р. Вульвовагинальный кандидоз — современные пути решения проблемы. Трудный пациент. 2016;9(4):33–37. [Prilepskaja V.N., Bayramov G.R. Vulvovaginal candidiasis — modern ways to solve the problem. A difficult patient. 2016;9(4):33–37 (in Russ.)].
17. Латышева Т.В., Сетдикова Н.Х., Манько К.С. Вторичные иммунодефициты. Возможности использования отечественного иммуномодулятора Галавит. Цитокины и воспаление. 2015;3:95–99. [Latysheva T.V., Setdikova N.H., Manko K.S. Secondary immunodeficiency. possibilities of using domestic immunomodulator Galavit. Cytokines and inflammation. 2015;3:95–99 (in Russ.)].
18. Шульженко А.Е., Зуйкова И.Н. Галавит в терапии хронической рецидивирующей герпесвирусной инфекции. Новые лекарственные средства. 2013;3:23–27. [Shulzhenko A.E., Zujkova I.N. Galavit in the therapy of chronic recurrent herpesviral infection. New medicinal products. 2013;3:23–27 (in Russ.)].
19. Rauchfuss E. The immunomodulator Galavit — a new hope for cancer patients? Achievements in science and technology of research in the black sea region. 2011;11:46–48.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





